Рибосома
Содержание:
Структура белка
Так как рибосома, строение и функции которой мы разобрали в этой статье, отвечает за синтез белков, то давайте рассмотрим подробнее их структуру. Она бывает первичной, вторичной, третичной и четвертичной. Первичная структура белка — это определенная последовательность, в которой располагаются аминокислоты, формирующие данное органическое соединение. Вторичная структура белка представляет собой сформированные из полипептидных цепочек альфа-спирали и бета-складки. Третичная структура белка предусматривает определенную комбинацию альфа-спиралей и бета-складок. Четвертичная же структура заключается в формировании единого макромолекулярного образования. То есть комбинации альфа-спиралей и бета-структур формируют глобулы либо фибриллы. По этому принципу можно выделить два типа белков — фибриллярные и глобулярные.
Фибриллярные белки
Трансляция
Синтетические процессы, приводящие к образованию конечного продукта – белка — входят в группу реакций ассимиляции и называются трансляцией. Какую же роль в ней играют рибосомы? Начало биосинтеза характеризуется тем, что осуществляется инициация – соединение информационной рибонуклеиновой кислоты с малой субъединицей органоида. В клеточной цитоплазме на один из конечных участков прикрепляется рибосома, что является сигналом к процессу биосинтеза. Следующая стадия, элонгация, заключается во взаимодействии рибосомы с первыми двумя частицами РНК, называемыми транспортными. Они, подобно грузовым такси, доставляют аминокислоты к органелле, которая затем передвигается вдоль полинуклеотидной цепи.

Одновременно идет связывание аминокислот между собой с помощью пептидных связей, приводящее к наращиванию белковой молекулы. Заключительная стадия – терминация, заключается в том, что по ходу движения органеллы по и-РНК ей встречается стоп-кодон, например, УАА, УГА или УАГ. В участке названных триплетов наблюдается разрыв ковалентных связей между белком и последней т-РНК. Это приводит к освобождению пептида от полисомы. Таким образом, рибосома является ведущим компонентом клетки, обеспечивающим синтез ее белков.
В нашей статье мы выяснили, какие органические полимеры входят в состав рибосом, а также определили их роль в жизнедеятельности клетки.
Местоположения рибосомы
Рибосомы классифицированы как являющийся или «свободным» или «направляющимся мембраной».
Свободные и направляющиеся мембраной рибосомы отличаются только по их пространственному распределению; они идентичны в структуре. Существует ли рибосома в свободном или направляющемся мембраной государстве, зависит от присутствия последовательности сигнала ER-планирования на синтезируемом белке, таким образом, отдельная рибосома могла бы быть направляющейся мембраной, когда это делает один белок, но свободный в цитозоли, когда это делает другой белок.
Рибосомы иногда упоминаются как органоиды, но использование термина органоид часто ограничивается описанием подклеточных компонентов, которые включают мембрану фосфолипида, которую не делают рибосомы, будучи полностью макрочастицей. Поэтому рибосомы могут иногда описываться как «неперепончатые органоиды».
Свободные рибосомы
Свободные рибосомы могут переместиться где угодно в цитозоли, но исключены из ядра клетки и других органоидов. Белки, которые сформированы из свободных рибосом, выпускаются в цитозоль и используются в клетке. Так как цитозоль содержит высокие концентрации глутатиона и является, поэтому, уменьшающей окружающей средой, белки, содержащие двусернистые связи, которые созданы от окисленных остатков цистеина, не может быть произведен в пределах него.
Направляющиеся мембраной рибосомы
Когда рибосома начинает синтезировать белки, которые необходимы в некоторых органоидах, рибосома, делающая этот белок, может стать «направляющейся мембраной». В эукариотических клетках это происходит в области сеточки endoplasmic (ER), названной «грубым ER». Недавно произведенные полипептидные цепи вставлены непосредственно в ER рибосомой, предпринимающей векторный синтез, и тогда транспортируются к их местам назначения через секреторный путь. Связанные рибосомы обычно производят белки, которые используются в пределах плазменной мембраны или удалены из клетки через exocytosis.
Гипотезы приобретают подтверждение
Несомненно, двадцать первый век — век высоких технологий, позволяющих человеку совершать то, что раньше казалось выдумкой ученых-фантастов. И молекулярные биологи активно пользуются результатами научно-технического прогресса в своих научных изысканиях. Благодаря интенсивному развитию техники, несколько лет назад сразу обе гипотезы нашли свое экспериментальное подтверждение . С помощью самых современных технологий установили, что рибосомы модельного объекта — стволовой клетки эмбриона мыши, не обладающей таким сложным жизненным циклом, как клетки диктиостелиума или малярийного плазмодия, также гетерогенны, то есть отличаются друг от друга составом входящих в них белков. Получается, что и клетки млекопитающих содержат неодинаковые по составу рибосомы!
Дальше — больше. Оказалось, что в одной и той же клетке присутствует не одна гетерогенная популяция рибосом, как полагали ранее, а сразу несколько таких популяций! Они не сменяют друг друга, а сосуществуют одновременно. Было экспериментально доказано, что каждая из популяций преимущественно осуществляет трансляцию только определенного набора мРНК. Это означает, что рибосомы не универсальны, то есть не способны транслировать абсолютно любую молекулу мРНК, как считалось ранее. Отдельные группы рибосом взаимодействуют только с некоторыми мРНК и, следовательно, «отвечают» за синтез лишь части клеточных белков. Было доказано, что избирательность рибосом вызвана именно присутствием определенных рибосомных белков, которые, предположительно, связываются с некими регуляторными областями в мРНК. Но точный механизм этого процесса требует дальнейших исследований.
Итак, получается, что функции рибосомных белков более обширны, чем мы были склонны думать ранее! Благодаря изменениям состава рибосомы клетка может регулировать, какие гены будут «превращены» в белки, а какие нет, в соответствии с ее нуждами.
Биосинтез белков на рибосомах
Трансляция или синтез белков на рибосомах с матрицы иРНК – конечный этап преобразования генетической информации в клетках. Во время трансляции информация, закодированная в нуклеиновых кислотах, переходит в белковые молекулы со строгой последовательностью аминокислот.
Трансляция – весьма непростой этап (в сравнении с репликацией и транскрипцией). Для проведения трансляции в процесс включаются все виды РНК, аминокислот, множество ферментов, которые могут исправлять погрешности друг друга. Самые важные участники трансляции – это рибосомы.
После транскрипции, новообразованная молекула иРНК, выходит из ядра в цитоплазму. Здесь после нескольких преобразований она соединяется с рибосомой. При этом аминокислоты приводятся в действие после взаимодействия с энергетическим субстратом – молекулой АТФ.
Аминокислоты и иРНК имеют разный химический состав и без постороннего участия не могут взаимодействовать между собой. Для преодоления этой несовместимости существует транспортная РНК. Под действием ферментов аминокислоты соединяются с тРНК. В таком виде они переносятся на рибосому и тРНК, с определенной аминокислотой, прикрепляется на иРНК в предназначенном месте. Далее рибосомальные ферменты формируют пептидную связь между присоединенной аминокислотой и строящимся полипептидом. После рибосома перемещается по цепи информационной РНК, оставляя участок для прикрепления следующей аминокислоты.
Рост полипептида идет до того момента, пока рибосома не встретит «стоп-кодон», который сигнализирует об окончании синтеза. Для освобождения новосинтезированного пептида от рибосомы включаются факторы терминации, окончательно завершающие биосинтез. К последней аминокислоте прикрепляется молекула воды, а рибосома распадается на две субъединицы.
Когда рибосома продвигается дальше по иРНК, она освобождает начальный отрезок цепи. К нему снова может присоединиться рибосома, которая начнет новый синтез. Таким образом, используя одну матрицу для биосинтеза, рибосомы создают одномоментно множество копий белка.
тип
Рибосомы у прокариот
Бактерии, как Кишечная палочка, имеют более 15000 рибосом (в пропорциях это эквивалентно почти четверти сухой массы бактериальной клетки).
Рибосомы в бактериях имеют диаметр около 18 нм и состоят из 65% рибосомальной РНК и только 35% белков различных размеров, от 6000 до 75000 кДа..
Большая субъединица называется 50S, а маленькая 30S, которые в совокупности образуют структуру 70S с молекулярной массой 2,5 × 10.6 кД.
Субъединица 30S вытянута и не симметрична, тогда как 50S толще и короче.
Небольшая субъединица Кишечная палочка он состоит из 16S рибосомальной РНК (1542 основания) и 21 белка, а в большой субъединице — 23S рибосомальной РНК (2904 основания), 5S (1542 основания) и 31 белка. Белки, которые их составляют, являются основными, и их количество варьируется в зависимости от структуры..
Молекулы рибосомальной РНК вместе с белками группируются во вторичной структуре подобно другим типам РНК..
Рибосомы у эукариот
Рибосомы у эукариот (80S) крупнее, с более высоким содержанием РНК и белка. РНК длиннее и называются 18S и 28S. Как и у прокариот, в составе рибосом доминирует рибосомная РНК.
У этих организмов рибосома имеет молекулярную массу 4,2 × 10.6 кДа, и он разбит на 40S и 60S субъединицу.
Субъединица 40S содержит одну молекулу РНК, 18S (1874 основания) и около 33 белков. Аналогично, субъединица 60S содержит 28S РНК (4718 оснований), 5,8S (160 оснований) и 5S (120 оснований). Кроме того, он состоит из основных белков и кислотных белков..
Рибосомы в Аркеасе
Археи представляют собой группу микроскопических организмов, которые напоминают бактерии, но они отличаются по многим характеристикам, которые составляют отдельный домен. Они живут в разных условиях и способны колонизировать экстремальные условия.
Типы рибосом, обнаруженные у архей, сходны с рибосомами эукариотических организмов, хотя они также имеют определенные характеристики бактериальных рибосом..
Он имеет три типа молекул рибосомальной РНК: 16S, 23S и 5S, связанные с 50 или 70 белками, в зависимости от вида исследования. По размеру рибосомы архей ближе к бактериальным (70S с двумя субъединицами 30S и 50S), но по своей первичной структуре они ближе к эукариотам.
Поскольку археи обычно обитают в средах с высокими температурами и высокими концентрациями соли, их рибосомы обладают высокой устойчивостью.
Коэффициент седиментации
S или Svedbergs, относится к коэффициенту оседания частиц. Выражает связь между постоянной скоростью седиментации между приложенным ускорением. Эта мера имеет временные измерения.
Обратите внимание, что Сведберги не являются добавками, так как они учитывают массу и форму частицы. По этой причине в бактериях рибосома, состоящая из субъединиц 50S и 30S, не добавляет 80S, а также субъединицы 40S и 60S не образуют рибосому 90S.
Синтез белка
Главная функция рРНК – синтез белка и аминокислот.Биосинтез белков включает два процесса:
- транскрипцию;
- трансляцию.
Транскрипция происходит с участием ДНК. Генетическую информацию считывает фермент РНК-полимераза, образуя мРНК. Далее начинается процесс трансляции, происходящий на рибосомах.Этот процесс разделяется на три этапа:
- инициацию – начало синтеза;
- элонгацию – биосинтез;
- терминацию – завершение синтеза, отделение рибосомы.
При инициации происходит сборка рибосомы. Контактные части субъединиц называются активными центрами, между которыми располагается:
- мРНК в качестве «шаблона» синтеза;
- тРНК, осуществляющая перенос аминокислот на синтезируемую цепь;
- синтезируемый пептид, состоящий из аминокислот.
В процессе элонгации происходит удлинение полипептидной цепи за счёт присоединения аминокислот. Цепь отсоединяется от рибосомы на стадии терминации благодаря стоп-кодону – единицы генетического кода, шифрующего прекращение синтеза белка.
Рис. 3. Общая схема синтеза белка на рибосоме.
Биосинтез требует энергетических затрат. При присоединении одной аминокислоты расходуется по две молекулы АТФ (аденозинтрифосфата) и ГТФ (гуанозинтрифосфата). Кроме того, ГТФ тратится на процессы инициации и терминации.
Что мы узнали?
Из урока 9 класса кратко узнали о строении и функции рибосомы. Это важные органоиды клетки, осуществляющие биосинтез белка путём считывания информации с мРНК. Рибосомы образованы двумя частями (большой и малой), каждая из которых состоит из рибонуклеиновой кислоты и белков.
Механизм трансляции
Основная статья: Трансляция (биология)
Трансляция — синтез белка рибосомой на основе информации, записанной в матричной РНК (мРНК). У прокариот мРНК связывается с малой субъединицей рибосомы в результате взаимодействия 3′-конца 16S рРНК с комплементарной ему последовательностью Шайн — Дальгарно 5′-конца мРНК (для связывания малой субъединицы эукариотической рибосомы помимо специфического мотива в нуклеотидной последовательности мРНК, необходимо также наличие кэп-структуры на её 5′-конце). Далее происходит позиционирование стартового кодона (как правило, AUG) мРНК на малой субъединице. Дальнейшая ассоциация малой и большой субъединиц происходит при связывании инициаторной тРНК (у прокариот — это формилметионил-тРНК, обозначаемая как fMet-тРНКfMet) и при участии факторов инициации (IF1, IF2 и IF3 у прокариот; в случае эукариотических рибосом в инициации трансляции участвуют аналоги прокариотических факторов, а также дополнительные факторы). Таким образом, распознавание антикодона (в тРНК) происходит на малой субъединице.
После ассоциации, fMet-тРНКfMet находится в P- (peptidyl-) сайте каталитического (пептидилтрансферазного) центра рибосомы. Следующая тРНК, несущая на 3′-конце аминокислоту и комплементарная второму кодону на мРНК, находясь в комплексе с заряженным (GTP) фактором элонгации EF-Tu, поступает в А- (aminoacyl-) сайт рибосомы. Затем, образуется пептидная связь между формилметионином (связанным с тРНКfMet, находящейся в Р-сайте) и аминокислотой, принесённой тРНК, находящейся в А-сайте. Механизм катализа реакции транспептидации (образования пептидной связи в пептидилтрансферазном центре) до сих пор полностью не выяснен. Существует несколько гипотез, объясняющих детали этого процесса:
- Оптимальное позиционирование субстратов (induced fit)
- Исключение из активного центра воды, способной прервать образование пептидной цепи посредством гидролиза
- Участие нуклеотидов рРНК (таких как А2450 и А2451) в переносе протона
- Участие 2′-гидроксильной группы 3′-концевого нуклеотида тРНК (А76) в переносе протона
Вероятно, высокая эффективность катализа достигается сочетанием этих факторов.
После образования пептидной связи, полипептид оказывается связанным с тРНК, находящейся в А-сайте. На следующем этапе деацилированная тРНКfMet сдвигается из Р-сайта в Е-сайт (exit-), пептидил-тРНК — из А-сайта в Р-сайт, а мРНК продвигается на один триплет нуклеотидов (кодон). Этот процесс называется транслокацией и происходит с затратой энергии (GTP) при участии фактора EF-G.
Далее, тРНК, комплементарная следующему кодону мРНК, связывается с освободившимся А-сайтом рибосомы, что ведёт к повторению описанных шагов, а образуемый полипептид удлинняется на один аминокислотный остаток с каждым циклом. Стоп-кодоны (UGA, UAG и UAA) сигнализируют об окончании трансляции. Процесс окончания трансляции и освобождения готового полипетида, рибосомы и мРНК называется терминацией. У прокариот он происходит при участии факторов терминации RF1, RF2, RF3 и RRF.
Рибосома — молекулярный фильтр?
В данной статье невозможно описать все эксперименты, проведенные исследователями во время поиска ответов на эти вопросы, хотя многие из них были крайне смелыми и новаторскими и, несомненно, увлекли бы читателя. Но мы ограничимся наиболее значительными, а также опишем ключевые научные идеи, лежащие в основе современного взгляда на рибосому.
В самом начале нового тысячелетия возникла гипотеза рибосомного фильтра . Заслуга авторов этой гипотезы, Винсента Мауро и Геральда Эдельмана, в том, что они, проанализировав и обобщив накопившиеся к тому времени данные, предложили совершенно новый взгляд на рибосому и на принцип ее функционирования. Если раньше рибосома рассматривалась как пассивная структура, с машинной точностью воспроизводящая генетическую информацию, то новый взгляд, предложенный авторами, возводил рибосому в новый ранг, и теперь ей приписывалась неожиданная роль в управлении фундаментальными клеточными процессами. Она приобретала звание «фильтра», который из общего потока клеточных мРНК отсеивает некоторую часть с заданными свойствами и на их основе производит белок. Остальные же мРНК она для трансляции не использует. Авторы предложили и механизм «отсеивания».
Дело в том, что в мРНК есть не только области, кодирующие аминокислотную последовательность белка, но и области, имеющие чисто регуляторное назначение (рис. 4). С их помощью начинать синтезировать белок рибосома может по двум разным механизмам.
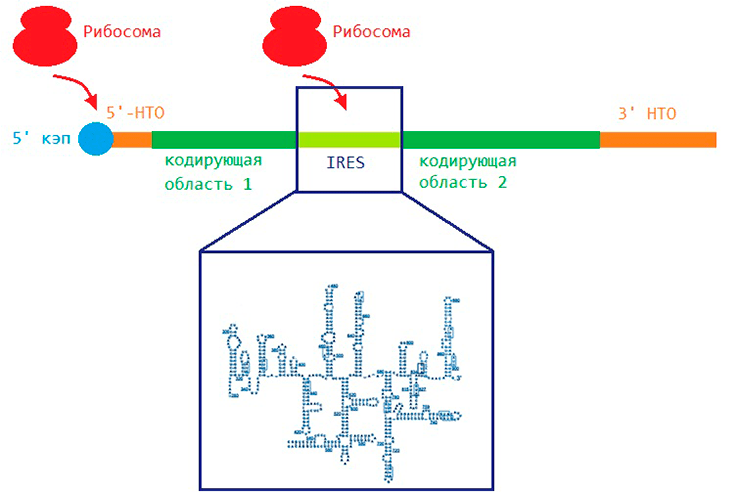
Рисунок 4. Белки могут образовываться двумя разными способами. Слева изображен кэп-зависимый механизм начала трансляции. Рибосома садится на кэп, который располагается на одном из концов мРНК, в так называемой нетранслируемой области (НТО), так как она не «переводится» в белок, а является чисто регуляторной. Справа — кэп-независимый механизм. Рибосома садится на IRES, который, благодаря своей сложной пространственной структуре (в рамке), направляет ее к старт-кодону.
рисунок автора статьи
Первый носит название кэп-зависимого, или сканирующего. На одном из концов молекулы мРНК имеется специальная структура — (молекула 7-метилгуанозина), на который перед началом синтеза садится рибосома. Сев, она движется вдоль молекулы мРНК, сканируя ее на предмет старт-кодона, кодирующего первую аминокислоту белка. Найдя старт-кодон, рибосома начинает синтез.
При втором механизме, кэп-независимом, характерном в основном для вирусов, рибосома садится на специальную область, называемую IRES (Internal Ribosomal Entry Site; в переводе с англ. — «сайт внутренней посадки рибосомы»), которая и направляет ее к старт-кодону.
Так вот, гипотеза рибосомного фильтра предполагала, что «фильтрование» происходит за счет специфического взаимодействия рибосомных белков и рРНК с определенными областями мРНК, которые могут запускать синтез белка по схожему с IRES принципу. Такие взаимодействия должны носить конкурирующий характер. Это значит, что мРНК, обладающие одинаковыми или схожими областями, будут соперничать за связывание с рибосомой, и эффективность их трансляции будет различна.
Способность клетки менять состав рибосом также имеет огромное значение для работы «фильтра». Добавление или утрата некоторых компонентов может приводить к пространственной недоступности областей рибосомы, взаимодействующих с мРНК, а значит, будет блокировать и синтез некоторых белков. Именно так, по мнению авторов гипотезы, могла меняться специфичность «фильтра».
Гипотеза рибосомного фильтра породила другую гипотезу — о специализации рибосом . Специализация — следствие гетерогенности, то есть избирательность рибосом в отношении мРНК, которая приводит к синтезу только каких-то определенных белков, закодированных в «избранных» рибосомой молекулах мРНК. К сожалению, ввиду отсутствия приборов и методов, с помощью которых можно было бы экспериментально проверить описанные идеи, эти гипотезы так и оставались гипотезами некоторое время.
функции
Рибосомы отвечают за процесс синтеза белков в клетках всех организмов, являясь универсальным биологическим механизмом..
Рибосомы — вместе с РНК-переносчиком и РНК-мессенджером — способны декодировать сообщение ДНК и интерпретировать его в последовательности аминокислот, которые образуют все белки организма, в процессе, называемом трансляцией..
В свете биологии, перевод слова относится к изменению «языка» от нуклеотидных триплетов к аминокислотам..
Эти структуры являются центральной частью трансляции, где происходит большинство реакций, таких как образование пептидных связей и высвобождение нового белка.
Трансляция белков
Процесс образования белка начинается со связывания между РНК-мессенджером и рибосомой. Посланник движется через эту структуру в определенном конце, называемом «кодон начала цепи».
Когда РНК-мессенджер проходит через рибосому, образуется молекула белка, потому что рибосома способна интерпретировать сообщение, закодированное в мессенджере..
Это сообщение закодировано в триплетах нуклеотидов, в которых каждые три основания указывают определенную аминокислоту. Например, если РНК-мессенджер несет последовательность: AUG AUU CUU UUG GCU, образованный пептид состоит из аминокислот: метионина, изолейцина, лейцина, лейцина и аланина..
Этот пример демонстрирует «вырождение» генетического кода, поскольку более одного кодона — в данном случае CUU и UUG — кодируют аминокислоту одного типа. Когда рибосома обнаруживает стоп-кодон в РНК-мессенджере, трансляция заканчивается.
Рибосома имеет сайт A и сайт P. Сайт P связывает пептидил-тРНК, а в сайт A он входит в аминоацил-тРНК..
Передача РНК
Передающие РНК ответственны за транспортировку аминокислот к рибосоме и имеют последовательность, комплементарную триплету. Для каждой из 20 аминокислот, из которых состоят белки, существует транспортная РНК..
Химические стадии синтеза белка
Процесс начинается с активации каждой аминокислоты связыванием АТФ в комплексе аденозинмонофосфата, высвобождая высокоэнергетические фосфаты..
На предыдущем этапе получается аминокислота с избыточной энергией, и происходит связывание с соответствующей ей РНК-переносчиком с образованием комплекса аминокислота-тРНК. Здесь происходит высвобождение аденозинмонофосфата.
В рибосоме трансферная РНК находит РНК-мессенджер. На этом этапе последовательность переносящей или антикодонной РНК гибридизуется с кодоном или триплетом РНК-мессенджера. Это приводит к выравниванию аминокислоты с ее правильной последовательностью.
Фермент пептидилтрансфераза ответственен за катализ образования пептидных связей, которые связывают аминокислоты. Этот процесс потребляет большое количество энергии, так как он требует образования четырех высокоэнергетических связей для каждой аминокислоты, которая связывается с цепью.
Реакция удаляет гидроксильный радикал на СООН-конце аминокислоты и удаляет водород на NH-конце2 другой аминокислоты. Реактивные области двух аминокислот связывают и создают пептидную связь.
Рибосомы и антибиотики
Поскольку синтез белка является обязательным событием для бактерий, определенные антибиотики нацелены на рибосомы и различные стадии процесса трансляции..
Например, стрептомицин связывается с небольшой субъединицей, чтобы вмешиваться в процесс трансляции, вызывая ошибки при чтении РНК-мессенджера..
Другие антибиотики, такие как неомицины и гентамицины, также могут вызывать ошибки трансляции, связанные с небольшой субъединицей..
История исследований рибосомы
Схема, показывающая цитоплазму, вместе с её компонентами (или органеллами), в типичной животной клетке. Органеллы: (1) Ядрышко (2) Ядро (3) рибосома (маленькие точки) (4) Везикула (5) шероховатый эндоплазматический ретикулум (ER) (6) Аппарат Гольджи (7) Цитоскелет (8) Гладкий эндоплазматический ретикулум (9) Митохондрия (10) Вакуоль (11) Цитоплазма (12) Лизосома (13) Центриоль и Центросома
Рибосомы впервые были описаны как уплотнённые частицы, или гранулы, американским клеточным биологом румынского происхождения Джорджем Паладе в середине 1950-х годов. В 1974 г. Джордж Паладе и Кристиан Де Дюв получили Нобелевскую премию по физиологии и медицине «за открытия, касающиеся структурной и функциональной организации клетки».
Термин «рибосома» был предложен Ричардом Робертсом в 1958 вместо «рибонуклеопротеидная частица микросомальной фракции» на первом симпозиуме, посвящённом этим частицам и их роли в биосинтезе белка. Биохимические и мутационные исследования рибосомы начиная с 1960-х позволили описать многие функциональные и структурные особенности рибосомы.
В начале 2000-х были построены модели с атомным разрешением (до 2,4 Å) структур отдельных субъединиц, а также полной прокариотической рибосомы, связанной с различными субстратами, которые позволили понять механизм декодинга (распознавания антикодона тРНК, комплементарного кодону мРНК) и детали взаимодействий между рибосомой, тРНК, мРНК, факторами трансляции, а также различными антибиотиками. Это крупнейшее достижение в молекулярной биологии было отмечено Нобелевской премией по химии 2009 года («За исследования структуры и функций рибосомы»). Награды были удостоены американец Томас Стейц, британец индийского происхождения Венкатраман Рамакришнан и израильтянка Ада Йонат. В 2010 году в лаборатории Марата Юсупова была определена трехмерная структура эукариотической рибосомы.
В 2009 году канадские биохимики Константин Боков и Сергей Штейнберг из Монреальского университета, исследовав третичную структуру рибосомной РНК бактерии Escherichia coli, высказали обоснованное предположение, что рибосомы могли сформироваться в результате постепенной эволюции из очень простой маленькой молекулы РНК — «проторибосомы», способной катализировать реакцию соединения двух аминокислот. Все остальные структурные блоки рибосомы последовательно добавлялись к проторибосоме, не нарушая её структуру и постепенно повышая эффективность её работы.
Роль рибосом в организме
- Рибосомы синтезируют белок для собственных нужд клетки и за ее пределы. Так в печени образуются плазменные факторы свертывания крови, плазмоциты продуцируют гамма-глобулины.
- Считывание закодированной информации с РНК, соединение аминокислот в запрограммированном порядке с образованием новых белковых молекул.
- Каталитическая функция – формирование пептидных связей, гидролиз ГТФ.
- Свои функции в клетке рибосомы выполняют более активно в виде полирибосом. Эти комплексы способны одновременно синтезировать несколько молекул белка.
Мал, да удал
Эта народная поговорка как нельзя лучше подходит к клеточному органоиду – рибосоме. Открытая в 1953 году, она считается мельчайшей клеточной структурой, да вдобавок не имеющей мембран. То, что рибосомы так важны, можно доказать следующим простым фактом. Все без исключения клетки: животных, растений, грибов и даже безъядерных организмов — содержат огромное количество рибосом. Синтез белков, осуществляемый ими, обеспечивает клетку белками, выполняющими в ней строительную, защитную, каталитическую, сигнальную и многие другие функции.

Размеры одной органеллы не превышают 20 нм, диаметр составляет около 15 нм, а ее форма напоминает сферическую игрушку – матрешку. Каждая субъединица формируется внутри клеточного ядра, содержащего ядрышко. Это место синтеза частиц рибосомы. Остановимся на строении белоксинтезирующего аппарата клетки подробнее.