Сколько аминокислот участвует в синтезе белка?
Содержание:
- Механизм репрессии
- Химические свойства белков.
- Новый метод синтеза белка
- Энергетика биосинтеза белка
- Процесс синтеза белка
- Условия возрождения мышц
- Биологический код
- Почему после тренировки усваивается только 30 грамм белка?
- Световая фаза фотосинтеза
- Норма потребления белка
- Каждый день погибает 167 грамм мышц
- Чтение, правка и запись
- Сколько белка вам нужно?
- Роль РНК и ДНК в процессе
- Классификация генных болезней
- Биологическое значение синтеза
Механизм репрессии
При регуляции оперона по механизму репрессии (например, гистидиновый или триптофановый опероны) белок-репрессор не имеет сродства к оператору. Когда к белку-репрессору присоединится небольшая молекула — корепрессор (гистидин или триптофан), то в результате происходящих в белковой молекуле конформационных изменений комплекс белок-репрессор—корепрессор приобретает сродство к оператору и прекращает транскрипцию.
В клетках млекопитающих существуют два вида регуляции биосинтеза белков:
• кратковременная, обеспечивающая адаптацию организма к возможным изменениям окружающей среды;
• длительная, стабильная, определяющая дифференцировку клеток и разный белковый состав органов и тканей.
В хроматине разных органов и тканей наряду с огромными транскрипционно неактивными или стабильно репрессированными участками имеются активные или потенциально активные участки. За малым исключением (лимфоциты), каждая клетка организма содержит один и тот же набор генов. Существование специализированных органов и тканей зависит от дифференциальной экспрессии генов, это означает, что в дифференцировании клетках разных тканей транскрибируются разные участки хроматина.
 Рис.4 Адаптивная регуляция транскрипции.
Рис.4 Адаптивная регуляция транскрипции.
Адаптивная регуляция у высших организмов отличается от регуляции транскрипции у прокариотов многообразием сигналов, которые контролируют 1. начало процесса на молекуле ДНК, 2. частоту, с которой он происходит.
ТАТА-участок промотора присоединяет ТАТА-связывающий белок (ТАТА-фактор), факторы транскрипции А и В, которые обеспечивают взаимодействие с РНК-полимеразой и определяют стартовую точку транскрипции (рис 4).
Минимальный синтез мРНК становится возможным после связывания РНК-полимеразы с транскрипционными факторами F, Е, Н.
Если, кроме указанных компонентов, с ТАТА-связывающим белком образуют комплекс белки, присоединенные к регуляторным участкам ДНК, то скорость транскрипции меняется. Она возрастет, если это будут белки-активаторы, обеспечивающие взаимодействие с энхансерами (усилителями), и снижается, если к ТАТА-связывающему белку присоединится белок, взаимодействующий с участком сайленсера (тушителя транскрипции).
Регуляторные зоны ДНК — энхансеры и сайленсеры — различны по числу и расположению на молекуле ДНК для разных генов в разных тканях, т.е. являются тканеспецифическими характеристиками. Они могут располагаться за тысячи нуклеотидных пар от стартовой точки транскрипции перед, после или внутри гена, связывать комплексы белков с метаболитами или гормонами и влиять на конформацию гена.
Естественный отбор и биологическая эволюция невозможны без генетической изменчивости, которая возникает за счет мутаций и рекомбинаций в процессе мейоза. В последнем случае происходит обмен участками ДНК между гомологичными хромосомами родителей.
Химические свойства белков.
1. Денатурация белка (разрушение вторичной и третичной структуры с сохранением первичной). Пример денатурации – свертывание яичных белков при варке яиц.
2. Гидролиз белков – необратимое разрушение первичной структуры в кислом или щелочном растворе с образованием аминокислот. Так можно установить количественный состав белков.
3. Качественные реакции:
Биуретовая реакция – взаимодействие пептидной связи и солей меди (II) в щелочном растворе. По окончанию реакции раствор окрашивается в фиолетовый цвет.
Ксантопротеиновая реакция — при реакции с азотной кислотой наблюдается желтое окрашивание.
Новый метод синтеза белка
Примерно за полтора года до того, как мир узнал о синтезе инсулина, в печати промелькнуло еще одно сообщение, которое вначале не привлекло особого внимания: американский ученый Р. Мэрифилд предложил новый метод синтеза пептидов. Поскольку сам автор поначалу не дал методу должной оценки, и в нем было много недоработок, выглядел он в первом приближении даже хуже существовавших. Однако уже в начале 1964 года, когда Мэрифилду удалось с помощью своего метода осуществить полный синтез 9-членного гормона с полезным выходом в 70%, ученые изумились: 70% после всех этапов — это 9% полезного выхода на каждой стадии синтеза.
Основная идея нового метода заключается в том, что растущие цепочки пептидов, которые раньше были брошены на произвол хаотического движения в растворе, теперь привязывались одним концом к твердому носителю — их как бы заставляли стать на якорь в растворе. Мэрифилд брал твердую смолу и к ее активным группам «привязывал» за карбонильный конец первую из собираемых в пептид аминокислоту. Реакции шли внутри отдельных частичек смолы. В «лабиринтах» ее молекул сначала появлялись первые короткие ростки будущего пептида. Затем в сосуд вводили вторую аминокислоту, ее молекулы сшивались своими карбонильными концами со свободными аминными концами «привязанной» аминокислоты, и в частицах вырастал еще один «этаж» будущего «здания» пептида. Так, этап за этапом, постепенно наращивался весь пептидный полимер.
Новый метод имел несомненные преимущества: прежде всего в нем была решена проблема отделения ненужных продуктов после присоединения каждой очередной аминокислоты — эти продукты легко смывались, а пептид оставался пришитым к гранулам смолы. Одновременно исключалась проблема растворимости растущих пептидов — один из главных бичей старого метода; раньше они нередко выпадали в осадок, практически переставая участвовать в процессе роста. Пептиды, «снимаемые» после окончания синтеза с твердой подложки, получались почти все одинакового размера и строения, во всяком случае, разброс в структуре был меньше, чем при классическом методе. И соответственно больше полезный выход. Благодаря этому методу синтез пептидов — кропотливый, трудоемкий синтез — легко поддается автоматизации.
Мэрифилд соорудил несложный автомат, который сам по заданной программе проделывал все положенные операции — подачу реагентов, смешивание, слив, промывку, отмер дозы, добавление новой порции и так далее. Если по старому методу на присоединение одной аминокислоты приходилось травить 2—3 дня, то Мэрифилд на своем автомате соединял за день 5 аминокислот. Разница — в 15 раз.
Энергетика биосинтеза белка
Образование белка в живых клетках тесно связано с внешними условиями и внутриклеточными потребностями. Центральной проблемой в клеточной физиологии является определение стоимости производства белка и молекулярных процессов, ограничивающих биосинтез
Это особенно важно для понимания взаимосвязей между ростом клеток, делением клеток и размером клеток. Наиболее энергозатратным процесом при синтезе белка обычно считается трансляция
Большая часть клеточного пула гуанозинтрифосфата используется для полимеризации аминокислот, тогда как значительно меньшие количество энергии используется на другие процессы, включая транскрипцию и сворачивание белков.
Процесс синтеза белка
Для того, чтобы соединить между собой две аминокислоты, надо преодолеть немало трудностей. Каждая аминокислота, подобно двуликому Янусу, имеет два химических лица: карбоксильную кислотную группу на одном конце и аминную основную группу — на другом. Если от карбоксила одной аминокислоты отнять группу ОН, а от аминной группы другой — атом водорода, то образовавшиеся при этом два аминокислотных остатка могут соединиться друг с другом пептидной связью, и в результате возникнет простейший из пептидов — дипептид. И отщепится молекула воды. Повторяя эту операцию, можно наращивать длину пептида.
Однако эта, казалось бы, на первый взгляд несложная операция практически трудноосуществима: аминокислоты очень неохотно соединяются друг с другом. Приходится их активировать, химически, и «подогревать» один из концов цепи (чаще всего карбоксильный), и вести реакцию, строго соблюдая необходимые условия. Но это еще не все: вторая сложность состоит в том, что соединяться друг с другом могут не только остатки разных аминокислот, но и две молекулы одной кислоты. При этом строение синтезируемого пептида будет уже отличаться от желаемого. Больше того, каждая аминокислота может иметь не две, а несколько «ахиллесовых пят» — боковых химически активных групп, способных присоединять аминокислотные остатки.
Чтобы не дать реакции свернуть с заданного пути, необходимо закамуфлировать эти ложные мишени — «запечатать» на время осуществляемой реакции все реакционноспособные группы аминокислоты, кроме одной, присоединив к ним так называемые защитные группировки. Если этого не сделать, то цель будет расти не только с обоих концов, но и вбок, и аминокислоты уже не удастся соединить в заданной последовательности. А ведь именно в этом и заключается смысл всякого направленного синтеза.
Но, избавляясь таким образом от одной неприятности, химики столкнулись с другой: защитные группировки после окончания синтеза нужно удалить. Во времена Фишера в качестве «защиты» применялись группировки, которые отщеплялись гидролизом. Однако реакция гидролиза обычно оказывалась слишком сильным «потрясением» для полученного пептида: с трудом построенная его «конструкция» разваливалась как только с нее снимали «строительные леса» — защитные группировки. Лишь в 1932 году ученик Фишера М. Бергманн нашел выход из этого положения: он предложил защищать аминогруппу аминокислоты карбобензоксигруппой, которую можно было удалить без повреждения пептидной цепи.
Условия возрождения мышц
Чтобы возрождение мышц было в балансе с ежедневной их гибелью, медики рекомендуют взрослым людям потреблять с пищей около 80 грамм белка или 1 грамм белка на килограмм массы тела.
Однако мы же не хотим быть обычными людьми — нам нужно выделяться мускулатурой, поэтому во многих журналах уже написано и многими прочитано, что для роста мышц нужно потреблять 1,5 или даже 2 грамма белка на килограмм массы тела. И многие уже начали практиковать такое потребление.
Но с какой стати организму синтезировать столько белка, сколько мы положили себе в рот? Что молодых атлетов заставляет думать, что за один день их организм может синтезировать 160 грамм белка, если до этого он синтезировал только 80? Часто люди на этот вопрос отвечают так: «Но я же тренируюсь!»

Биологический код
Биологический код — это способ записи информации об аминокислотной последовательности белков с помощью последовательности нуклеотидов в ДНК или РНК. Он характеризуется следующими свойствами: триплетностью, специфичностью, универсальностью, наличием терминирующих кодонов, вырожденностью .
Основными компонентами белоксинтезирующей системы являются мРНК, аминокислоты, тРНК, аминоацил-тРНК-синтетазы, рибосомы, факторы инициации, элонгации и терминации, источники энергии и кофакторы.Синтез аминоацил-тРНК (аа-тРНК) катализируют аминоацил-тРНК-синтетазы, обладающие абсолютной специфичностью к аминокислоте и относительной — к тРНК. В связи с вырожденностью кода тРНК больше, чем аминокислот, и существуют изоакцепторные тРНК, отличающиеся по строению антикодона, но связывающиеся с одной и той же аминокислотой. Название каждой из 20 аминоацил-тРНК-синтетаз отражает название аминокислоты, которая активируется в ходе этой реакции. Так, реакцию активации глутамата катализирует глутамил-тРНК-синтетаза, которая при соединяет a-СООН- группу аминокислоты к 3′-ОН-концу тРНК за счет энергии АТР.
| Необходимые компоненты | Функции |
| Аминокислоты | Субстраты для синтеза белков |
| тРНК | тРНК выполняют функцию адаптеров. Они акцепторным концом взаимодействуют с аминокислотами, а антикодоном — с кодоном мРНК |
| Аминоацил-тРНК- синтетазы | Каждая аминоацил-тРНК-синтетаза катализирует реакцию специфического связывания одной из 20 аминокислот с соответствующей тРНК |
| мРНК | Матрица содержит линейную последовательность кодонов, определяющих первичную структуру белков |
| Рибосомы | Рибонуклеопротеиновые субклеточные структуры, являющиеся местом синтеза белков |
| АТР, GTP | Источники энергии |
| Белковые факторы инициации, элонгации, терминации | Специфические внерибосомные белки, необходимые для процесса трансляции: факторы инициации, элонгации, терминации |
| Ионы магния | Кофактор, стабилизирующий структуру рибосом |
Таблица 1. Основные компоненты белоксинтезирующей системы и их функции в процессе трансляции
Почему после тренировки усваивается только 30 грамм белка?
Долгие годы я наблюдал за связью тренировок и синтезом белка и вот, что я обнаружил. Одна тонна поднятого железа на тренировках требует дополнительно одного грамма белка.
Например, восьмидесяти килограммовый атлет, который за тренировку поднимает 30 тонн сможет синтезировать только 30 грамм белка. Мое наблюдение подтвердили ученые, которые сказали, что после тренировки усваивается только 30 грамм белка. Наверное, предметы их наблюдения поднимали за тренировку 30 тонн.
Почему одна тренировка не дает прирост 150 грамм мышц?
В мышцах 20 процентов белка, как в нежирной говядине. Синтез 30 грамм белка дает прирост 150 грамм мышц.
Казалось бы, что одна тренировка способна синтезировать 30 грамм белка и 150 грамм мышц. Но что нас кормит, то и убивает. Тренировка не только стимулирует синтез белка, но на тренировке белок мышц повреждается.
В упражнениях со жгутом трудно считать тоннаж, но это силовые упражнения
Световая фаза фотосинтеза
Чтобы лучше понять, что происходит во время фотосинтеза, разберём фазы фотосинтеза. Световая фаза фотосинтеза включает в себя фотохимические и фотофизические процессы, и может быть поделена на три этапа:
- Фаза поглощения — энергия света улавливается при помощи светособирающих комплексов, переходит в энергию электронного возбуждения пигментов, передаётся в реакционный центр фотосистем I и II.
- Фаза реакционных центров — энергия электронного возбуждения пигментов светособирающих комплексов используется для активации реакционных центров фотосистем. В реакционном центре электрон от возбуждённого хлорофилла передаётся другим компонентам электрон-транспортной цепи, пигмент после отдачи электрона переходит в окисленное состояние и становится способным, в свою очередь, отнимать электроны у других веществ. Именно в этом процессе происходит преобразование физической формы энергии в химическую.
- Фаза электрон-транспортной цепи — электроны переносятся по цепи переносчиков, образуются АТФ, НАДФН, O2. Необходимо, чтобы каждый переносчик электрон-транспортной цепи поочерёдно восстанавливался и окислялся, обеспечивая таким образом перенос энергии электронов. Любой этап переноса электрона сопровождается высвобождением или поглощением энергии. Часть энергии теряется. На некоторых участках электрон-транспортной цепи перенос электрона сопряжён с переносом протона.
Для того чтобы понять, что происходит во время фазы фотосинтеза, рассмотрим эти процессы подробнее. Кванты света улавливаются светособирающими комплексами фотосистемы I — молекула хлорофилла в составе светособирающего комплекса переходит в возбуждённое состояние, и энергия передаётся в реакционный центр фотосистемы I. Происходит возбуждение молекул хлорофилла фотосистемы I, отщепляется электрон. Пройдя по цепочке внутренних компонентов фотосистемы I и внешних переносчиков, электрон в конце концов попадает к НАДФ+ — образуется восстановитель НАДФН. Получается, что хлорофилл фотосистемы I отдал электрон и приобрёл положительный заряд, и для дальнейшего функционирования необходимо восстановить нейтральность молекулы, получить электрон, чтобы закрыть «дырку». Этот электрон приходит от фотосистемы II.
На светособирающие комплексы фотосистемы II попадают кванты света — происходит возбуждение молекулы хлорофилла фотосистемы II, молекула хлорофилла отдаёт электрон и переходит в окисленное состояние. Нехватку электрона хлорофилл восполняет благодаря фотолизу воды, при этом образуется протоны H+, а также важный побочный продукт фотосинтеза — кислород. По цепи переносчиков электрон от хлорофилла фотосистемы II попадает к хлорофиллу реакционного центра фотосистемы I и восстанавливает его. Теперь этот хлорофилл может снова поглощать энергию кванта света и отдавать электрон в электрон-транспортную цепь.
Протоны, попадающие во внутритилакоидное пространство, используются для синтеза АТФ. С помощью фермента АТФ-синтазы за счёт градиента протонов образуется АТФ из АДФ и фосфата. Под градиентом понимают неравномерное распределение: во внутритилакоидном пространстве H+ больше, в строме — меньше. Поэтому частицы стремятся проникнуть в строму, переходят в неё через АТФ-синтазу, а в процессе пути сквозь белковый комплекс отдают ему часть энергии, которая и используется для синтеза АТФ.
Норма потребления белка
В среднем человек должен получать с пищей 0,8 г белка на 1 кг массы тела. Это очень относительный подсчет, так как он не учитывает ряд особенностей. Потребность белка резко возрастает при физических нагрузках, болезнях, а также в детском и молодом возрасте, когда идет активный рост и развитие.
Для того, чтобы узнать сколько белка в продуктах, которые входят в ваш привычный рацион необходимо прочитать состав, указанный на упаковке или ознакомиться с таблицами БЖУ.
Учитывая разнообразие пищи в современном мире трудно представить себе, что могут быть проблемы с дефицитом белка. Тем не менее такие ситуации иногда возникают. Есть разные направления в культуре питания. Речь идет о людях, добровольно отказавшихся от мяса, рыбы и продуктов животноводства.
В мясе и рыбе можно найти весь комплект аминокислот, как заменимых, так и незаменимых. В диетологии даже есть такой термин, как “полный” и “неполный” белок. О мясе, продуктах животноводства и рыбе можно сказать, что они содержат полный белок. А вот растительные продукты, содержат не полный набор аминокислот, хотя есть овощи и грибы, в которых белка содержится большое количество. Это соя (30% белка), грибы, чечевица и фасоль (25-28% белка).
Настоящим кладезем незаменимых аминокислот являются белок яиц, молоко и молочные продукты. Вегетарианцы, включив их в свой рацион запросто компенсируют дефицит. В этом плане сложнее веганам. Диетологи рекомендуют в качестве альтернативы включить в свой рацион сочетания продуктов – грибы + злаки, грибы + овощи, бобовые + злаки, бобовые + орехи. Но это только теория. Вопрос – могут ли эти продукты заменить животный белок — остается открытым.

И напоследок несколько полезных советов по употреблению белка для спортсменов и худеющих:
- Белковую пищу лучше употреблять во второй половине дня. Белки долго перевариваются, поэтому надолго обеспечат чувство сытости. Как известно, многие боятся ночных и вечерних “срывов” диеты. Белки могут предупредить такие ситуации. Но не стоит наедаться белковой пищей на ночь. Непереваренная пища, попадая в толстый кишечник начинает гнить, что дает дополнительную нагрузку на печень. В итоге нарушится сон. И утро будет “не добрым”.
- Если вы хотите стать обладателем спортивной фигуры, то белок нужно употреблять за 1 час до тренировки и через 20 минут после.
- Если вы мечтаете о стройности, то перед тренировкой нужно воздержаться от белковой пищи за 5 часов до физической нагрузки, и начать прием через 2 часа после.
Следите за своим питанием и будьте здоровы!
Каждый день погибает 167 грамм мышц
Превращение пищевого протеина в мышечный — это магия природы, которую веками разгадывают ученые. После того, как вы положили высоко-белковую еду в рот, она неизбежно пойдет двумя путями: либо в мышцы, либо в сточные воды. Чтобы белок пошел в мышцы нужны условия для синтеза мышечного белка.
Надо признать, что у всех людей белок синтезируется, так как это необходимо для сохранения уже имеющихся мышц, внутренних органов, да вообще всего тела.
У обычных людей на теле около 30 кг мышц. Ежедневно часть этих мышц исчезает — если быть точнее, то 167 грамм, — но столько же восстанавливается, я бы сказал возрождается.
Сколько нам действительно нужно белка в пище с учтом професии и уровня тренировок? — статья доступна после регистрации. Рекламный ролик статьи — 30 сек:
Чтение, правка и запись
Кроме секвенирования нового поколения появились и другие технологии, изменившие правила игры. Мы уже упоминали о технологиях, позаимствованных у природы, которые легли в основу новой отрасли — генной инженерии: о ферментах рестриктазах и лигазах, разрезающих и сшивающих ДНК. Однако за 40 с лишним лет генная инженерия значительно увеличила свой арсенал инструментов. В частности, гены теперь можно редактировать не в пробирке, а прямо внутри живых систем.
Общий принцип работы инструментов для такого редактирования — узнавание целевой последовательности ДНК и внесение разрыва в выбранном месте с помощью фермента нуклеазы. Следующий этап — починка (репарация) поврежденной ДНК, его выполняет сама живая клетка. При этом и возникает запланированное изменение последовательности в ДНК — удаление части ДНК или, скажем, замена мутации на нормальную последовательность гена (для замены системе репарации нужен участок ДНК без мутации, внесенный извне или уже находящийся в клетке, например копия того же гена в другой хромосоме, см. «Химию и жизнь» № 9, 2017).
Одним из первых популярных редактирующих инструментов стала система TALEN — белок-химера, состоящий из нуклеазы и пришитого к ней ДНК-связывающего домена, который распознает участок генома, выбранный для редактирования. ДНК-связывающий домен собирают, как конструктор из деталей, заново для каждой целевой последовательности; кроме того, систему TALEN трудно доставить в клетки. Но затем появилась альтернатива, система CRISPR-Cas9. Белок Cas9 — тоже нуклеаза, но распознавание нужного участка обеспечивает не белок, а направляющая РНК, комплементарная этому участку. Синтез РНК куда менее трудоемкая задача, чем конструирование ДНК-связывающего белка, поэтому система CRISPR-Cas9 стала одной из самых перспективных технологий редактирования генома, дав начало волне новых исследований, от метаболической инженерии микроорганизмов (перестройки обмена веществ в бактериальной клетке) до лечения наследственных заболеваний человека.
Параллельно развивались и методы химического синтеза ДНК, его стоимость тоже снижалась, автоматизация же позволила строить длинные цепи ДНК. В 2008 году синтезировали молекулу ДНК длиной в 582 970 пар нуклеотидов, о чем существует запись в книге рекордов Гиннесса. Молекула была геномом бактерии Mycoplasma genitalium, а работа проводилась под руководством Крейга Вентера. В 2010 году та же группа ученых опубликовала результаты еще более интересного эксперимента. Синтезированный с нуля геном другого вида микоплазмы — M. mycoides длиной около 1,1 миллиона пар нуклеотидов пересадили в бактерию третьего вида, M. capricolum, из которой предварительно изъяли ее собственный генетический материал. Полученный организм — первое в мире живое существо с синтетическим геномом — продемонстрировал характеристики вида M. mycoides. Очевидно, именно после этого в научном сообществе и медийном пространстве стал активно использоваться термин «синтетическая биология».
Следующая цель Крейга Вентера и его коллег еще более амбициозна: создание организма с набором генов, не встречающихся в природе. Пока что они сконструировали клетку с минимальным геномом, удалив несущественные для выживания участки из генома M. mycoides. Результат нескольких лет экспериментов — M. mycoides JCV-syn3.0 — был представлен научной общественности в 2016 году. У этой вполне жизнеспособной бактерии осталось всего 473 гена, тогда как 428 генов исследователи смогли удалить (см. «Химию и жизнь № 5, 2016). Можно представить, что на основе подобных организмов специалисты когда-нибудь будут конструировать бактерий с нужными свойствами, добавляя дополнительные гены к «минимальной конфигурации».
Сколько белка вам нужно?
Необходимое количество белка зависит от нескольких факторов, но одним из самых важных является уровень активности.
Основная рекомендация по потреблению белка составляет 0,8 г на килограмм для нетренированных здоровых взрослых. Например, человек массой 68 кг должен потреблять около 54 г белка в день.
Однако этого количества достаточно только для предотвращения дефицита белка. Это не оптимум, особенно для спортсменов, которые тренируются регулярно и тяжело.
Для людей интенсивно тренирующихся потребность в белках может повышаться примерно до 1,4-2,0 г/кг массы тела. Наш гипотетический человек весом 68 кг, таким образом, должен получать около 95-135 г белка в день.
Это предполагаемое количество – то, что необходимо для базового синтеза белка (другими словами, создание новых белков из отдельных строительных блоков). Нам нужно потреблять в течение дня для синтеза белка не более 1,4-2,0 г/кг веса тела.
Но подождите!
Помимо предотвращения дефицита и обеспечения базового синтеза нам может потребоваться еще больше белка для оптимального функционирования иммунной системы, метаболизма, поддержания чувства сытости, управления весом и сохранения силы. Другими словами, нам нужно небольшое количество белка, чтобы выжить, но нам нужно намного больше, чтобы процветать.
Как показано на приведенном ниже графике, запасы белка в организме колеблются в течение дня
Обратите внимание, что верхний предел всегда одинаковый; количество белка в организме просто циклично повышается и снижается по мере того как мы его потребляем или тратим
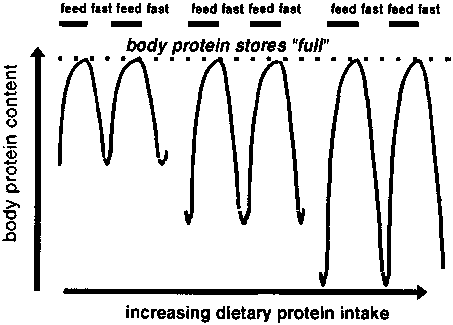 (сбоку) Содержание белка в организме (сверху вниз) потребление голодание потребление голодание потребление голодание потребление голодание потребление голодание потребление голодание запасы белка в организме максимальные повышение потребления белка
(сбоку) Содержание белка в организме (сверху вниз) потребление голодание потребление голодание потребление голодание потребление голодание потребление голодание потребление голодание запасы белка в организме максимальные повышение потребления белка
Главное: вы не можете просто съесть полкило стейка за раз и забыть о протеине. Телу нужно, чтобы белковый пул постоянно пополнялся, а для этого вы должны потреблять умеренное количество белка через регулярные промежутки времени.
Потребление большего количества протеина поддерживает оптимальный состав тела (другими словами, вы остаетесь более «компактным» и более мускулистым), сильный иммунитет, хорошую работоспособность и здоровый обмен веществ. Он способствует насыщению (т.е. вы чувствуете себя сытыми дольше) и, следовательно, управляет весом тела.
Долгое время профессиональные спортсмены, в частности, бодибилдеры, ориентировались на правило: «2,2 г белка на 1 кг веса». То есть 150 г для спортсмена весом 68 кг.
Роль РНК и ДНК в процессе
Итак, запускает синтез белков в клетках цепочка ДНК, которая несет информацию о каком-либо конкретном белке и называется геном. Цепочка ДНК в процессе транскрипции расплетается, то есть её спираль начинает распадаться в линейную молекулу. С ДНК информация должна преобразоваться на РНК. Напротив тимина в данном процессе должен становиться аденин. Цитозин же имеет в качестве пары гуанин, точно так же, как ДНК. Напротив аденина РНК становится урацил, потому как в РНК такого нуклеотида, как тимин, не существует, он заменяется просто урациловым нуклеотидом. С гуанином соседствует цитозин. Напротив аденина становится урацил, а в паре с тимином располагается аденин. Эти молекулы РНК, которые становятся напротив, называются информационными РНК (иРНК). Они способны через поры выходить из ядра в цитоплазму и рибосомы, которые, собственно, и выполняют функцию синтеза белков в клетках.
Классификация генных болезней
В основу классификации генных болезней положены 3 принципа: генетический, клинический и патогенетический.
Патогенетическая классификация зависит от поражения основного патогенетического звена.
В связи с функциональной значимостью первичных продуктов генные болезни делятся на:
1.наследственные нарушения ферментных систем или энзимопатии;
2.дефекты белков крови или гемоглобинопатии;
3.дефекты структурных белков или коллагеновые болезни;
4.генные болезни с невыясненным первичным биохимическим дефектом.
В последнее время стали рассматривать 5 категорию, к которой относятся болезни накопления (недостаток лизосомальных ферментов), а также митохондриальные и пероксисомные болезни, определяющие патологию функции и обмена клеточных органелл.
Биологическое значение синтеза
Между двумя аминокислотами, находящимися на концах «клеверов» каждого триплета, образуется пептидная связь. На этом этапе транспортная РНК уходит в цитоплазму. К триплетам присоединяется затем следующая транспортная РНК с другой аминокислотой, которая образует с предыдущими двумя полипептидную цепь. Этот процесс повторяется до момента, когда набирается необходимая последовательность аминокислот. Таким образом происходит синтез белка в клетке, и образуются ферменты, гормоны, кровяные вещества и т. д. Не во всякой клетке образуется любой белок. Каждая клетка может образовать определенный белок. Например, в эритроцитах будет образовываться гемоглобин, а клетками поджелудочной железы будут синтезироваться гормоны и разнообразные ферменты, расщепляющие пищу, которая попадает в организм.
В мышцах же будет образовываться белок актин и миозин. Как видно, процесс синтеза белка в клетках многоэтапен и сложен, что говорит о его значимости и необходимости для всего живого.