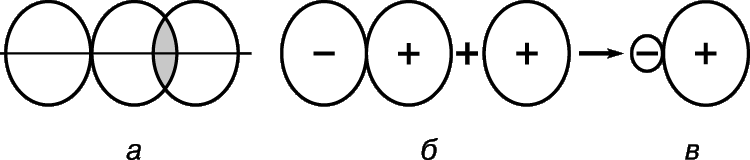Нейтрон
Содержание:
От УР к «Протону»
На самом деле воспринимаемый сейчас как самостоятельная разработка «Протон» был частью большого проекта Опытного конструкторского бюро №52 (ОКБ-52) под руководством Владимира Челомея. В начале шестидесятых годов прошлого века, на самой заре мировой космонавтики, Советскому Союзу требовались ракеты, способные выводить на орбиту большую нагрузку. Военные одновременно с этим требовали баллистическую ракету с возможностью доставки боеголовки мощностью более сотни мегатонн. Над проектами таких ракет, способных удовлетворить как военных, так и гражданскую космонавтику, работали сразу несколько конструкторских бюро, включая КБ Михаила Янгеля и Сергея Королева.
Для решения поставленной задачи ОКБ-52 предложило проект, состоящий из четырех ракет различной грузоподъемности: УР-100 и УР-200 (УР — универсальная ракета) для использования в качестве баллистических ракет, УР-500 для вывода на орбиту космических аппаратов большой массы и УР-700 как возможный вариант носителя для советской лунной миссии. Ракеты были во многом унифицированы между собой, в черновом варианте УР-500 вообще состояла из четырех ракет УР-200, соединенных между собой и третьей ступени, созданной опять-таки из ракеты УР-200. Подобная взаимозаменяемость и унификация должна была облегчить производство и ускорить технологический процесс: создавать одинаковые ступени всегда проще.
Протон

Межконтинентальная баллистическая ракета УР-100
Фото: РИА Новости/Сергей Казак
КБ Сергея Королева оказалось быстрее, предложив свою разработку Р-9 в качестве баллистической ракеты и Н-1 в качестве перспективного лунного носителя. По Н-1 почти сразу начались работы — строилась стартовая площадка и сборочные цеха. «Лунная гонка» между СССР и США требовала максимально быстрых решений. Авторитет главного конструктора Сергея Королева был непререкаемым, поэтому подвинуть Н-1 у челомеевской УР-700 не было никаких шансов. Но вскоре Королев умер, и, как мы знаем, Н-1 в итоге так и не полетела — все четыре запуска закончились аварией. Схема советской сверхтяжелой ракеты Н-1 оказалась слишком сложной для того времени, а экономия на создании испытательного стенда не позволила своевременно выявить и решить технические проблемы. История не терпит сослагательного наклонения, но если бы главной лунной ракетой была выбрана УР-700, история советской космонавтики могла бы пойти по-другому.
В итоге Челомею удалось отстоять лишь проект УР-500, кардинально изменившийся к тому времени. Ступени было решено располагать последовательно, друг над другом. В качестве второй ступени использовались модифицированные УР-200. Топливной парой для УР-500 была выбрана комбинация несимметричного диметилгидразина и азотного тетроксида — оба элемента были чрезвычайно токсичными, но обладали нужными характеристиками и высокой по тем временам энергетической эффективностью. Об экологии в тот момент не думали, гораздо важнее было создать ракету вовремя.
Протон

Ракета-носитель УР-500 «Протон» с космическим аппаратом «Фобос-2» в монтажно-испытательном корпусе космодрома Байконур. 7 июля 1988 года
Фото: ТАСС/Альберт Пушкарев
Проектирование и создание УР-500 велось в практически недостижимые по сегодняшним меркам сроки. Ракета была полностью разработана менее чем за три года силами сразу нескольких НИИ. Химкинское КБ энергетического машиностроения под руководством Глушко предоставило двигатели первой ступени РД-253, воронежское КБ химавтоматики разработало двигатели второй и третьей ступени. Всего же над созданием ракеты работали более десяти ведущих организаций, разбросанных по всему Союзу, а общее число смежников исчислялось сотнями.В 1964 году началось создание наземной инфраструктуры на Байконуре, а уже 16 июля 1965 года состоялся первый запуск УР-500 со спутником «Протон-1». У ракеты еще не было устоявшегося имени, а в теле- и радиопередачах ее называли по названию выводимой полезной нагрузки. Так за УР-500 закрепилось название «Протон». Тогда же и началась многолетняя история самой популярной советской тяжелой ракеты «Протон», хотя изначально создатели думали о том, чтобы назвать ее «Атлантом» или «Геркулесом».
Определение числа нейтронов
Для определения числа нейтронов N в ядре нужно воспользоваться формулой:
N=A-Z, где А – массовое число; Z – заряд ядра, который равняется числу протонов (порядковому номеру химического элемента в таблице Менделеева).
Как правило, параметры ядра записывают так: сверху – массовое число, а слева внизу от символа элемента прописывают заряд ядра.
Это выглядит так:
Данная запись обозначает следующее:
- Массовое число равняется 31;
- Заряд ядра (и как следствие, и число протонов) для атома фосфора равняется 15;
- Число нейтронов равно 16. Его высчитывают так: 31-15=16.
Массовое число примерно соответствует относительной атомной массе ядра. Это вызвано тем, что массы нейтрона и протона практически не имеют отличий.
Электронные формулы элементов первых четырех периодов
Рассмотрим заполнение электронами оболочки элементов первых четырех периодов. У водорода заполняется самый первый энергетический уровень, s-подуровень, на нем расположен 1 электрон:
+1H 1s1 1s
У гелия 1s-орбиталь полностью заполнена:
+2He 1s2 1s
Поскольку первый энергетический уровень вмещает максимально 2 электрона, у лития начинается заполнение второго энергетического уровня, начиная с орбитали с минимальной энергией — 2s. При этом сначала заполняется первый энергетический уровень:
+3Li 1s22s1 1s 2s
У бериллия 2s-подуровень заполнен:
+4Be 1s22s2 1s 2s
Далее, у бора заполняется p-подуровень второго уровня:
+5B 1s22s22p1 1s 2s 2p
У следующего элемента, углерода, очередной электрон, согласно правилу Хунда, заполняет вакантную орбиталь, а не заполняет частично занятую:
+6C 1s22s22p2 1s 2s 2p
Попробуйте составить электронную и электронно-графическую формулы для следующих элементов, а затем можете проверить себя по ответам конце статьи:
5. Азот
6. Кислород
7. Фтор
У неона завершено заполнение второго энергетического уровня:
+10Ne 1s22s22p6 1s 2s 2p
У натрия начинается заполнение третьего энергетического уровня:
+11Na 1s22s22p63s1 1s 2s 2p 3s
От натрия до аргона заполнение 3-го уровня происходит в том же порядке, что и заполнение 2-го энергетического уровня. Предлагаю составить электронные формулы элементов от магния до аргона самостоятельно, проверить по ответам.
8. Магний
9. Алюминий
10. Кремний
11. Фосфор
12. Сера
13. Хлор
14. Аргон
А вот начиная с 19-го элемента, калия, иногда начинается путаница — заполняется не 3d-орбиталь, а 4s. Ранее мы упоминали в этой статье, что заполнение энергетических уровней и подуровней электронами происходит по энергетическому ряду орбиталей, а не по порядку. Рекомендую повторить его еще раз. Таким образом, формула калия:
+19K 1s22s22p63s23p64s11s 2s 2p3s 3p4s
Для записи дальнейших электронных формул в статье будем использовать сокращенную форму:
+19K 4s1 4s
У кальция 4s-подуровень заполнен:
+20Ca 4s2 4s
У элемента 21, скандия, согласно энергетическому ряду орбиталей, начинается заполнение 3d-подуровня:
+21Sc 3d14s2 4s 3d
Дальнейшее заполнение 3d-подуровня происходит согласно квантовым правилам, от титана до ванадия:
+22Ti 3d24s2 4s 3d
+23V 3d34s2 4s 3d
Однако, у следующего элемента порядок заполнения орбиталей нарушается. Электронная конфигурация хрома такая:
+24Cr 3d54s1 4s 3d
В чём же дело? А дело в том, что при «традиционном» порядке заполнения орбиталей (соответственно, неверном в данном случае — 3d44s2) ровно одна ячейка в d-подуровне оставалась бы незаполненной. Оказалось, что такое заполнение энергетически менее выгодно. А более выгодно, когда d-орбиталь заполнена полностью, хотя бы единичными электронами. Этот лишний электрон переходит с 4s-подуровня. И небольшие затраты энергии на перескок электрона с 4s-подуровня с лихвой покрывает энергетический эффект от заполнения всех 3d-орбителей. Этот эффект так и называется — провал или проскок электрона. И наблюдается он, когда d-орбиталь недозаполнена на 1 электрон (по одному электрону в ячейке или по два).
У следующих элементов «традиционный» порядок заполнения орбиталей снова возвращается. Конфигурация марганца:
+25Mn 3d54s2
Аналогично у кобальта и никеля. А вот у меди мы снова наблюдаем провал (проскок) электрона — электрон опять проскакивает с 4s-подуровня на 3d-подуровень:
+29Cu 3d104s1
На цинке завершается заполнение 3d-подуровня:
+30Zn 3d104s2
У следующих элементов, от галлия до криптона, происходит заполнение 4p-подуровня по квантовым правилам. Например, электронная формула галлия:
+31Ga 3d104s24p1
Формулы остальных элементов мы приводить не будем, можете составить их самостоятельно и проверить себя в Интернете.
Некоторые важные понятия:
Внешний энергетический уровень — это энергетический уровень в атоме с максимальным номером, на котором есть электроны. Например, у меди (3d104s1) внешний энергетический уровень — четвёртый.
Валентные электроны — электроны в атоме, которые могут участвоват ьв образовании химической связи. Например, у хрома (+24Cr 3d54s1) валентными являются не только электроны внешнего энергетического уровня (4s1), но и неспаренные электроны на 3d-подуровне, т.к. они могут образовывать химические связи.
Что такое протон?
Все, чего вы можете коснуться и чувствовать, состоит из атомов. Размер этих крошечных частиц внутри центра атома очень маленький. Хотя они составляют большую часть веса атома, но они все же очень малы. Фактически, если бы атом был размером с футбольное поле, каждый из его протонов был бы только размером с муравья. Протоны не должны ограничиваться ядрами атомов. Когда протоны находятся за пределами атомных ядер, они приобретают увлекательные, причудливые и потенциально опасные свойства, аналогичные свойствам нейтронов в подобных обстоятельствах.
Но протоны обладают дополнительным свойством. Поскольку они несут электрический заряд, их можно ускорить электрическими или магнитными полями. Высокоскоростные протоны и атомные ядра, содержащие их, выделяются в больших количествах во время солнечных вспышек. Частицы ускоряются магнитным полем Земли, вызывая ионосферные возмущения, известные как геомагнитные бури.

Основные характеристики
-
Масса (примерно на 0,1378 % больше, чем масса протона; приведены рекомендованные значения CODATA 2014 года, в скобках указана погрешность величины в единицах последней значимой цифры, одно стандартное отклонение):
- 939,565 420 52(54) МэВ;
- 1,008 664 915 95(49) а. е. м.;
- 1,674 927 498 04(95)⋅10−27 кг;
- 1 838,683 661 73(89) массы электрона.
- Электрический заряд: 0. Экспериментально измеренное значение совместимо с нулём: (−0,2 ± 0,8)⋅10−21элементарного электрического заряда.
- Спин: 1⁄2 (фермион). Спин свободного нейтрона измеряется методом когерентного отражения от магнитных зеркал.
- Время жизни в свободном состоянии: τ = 880,0 ± 0,9 секунды (период полураспада T1/2 = τ·ln 2 = 610,0 ± 0,6 секунды).
- Магнитный момент: −1,913 042 73(45) ядерного магнетона, или −9,662 365 1(23)×10−27Дж/Тл. Магнитный момент нейтрона измеряется с помощью резонансного метода молекулярных пучков.
- Внутренняя чётность: равна 1.
Несмотря на нулевой электрический заряд, нейтрон не является истинно нейтральной частицей. Античастицей нейтрона является антинейтрон, который не совпадает с самим нейтроном. Нейтрон аннигилирует с антинейтроном и другими антиадронами (в частности, с антипротоном).
С нейтроном связаны несколько физических величин, имеющих размерность длины:
- комптоновская длина волны нейтрона λK=2πℏmc≈1,32⋅10−13{\displaystyle \lambda _{K}={\frac {2\pi \hbar }{mc}}\approx 1{,}32\cdot 10^{-13}} см;
- расстояние от центра нейтрона до максимума плотности отрицательного электрического заряда (зарядовый радиус) RE≈,75⋅10−13{\displaystyle R_{E}\approx 0{,}75\cdot 10^{-13}} см;
- отношение электрического дипольного момента нейтрона к элементарному заряду |dne|<2,9⋅10−26{\displaystyle \left|{\frac {d_{n}}{e}}\right|<2{,}9\cdot 10^{-26}} см;
- гравитационный радиус нейтрона RG=2Gmc2≈2,48⋅10−52{\displaystyle R_{G}={\frac {2Gm}{c^{2}}}\approx 2{,}48\cdot 10^{-52}} см.
Электронные формулы ионов
Атомы могут отдавать и принимать электроны. Отдавая или принимая электроны, они превращаются в ионы.
Ионы — это заряженные частицы. Избыточный заряд обозначается индексом в правом верхнем углу.
Если атом отдаёт электроны, то общий заряд образовавшейся частицы будет положительный (вспомним, что число протонов в атоме равно числу электронов, а при отдаче электронов число протонов будет больше числа электронов). Положительно заряженные ионы — это катионы. Например: катион натрия образуется так:
+11Na 1s22s22p63s1 -1е =+11Na+ 1s22s22p63s
Если атом принимает электроны, то приобретает отрицательный заряд. Отрицательно заряженные частицы — это анионы. Например, анион хлора обраузется так:
+17Cl 1s22s22p63s23p5 +1e = +17Cl— 1s22s22p63s23p6
Таким образом, электронные формулы ионов можно получить добавив или отняв электроны у атома
Обратите внимание, при образовании катионов электроны уходят с внешнего энергетического уровня. При образовании анионов электроны приходят на внешний энергетический уровень
Попробуйте составить самостоятельно электронный формулы ионов. Не забывайте проверять себя по ключам!
18. Ион Са2+
19. Ион S2-
20. Ион Ni2+
В некоторых случаях совершенно разные атомы образуют ионы с одинаковой электронной конфигурацией. Частицы с одинаковой электронной конфигурацией и одинаковым числом электронов называют изоэлектронными частицами.
Например, ионы Na+ и F—.
Электронная формула катиона натрия: Na+ 1s22s22p6, всего 10 электронов.
Электронная формула аниона фтора: F— 1s22s22p6, всего 10 электронов.
Таким образом, ионы Na+ и F— — изоэлектронные. Также они изоэлектронны атому аргона.
Ответы на вопросы:
1. У изотопов одного химического элемента массовое число всегда разное, т.к. массовое число складывается из числа протонов и нейтронов. А у изотопов различается число нейтронов.
2. У изотопов одного элемента число протонов всегда одинаковое, т.к. число протонов характеризует химический элемент.
3. Массовое число изотопа брома-81 равно 81. Атомный номер = заряд ядра брома = число протонов в ядре = 35. Вычитаем из массового числа число протонов, получаем 81-35=46 нейтронов.
4. Массовое число изотопа хлора равно 37. Атомный номер, заряд ядра и число протонов в ядре равно 17. Получаем число нейтронов = 37-17 =20.
5. Электронная формула азота:
+7N 1s22s22p3 1s 2s 2p
6. Электронная формула кислорода:
+8О 1s22s22p4 1s 2s 2p
7. Электронная формула фтора:

8. Электронная формула магния:
+12Mg 1s22s22p63s2 1s 2s 2p 3s
9. Электронная формула алюминия:
+13Al 1s22s22p63s23p1 1s 2s 2p 3s 3p
10. Электронная формула кремния:
+14Si 1s22s22p63s23p2 1s 2s 2p 3s 3p
11. Электронная формула фосфора:
+15P 1s22s22p63s23p3 1s 2s 2p 3s 3p
12. Электронная формула серы:
+16S 1s22s22p63s23p4 1s 2s 2p 3s 3p
13. Электронная формула хлора:

14. Электронная формула аргона:
+18Ar 1s22s22p63s23p6 1s 2s 2p 3s 3p
15. Электронная формула углерода в возбуждённом состоянии:
+6C* 1s22s12p3 1s 2s 2p
16. Электронная формула бериллия в возбуждённом состоянии:
+4Be 1s22s12p1 1s 2s 2p
17. Электронная формула кислорода в возбуждённом энергетическом состоянии соответствует формуле кислорода в основном энергетическом состоянии, т.к. нет условий для перехода электрона — отсутствуют вакантные энергетические орбитали.
18. Электронная формула иона кальция Са2+: +20Ca2+ 1s22s22p63s23p6
19. Электронная формула аниона серы S2-: +16S2- 1s22s22p63s23p6
20. Электронная формула катиона никеля Ni2+: +28Ni2+ 1s22s22p63s23p63d84s
Обратите внимание! Атомы отдают электроны всегда сначала с внешнего энергетического уровня. Поэтому никель отдаёт электроны сначала с внешнего 4s-подуровня