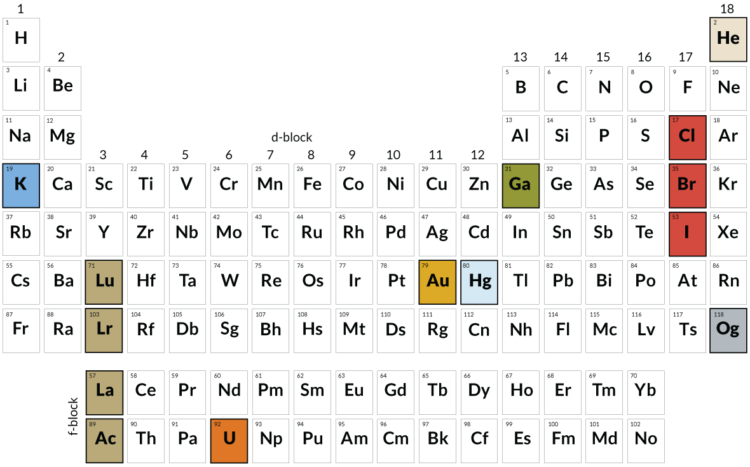
Периодическая таблица химических элементов д.и.менделеева
Содержание:
- Энергия ионизации
- Примечания
- «Башня» из химических элементов
- Периодическая таблица Д.И. Менделеева
- Свойства таблицы Менделеева
- Тренировочные задания
- Значение
- Применение серебра
- Простейшие понятия: вещество, молекула, атом, химический элемент
- Энергия ионизации
- Ядро атома. Изотопы
- Список химических элементов таблицы Менделеева
Энергия ионизации
Чем ближе электрон к центру атома — тем больше энергии необходимо, что бы его оторвать.
Энергия, затрачиваемая на отрыв электрона от атома называется энергией ионизации и обозначается Eo.
Если не указано иное, то энергия ионизации — это энергия отрыва первого электрона, также существуют энергии
ионизации для каждого последующего электрона.
— Что такое ион читайте в статье.
Перейти к другим элементам таблицы менделеева
1
H
1.008
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
2
He
4.003
3
Li
6.938
4
Be
9.012
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
5
B
10.806
6
C
12.01
7
N
14.006
8
O
15.999
9
F
18.998
10
Ne
20.18
11
Na
22.99
12
Mg
24.304
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
13
Al
26.982
14
Si
28.084
15
P
30.974
16
S
32.059
17
Cl
35.446
18
Ar
39.948
19
K
39.098
20
Ca
40.078
—
—
—
21
Sc
44.956
22
Ti
47.867
23
V
50.942
24
Cr
51.996
25
Mn
54.938
26
Fe
55.845
27
Co
58.933
28
Ni
58.693
29
Cu
63.546
30
Zn
65.38
31
Ga
69.723
32
Ge
72.63
33
As
74.922
34
Se
78.971
35
Br
79.901
36
Kr
83.798
37
Rb
85.468
38
Sr
87.62
—
—
—
39
Y
88.906
40
Zr
91.224
41
Nb
92.906
42
Mo
95.95
43
Tc
44
Ru
101.07
45
Rh
102.906
46
Pd
106.42
47
Ag
107.868
48
Cd
112.414
49
In
114.818
50
Sn
118.71
51
Sb
121.76
52
Te
127.6
53
I
126.904
54
Xe
131.293
55
Cs
132.905
56
Ba
137.327
—
—
—
71
Lu
174.967
72
Hf
178.49
73
Ta
180.948
74
W
183.84
75
Re
186.207
76
Os
190.23
77
Ir
192.217
78
Pt
195.084
79
Au
196.967
80
Hg
200.592
81
Tl
204.382
82
Pb
207.2
83
Bi
208.98
84
Po
85
At
86
Rn
87
Fr
88
Ra
—
—
—
103
Lr
104
Rf
105
Db
106
Sg
107
Bh
108
Hs
109
Mt
110
Ds
111
Rg
112
Cn
113
Nh
114
Fl
115
Mc
116
Lv
117
Ts
118
Og
Скачать таблицу менделеева в хорошем качестве
Примечания
- В книге (В. М. Потапов, Г. Н. Хомченко. «Химия». — М., 1982, стр. 26) утверждается, что их более 400.
- (недоступная ссылка). Музей-архив Д.И. Менделеева. Дата обращения 1 сентября 2012.
- Периодическая система элементов / Д. Н. Трифонов // Большая Советская Энциклопедия / гл. ред. А. М. Прохоров. — 3-е изд. — М. : Советская Энциклопедия, 1975. — Т. 19 : Отоми — Пластырь. — С. 413—417.
- Дружинин П.А. Загадка «Таблицы Менделеева»: История публикации открытия Д.И. Менделеевым Периодического закона. — Москва: Новое Литературное Обозрение, 2019. — 164 с. — ISBN 978-5-4448-0976-1.
- Дружинин П.А. Загадка «Таблицы Менделеева»: История публикации открытия Д.И. Менделеевым Периодического закона. — Москва: Новое Литературное Обозрение, 2019. — 164 с. — ISBN 978-5-4448-0976-1.
- Professor Witek Nazarewicz. . Sci-News.com (20 июня 2018).
- ↑ (англ.). ИЮПАК (30 November 2016). Дата обращения 24 октября 2018.
- . ИА REGNUM. (1 декабря 2016).
- , с. 29.
- , с. 29.
- Например, в 1997 году Б. Ф. Маховым была опубликована книга «Симметричная квантовая Периодическая система элементов», в которой границами горизонтальных рядов, периодов и диад служат элементы со спектральным термом 1s. Координатами конкретного элемента в таблице принят набор из четырёх квантовых чисел.
- Трифонов Д. Н. Структура и границы периодической системы. — М.: Атомиздат, 1969. — 271 с.
- . Lenta.Ru (7 октября 2009). Дата обращения 7 октября 2009.
- Дудин С. А. Атлас-определитель главных минералов и горных пород. — Екатеринбург: Издательские решения, 2016. — 78 с.
- Scerri 2007, p. 24
- Messler, R. W. The essence of materials for engineers (англ.). — Sudbury, MA: Jones & Bartlett Publishers (англ.)русск., 2010. — P. 32. — ISBN 0763778338.
- Day M. C., Selbin J. Theoretical inorganic chemistry (англ.). — 2nd. — New York, MA: Reinhold Book Corporation, 1969. — P. 103. — ISBN 0763778338.
- Holman J., Hill G. C. Chemistry in context (англ.). — 5th. — Walton-on-Thames: Nelson Thornes, 2000. — P. 40. — ISBN 0174482760.
- ↑ Leigh, G. J. Nomenclature of Inorganic Chemistry: Recommendations 1990 (англ.). — Blackwell Science (англ.)русск., 1990. — ISBN 0-632-02494-1.
- ↑ Moore, p. 111
- Greenwood, p. 30
- Stoker, Stephen H. General, organic, and biological chemistry (англ.). — New York: Houghton Mifflin (англ.)русск., 2007. — P. 68. — ISBN 978-0-618-73063-6.
- Mascetta, Joseph. Chemistry The Easy Way. — 4th. — New York: Hauppauge, 2003. — С. 50. — ISBN 978-0-7641-1978-1.
- Kotz, John; Treichel, Paul; Townsend, John. Chemistry and Chemical Reactivity, Volume 2 (англ.). — 7th. — Belmont: Thomson Brooks/Cole, 2009. — P. 324. — ISBN 978-0-495-38712-1.
- Gray, p. 12
- Jones, Chris. d- and f-block chemistry. — New York: J. Wiley & Sons, 2002. — С. 2. — ISBN 978-0-471-22476-1.
- Myers, R. The basics of chemistry. — Westport, CT: Greenwood Publishing Group, 2003. — С. 61—67. — ISBN 0313316643.
- Chang, Raymond. Chemistry. — 7. — New York: McGraw-Hill Education, 2002. — С. 289—310; 340—42. — ISBN 0-07-112072-6.
- Yoder, C. H.; Suydam, F. H.; Snavely, F. A. Chemistry. — 2nd. — Harcourt Brace Jovanovich (англ.)русск., 1975. — С. 58. — ISBN 0-15-506465-7.
- Sacks, O. Uncle Tungsten: Memories of a chemical boyhood (англ.). — New York: Alfred A. Knopf (англ.)русск., 2009. — P. 191, 194. — ISBN 0-375-70404-3.
- Gray, p. 9
- , с. .
- . ЮНЕСКО.
«Башня» из химических элементов
Периодическая таблица ADOMAH разработанная в 2006 году Валерием Циммерманом. Вместо того, чтобы основываться на атомных числах, систематизирована вокруг четырех квантовых чисел электронной конфигурации, эти четыре числа используются для описания расположения и движения электронов внутри атома. Идея берет свое начало из более старой таблицы инженера и биолога Чарльза Джанета, согласно статье, опубликованной на портале Science Alert. Его работа перестраивала элементы в соответствии с орбитальным заполнением – основной вероятностью нахождения электрона на определенном расстоянии от ядра атома.
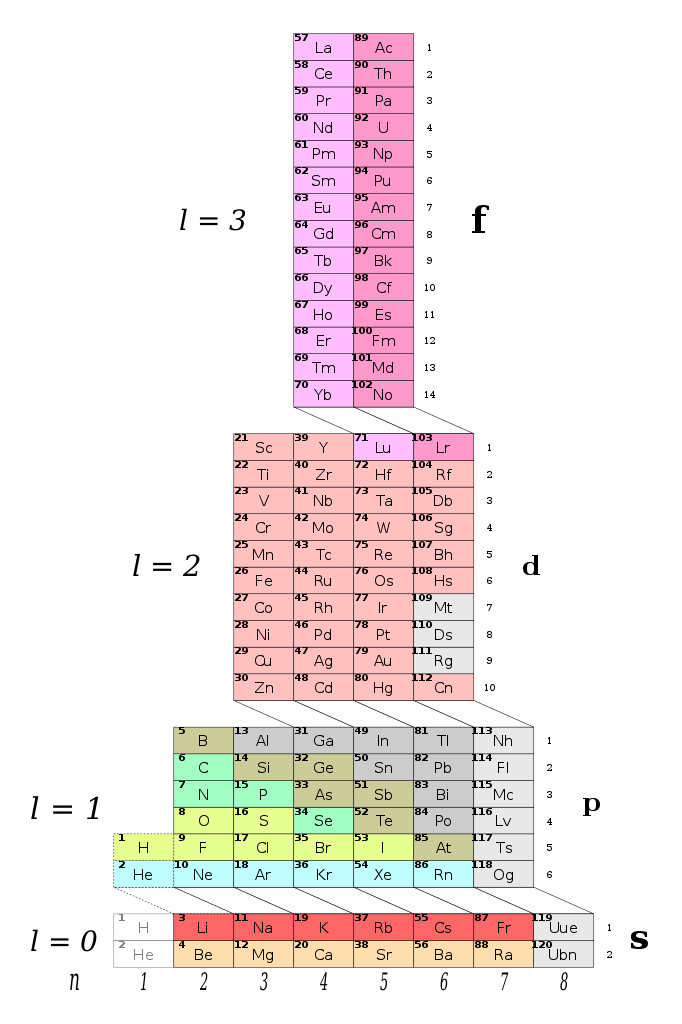
Так выглядит периодическая система ADOMAH
Периодическая таблица Д.И. Менделеева
Вне зависимости от того, любите вы или ненавидите ее, перед вами оригинальная периодическая таблица Менделеева и, скорее всего, вы всегда ее узнаете. Эта система классификации химических элементов знакома нам с детства и упорядочена по атомному номеру, электронной конфигурации. Необхдимо отметить, что она слабо зависит от химических свойств элементов как таковых. В этой версии таблицы меньше элементов, но зато в ней оставлено место для большего количества еще не открытых элементов, что – как показали годы исследований – оказалось разумным предположением русского ученого.
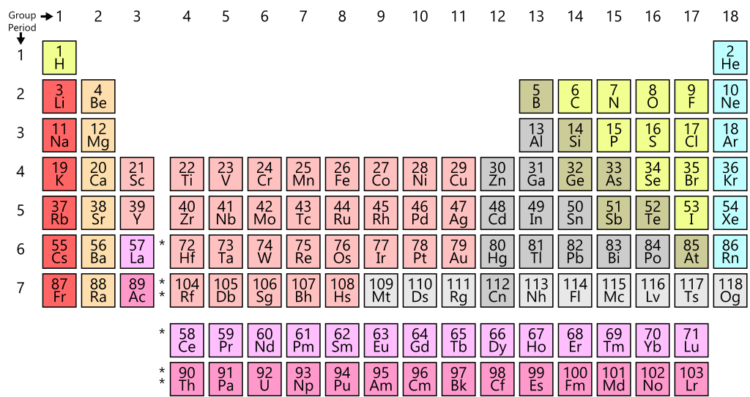
Всем знакомая периодическая таблица химических элементов Д.И. Менделеева
Свойства таблицы Менделеева
Напомним, что группами называют вертикальные ряды в периодической системе и химические свойства элементов главных и побочных подгрупп значительно различаются.
Свойства элементов в подгруппах закономерно изменяются сверху вниз:
- усиливаются металлические свойства и ослабевают неметаллические;
- возрастает атомный радиус;
- возрастает сила образованных элементом оснований и бескислородных кислот;
- электроотрицательность падает.
Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения, существует всего восемь форм кислородных соединений. В периодической системе их часто изображают общими формулами, расположенными под каждой группой в порядке возрастания степени окисления элементов: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4, где символом R обозначают элемент данной группы. Формулы высших оксидов относятся ко всем элементам группы, кроме исключительных случаев, когда элементы не проявляют степени окисления, равной номеру группы (например, фтор).
Оксиды состава R2O проявляют сильные основные свойства, причём их основность возрастает с увеличением порядкового номера, оксиды состава RO (за исключением BeO) проявляют основные свойства. Оксиды состава RO2, R2O5, RO3, R2O7 проявляют кислотные свойства, причём их кислотность возрастает с увеличением порядкового номера.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения. Существуют четыре формы таких соединений. Их располагают под элементами главных подгрупп и изображают общими формулами в последовательности RH4, RH3, RH2, RH.
Соединения RH4 имеют нейтральный характер; RH3 — слабоосновный; RH2 — слабокислый; RH — сильнокислый характер.
Напомним, что периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров.
В пределах периода с увеличением порядкового номера элемента:
- электроотрицательность возрастает;
- металлические свойства убывают, неметаллические возрастают;
- атомный радиус падает.
Тренировочные задания
1. Среди перечисленных химический элемент с максимальным радиусом атома — это
1) неон 2) алюминий 3) калий 4) кальций
2. Среди перечисленных химический элемент с минимальным радиусом атома — это
1) алюминий 2) бор 3) калий 4) неон
3. Наиболее ярко металлические свойства выражены у элемента
1) Rb 2) Li 3) Mg 4) Ca
4. Наиболее ярко неметаллические свойства выражены у элемента
1) F 2) S 3) O 4) N
5. Наибольшее число валентных электронов у элемента
1) фтор 2) водород 3) натрий 4) сера
6. Наименьшее число валентных электронов у элемента
1) кислород 2) кремний 3) водород 4) кальций
7. Металлические свойства элементов возрастают в ряду
1) Ba, Li, Cs, Mg 2) Al, Mg, Ca, K 3) Li, Cs, Mg, Ba 4) Na, Mg, Li, Al
8. Неметаллические свойства элементов ослабевают в ряду:
1) N, S, Br, Cl 2) O, S, Se, Te 3) Se, I, S, O 4) N, P, O, F
9. Химические элементы перечислены в порядке возрастания атомного радиуса в ряду
1) углерод, бериллий, магний 2) калий, магний, алюминий 3) хлор, натрий, фтор 4) азот, фосфор, фтор
10. Химические элементы перечислены в порядке убывания атомного радиуса в ряду
1) водород, бор, алюминий 2) углерод, кремний, калий 3) натрий, хлор, фтор 4) сера, кремний, магний
11. Кислотные свойства водородных соединений усиливаются в ряду
1) HI – PH3 – HCl – H2S 2) PH3 – H2S – HBr – HI 3) H2S – PH3 – HCl – SiH4 4) HI – HCl – H2S – PH3
12. Кислотные свойства водородных соединений ослабевают в ряду
1) HI – PH3 – HCl – H2S 2) PH3 – H2S – HBr – HI 3) H2S – PH3 – HCl – SiH4 4) HI – HBr – HCl – HF
13. Основные свойства соединений усиливаются в ряду
1) LiOH – KOH – RbOH 2) LiOH – KOH – Ca(OH)2 3) Ca(OH)2 – KOH – Mg(OH)2 4) LiOH – Ca(OH)2 – KOH
14. Основные свойства соединений ослабевают в ряду
1) LiOH – Ba(OH)2 – RbOH 2) LiOH – Ba(OH)2 – Ca(OH)2 3) Ca(OH)2 – KOH – Mg(OH)2 4) LiOH – Ca(OH)2 – KOH
15. Во втором периоде Периодической системы элементов Д.И. Менделеева с увеличением заряда ядра у химических элементов:
1) возрастает электроотрицательность 2) уменьшается заряд ядра 3) возрастает атомный радиус 4) возрастает степень окисления
16. Наиболее сильной кислотой, образованной элементом второго периода, является
1) угольная 2) азотная 3) фтороводородная 4) азотистая
17. Наиболее сильное основание образует химический элемент
1) магний 2) литий 3) алюминий 4) калий
18. Наиболее сильная бескислородная кислота соответствует элементу
1) селен 2) фтор 3) йод 4) сера
19. В ряду элементов Li → B → N → F
1) убывает атомный радиус 2) возрастают металлические свойства 3) уменьшается число протонов в атомном ядре 4) увеличивается число электронных слоёв
20. В ряду элементов Li → Na → K → Rb
1) убывает атомный радиус 2) ослабевают металлические свойства 3) уменьшается число протонов в атомном ядре 4) увеличивается число электронных слоёв
Значение
Периодическая система Д. И. Менделеева стала важнейшей вехой в развитии атомно-молекулярного учения. Благодаря ей сложилось современное понятие о химическом элементе, были уточнены представления о простых веществах и соединениях.
Прогнозирующая роль периодической системы, показанная ещё самим Менделеевым, в XX веке проявилась в оценке химических свойств трансурановых элементов.
Разработанная в XIX в. в рамках науки химии, периодическая таблица явилась готовой систематизацией типов атомов для новых разделов физики, получивших развитие в начале XX в. — физики атома и физики ядра. В ходе исследований атома методами физики было установлено, что порядковый номер элемента в таблице Менделеева, называемый также числом Менделеева, (атомный номер) является мерой электрического заряда атомного ядра этого элемента, номер горизонтального ряда (периода) в таблице определяет число электронных оболочек атома, а номер вертикального ряда — квантовую структуру верхней оболочки, чему элементы этого ряда и обязаны сходством химических свойств.
Появление периодической системы и открытие периодического закона открыло новую, подлинно научную эру в истории химии и ряде смежных наук — взамен разрозненных сведений об элементах и соединениях Д. И. Менделеевым и его последователями создана стройная система, на основе которой стало возможным обобщать, делать выводы, предвидеть.
По решению ООН, 2019 год объявлен Международным годом периодической таблицы химических элементов.
Применение серебра
Уже с давних времен серебро использовали при изготовлении зеркал, в настоящее время его заменяют алюминием для удешевления производства. Низкое электрическое сопротивление серебра находит применение в электротехнике и электронике, тут из него изготавливают разнообразные контакты и разъемы. В настоящее время серебро практически не используют для производства монет, из него изготавливают только памятные монеты. Большая часть серебра используется в ювелирном деле, при изготовлении столовых приборов. Серебро также широко используется в химической и пищевой промышленности. Интересно применение иодида серебра. С его помощью можно управлять погодой. Распыляя ничтожные количества иодида серебра с самолета, добиваются образования водяных капель, т.е. проще говоря вызывается дождь
При необходимости можно выполнить и противоположную задачу, когда дождь совершенно не нужен, например, при проведении какого-то очень важного мероприятия. Для этого иодид серебра распыляют за десятки километров до места события, тогда дождь прольется там, а в нужном месте будет сухая погода
Серебро широко применяется в медицине. Его используют как зубные протезы, в производстве лекарств (колларгол, протаргол, ляпис и др.) и медицинских инструментов.
 Серебряный столовый сервиз
Серебряный столовый сервиз
Простейшие понятия: вещество, молекула, атом, химический элемент
Что такое химия? Где мы встречаемся с химическими явлениями? Везде. Сама жизнь — это бесчисленное множество разнообразных химических реакций, благодаря которым мы дышим, видим голубое небо, ощущаем изумительный запах цветов…
Что изучает химия? Химия изучает вещества, а также химические процессы, в которых участвуют эти вещества.
Что такое вещество — понятно: это то, из чего состоит окружающий нас мир и мы сами. Но что такое химический процесс (явление)?
К химическим явлениям относятся процессы, в результате которых изменяется состав или строение молекул, образующих данное вещество. Изменились молекулы — изменилось вещество (оно стало другим!), — изменились его свойства:
- свежее молоко стало кислым;
- зелёные листья стали жёлтыми;
- сырое мясо при обжаривании изменило запах.
Все эти изменения — следствие сложных и многообразных химических процессов. Итак,
химия — это наука о веществах и их превращениях.
При этом исследуются не всякие превращения, а только такие, при которых
- обязательно изменяется состав или строение молекул;
- никогда не изменяется состав и заряд ядер атомов.
В этом определении встречаются такие понятия, как «вещество», «молекула», «атом». Разберём их подробнее.
Вещество — это то, из чего состоят окружающие нас предметы. Каждому абсолютно чистому веществу (таких в природе, кстати, не существует) приписывают определённую химическую формулу, которая отражает его состав, например:
- Н2О — вода;
- Na8[(AlSiO4)6SO4] — лазурит.
Выше приведены молекулярные формулы двух веществ. Следует отметить, что далеко не все вещества состоят из молекул, так как существуют вещества, которые состоят из атомов или ионов. Например, алмаз состоит из атомов углерода, а обычная поваренная соль — из ионов Na+ и ионов Cl– (условная «молекула» — NaСl).
Наименьшая частица вещества, которая отражает его качественный и количественный состав, называется молекулой.
Молекулы состоят из атомов. Атомы в молекуле соединены при помощи химических связей. Каждый атом обозначается при помощи символа (химического знака):
- Н — атом водорода;
- О — атом кислорода.
Число атомов в молекуле обозначают при помощи индекса:
Примеры:
- О2 — это молекула вещества кислорода, состоящая из двух атомов кислорода;
- Н2О — это молекула вещества воды, состоящая из двух атомов водорода и одного атома кислорода.
Но! Если атомы не связаны химической связью, то их число обозначают при помощи коэффициента:
Аналогично изображают число молекул:
- 2Н2 — две молекулы водорода;
- 3Н2О — три молекулы воды.
Почему атомы водорода и кислорода имеют разное название, разный символ? Потому что это атомы разных химических элементов.
Химический элемент — это частицы с одинаковым зарядом ядер их атомов.
Что такое ядро атома? Почему заряд ядра является признаком принадлежности атома к данному химическому элементу? Чтобы ответить на эти вопросы, следует уточнить: изменяются ли атомы в химических реакциях? Из чего состоит атом*?
Атом не имеет заряда, хотя и состоит из положительно заряженного ядра и отрицательно заряженных электронов:
В ходе химических реакций число электронов любого атома может изменяться, но заряд ядра атома в химических реакциях НЕ МЕНЯЕТСЯ!
Поэтому заряд ядра атома — своеобразный «паспорт» химического элемента. Все атомы с зарядом ядра +1 принадлежат химическому элементу под названием «водород». Атомы с зарядом ядра +8 составляют химический элемент «кислород».
Каждому химическому элементу присвоен химический символ (знак), порядковый номер в таблице Менделеева (порядковый номер равен заряду ядра атома); определённое название и, для некоторых химических элементов, особое прочтение символа в химической формуле (табл. 1).
Подведём итог. Вещества состоят из молекул, молекулы состоят из атомов, атомы с одинаковым зарядом ядра относятся к одному и тому же химическому элементу.
Но, если вещество состоит из молекул, то любое изменение состава или строения молекулы приводит к изменению самого вещества, его свойств.
Вопрос. Чем отличаются химические формулы веществ: Н2О и Н2О2?
Хотя по составу молекулы этих веществ отличаются на один атом кислорода, сами вещества по свойствам сильно отличаются друг от друга. Воду Н2О мы пьём и жить без неё не можем, а Н2О2 — перекись водорода, пить нельзя, а в быту её используют для обесцвечивания волос.
Вопрос. А чем отличаются химические формулы веществ:
Состав этих веществ — аллозы (А) и глюкозы (Б) — одинаков — С6Н12О6. Отличаются они строением молекул, в данном случае — расположением групп ОН в пространстве. Глюкоза — универсальный источник энергии для большинства живых организмов, а аллоза практически не встречается в природе и не может быть источником энергии.
Энергия ионизации
Чем ближе электрон к центру атома — тем больше энергии необходимо, что бы его оторвать.
Энергия, затрачиваемая на отрыв электрона от атома называется энергией ионизации и обозначается Eo.
Если не указано иное, то энергия ионизации — это энергия отрыва первого электрона, также существуют энергии
ионизации для каждого последующего электрона.
— Что такое ион читайте в статье.
Перейти к другим элементам таблицы менделеева
1
H
1.008
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
2
He
4.003
3
Li
6.938
4
Be
9.012
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
5
B
10.806
6
C
12.01
7
N
14.006
8
O
15.999
9
F
18.998
10
Ne
20.18
11
Na
22.99
12
Mg
24.304
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
13
Al
26.982
14
Si
28.084
15
P
30.974
16
S
32.059
17
Cl
35.446
18
Ar
39.948
19
K
39.098
20
Ca
40.078
—
—
—
21
Sc
44.956
22
Ti
47.867
23
V
50.942
24
Cr
51.996
25
Mn
54.938
26
Fe
55.845
27
Co
58.933
28
Ni
58.693
29
Cu
63.546
30
Zn
65.38
31
Ga
69.723
32
Ge
72.63
33
As
74.922
34
Se
78.971
35
Br
79.901
36
Kr
83.798
37
Rb
85.468
38
Sr
87.62
—
—
—
39
Y
88.906
40
Zr
91.224
41
Nb
92.906
42
Mo
95.95
43
Tc
44
Ru
101.07
45
Rh
102.906
46
Pd
106.42
47
Ag
107.868
48
Cd
112.414
49
In
114.818
50
Sn
118.71
51
Sb
121.76
52
Te
127.6
53
I
126.904
54
Xe
131.293
55
Cs
132.905
56
Ba
137.327
—
—
—
71
Lu
174.967
72
Hf
178.49
73
Ta
180.948
74
W
183.84
75
Re
186.207
76
Os
190.23
77
Ir
192.217
78
Pt
195.084
79
Au
196.967
80
Hg
200.592
81
Tl
204.382
82
Pb
207.2
83
Bi
208.98
84
Po
85
At
86
Rn
87
Fr
88
Ra
—
—
—
103
Lr
104
Rf
105
Db
106
Sg
107
Bh
108
Hs
109
Mt
110
Ds
111
Rg
112
Cn
113
Nh
114
Fl
115
Mc
116
Lv
117
Ts
118
Og
Скачать таблицу менделеева в хорошем качестве
Ядро атома. Изотопы
Атом состоит из ядра, которое имеет положительный заряд, и электронов, которые имеют отрицательный заряд. В целом атом электронейтрален.
Положительный заряд ядра атома равен порядковому номеру химического элемента.
Ядро атома — сложная частица. В ней сосредоточена почти вся масса атома. Поскольку химический элемент — совокупность атомов с одинаковым зарядом ядра, то около символа элемента указывают (рис. 6).
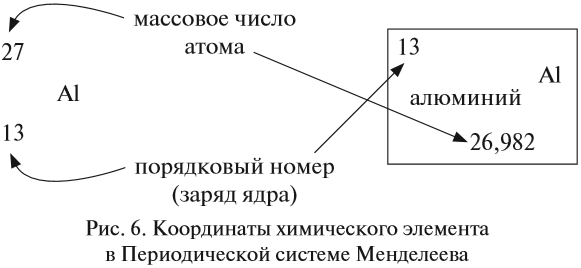
По этим данным можно определить состав ядра. Ядро состоит из протонов и нейтронов.
- Протон (р) имеет массу, равную 1 (1,0073 а. е. м.) и заряд, равный +1.
- Нейтрон (n) заряда не имеет (нейтрален), а масса его приблизительно равна массе протона (1,0087 а. е. м.).
Какие частицы определяют заряд ядра? Протоны! Причём число протонов равно (по величине) заряду ядра атома, т. е. порядковому номеру:
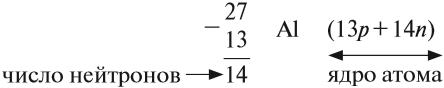
Число нейтронов определяют по разности между величинами: «масса ядра» и «порядковый номер».
Задание 3.3. Определите состав ядер атомов, если химический элемент находится в:
- 3-м периоде, VII группе, главной подгруппе;
- 4-м периоде, IV группе, побочной подгруппе;
- 5-м периоде, I группе, главной подгруппе.
Обратите внимание, что при определении массового числа ядра атома приходится округлять атомную массу, указанную в Периодической системе! Почему? Ведь массы протона и нейтрона практически целочисленны, а массой электронов можно пренебречь. Для того,чтобы ответить на этот вопрос, нужно понять:
Для того,чтобы ответить на этот вопрос, нужно понять:
- Что происходит с атомом в ходе химических процессов;
- Что такое «химический элемент».
В химических процессах обязательно изменяется распределение электронов вокруг ядра или даже изменяется их число. В последнем случае атом отдаёт или принимает электроны и превращается в заряженную частицу — ион. Но в химических реакциях никогда не меняется состав ядра атома, его заряд. Поэтому заряд ядра атома является своеобразным «паспортом» химического элемента.
Химический элемент — совокупность атомов или ионов с одинаковым зарядом ядра.
Для того чтобы разобраться, попробуйте определить, какие из ядер, состав которых указан ниже, принадлежат одному и тому же химическому элементу:
Атомам одного химического элемента принадлежат ядра А и В, так как они содержат одинаковое число протонов, т. е. заряд этих ядер одинаковый. Но ведь у них разная масса! Исследования показывают, что масса атома не оказывает существенного влияния на его химические свойства. Поэтому атомы одного и того же химического элемента (одинаковое число протонов), но с разной массой (разное число нейтронов) являются ИЗОТОПАМИ* этого элемента.
В таблице Менделеева указана средняя атомная масса всех природных изотопов данного элемента (Аr). Изотопы и их химические соединения отличаются друг от друга по физическим свойствам, но химические свойства у изотопов одного химического элемента одинаковы. Так, изотоп углерода-14 (14С) имеет такие же химические свойства, как и углерод-12 (12С), который входит в ткани любого живого организма, отличаясь от него только радиоактивностью. Поэтому изотопы применяют для диагностики и лечения различных заболеваний, для научных исследований.
Элемент «водород» встречается в природе в виде трёх изотопов:
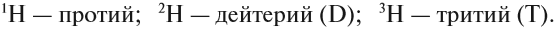
Химический элемент «кислород» также представлен тремя природными изотопами:
Задание 3.4. Укажите состав ядер этих изотопов водорода и кислорода.
Если разные вещества содержат атомы одного и того же химического элемента, это не означает, что эти вещества имеют одни те же свойства. Например, химический элемент «хлор» в виде атомарного хлора Cl• разрушает метан, а также атмосферный озон. Тот же элемент в виде молекулярного хлора Cl2 ядовит, активно реагирует с водой, многими металлами, а ионы хлора (химический элемент — тот же!) в составе NaCl химически инертен, а с биологической точки зрения не только безвреден, но и полезен для нас. Эти ионы являются макроэлементами нашей пищи, которые входят в состав крови, желудочного сока. Суточная потребность — до 6 граммов.
Но вернемся к описанию строения атома.

Список химических элементов таблицы Менделеева
- 1 H Водород (а.м. 1,00794)
- 2 He Гелий (а.м. 4,002602)
- 3 Li Литий (а.м. 6,9412)
- 4 Be Бериллий (а.м. 9,0122)
- 5 B Бор (а.м. 10,812)
- 6 С Углерод (а.м. 12,011)
- 7 N Азот (а.м. 14,0067)
- 8 О Кислород (а.м. 15,9994)
- 9 F Фтор (а.м. 18,9984)
- 10 Ne Неон (а.м. 20,179)
- 11 Na Натрий (а.м. 22,98977)
- 12 Mg Магний (а.м. 24,305)
- 13 Al Алюминий (а.м. 26,98154)
- 14 Si Кремний (а.м. 28,086)
- 15 P Фосфор (а.м. 30,97376)
- 16 S Сера (а.м. 32,06)
- 17 Cl Хлор (а.м. 35,453)
- 18 Ar Аргон (а.м. 39,948)
- 19 К Калий (а.м. 39,0983)
- 20 Ca Кальций (а.м. 40,08)
- 21 Sc Скандий (а.м. 44,9559)
- 22 Ti Титан (а.м. 47,9)
- 23 V Ванадий (а.м. 50,9415)
- 24 Cr Хром (а.м. 51,996)
- 25 Mn Марганец (а.м. 54,938)
- 26 Fe Железо (а.м. 55,847)
- 27 Со Кобальт (а.м. 58,9332)
- 28 Ni Никель (а.м. 58,7)
- 29 Cu Медь (а.м. 63,546)
- 30 Zn Цинк (а.м. 65,38)
- 31 Ga Галлий (а.м. 69,72)
- 32 Ge Германий (а.м. 72,59)
- 33 As Мышьяк (а.м. 74,9216)
- 34 Se Селен (а.м. 78,96)
- 35 Br Бром (а.м. 79,904)
- 36 Kr Криптон (а.м. 83,8)
- 37 Rb Рубидий (а.м. 85,4678)
- 38 Sr Стронций (а.м. 87,62)
- 39 Y Иттрий (а.м. 88,9059)
- 40 Zr Цирконий (а.м. 91,20)
- 41 Nb Ниобий (а.м. 92,9064)
- 42 Mo Молибден (а.м. 95,94)
- 43 Tc Технеций (а.м. 98,9062)
- 44 Ru Рутений (а.м. 101,07)
- 45 Rh Родий (а.м. 102,9055)
- 46 Pd Палладий (а.м. 106,4)
- 47 Ag Серебро (а.м. 107,868)
- 48 Cd Кадмий (а.м. 112,41)
- 49 In Индий (а.м. 114,82)
- 50 Sn Олово (а.м. 118,69)
- 51 Sb Сурьма (а.м. 121,75)
- 52 Те Теллур (а.м. 127,6)
- 53 I Йод (а.м. 126,9045)
- 54 Xe Ксенон (а.м. 131,3)
- 55 Cs Цезий (а.м. 132,9054)
- 56 Ba Барий (а.м. 137,33)
- 57 La Лантан (а.м. 138,9)
- 58 Ce Церий (а.м. 140,12)
- 59 Pr Празеодим (а.м. 140,9)
- 60 Nd Неодим (а.м. 144,24)
- 61 Pm Прометий (а.м. 145)
- 62 Sm Самарий (а.м. 150,35)
- 63 Eu Европий (а.м. 151,96)
- 64 Gd Гадолиний (а.м. 157,25)
- 65 Tb Тербий (а.м. 158,92)
- 66 Dy Диспрозий (а.м. 162,5)
- 67 Ho Гольмий (а.м. 164,93)
- 68 Er Эрбий (а.м. 167,26)
- 69 Tm Тулий (а.м. 168,93)
- 70 Yb Иттербий (а.м. 173,04)
- 71 Lu Лютеций (а.м. 174,97)
- 72 Hf Гафний (а.м. 178,49)
- 73 Ta Тантал (а.м. 180,9479)
- 74 W Вольфрам (а.м. 183,85)
- 75 Re Рений (а.м. 186,207)
- 76 Os Осмий (а.м. 190,2)
- 77 Ir Иридий (а.м. 192,22)
- 78 Pt Платина (а.м. 195,09)
- 79 Au Золото (а.м. 196,9665)
- 80 Hg Ртуть (а.м. 200,59)
- 81 Tl Таллий (а.м. 204,37)
- 82 Pb Свинец (а.м. 207,2)
- 83 Bi Висмут (а.м. 208,9)
- 84 Po Полоний (а.м. 209)
- 85 At Астат (а.м. 210)
- 86 Rn Радон (а.м. 222)
- 87 Fr Франций (а.м. 223)
- 88 Ra Радий (а.м. 226)
- 89 Ac Актиний (а.м. 227)
- 90 Th Торий (а.м. 232,03)
- 91 Pa Протактиний (а.м. 231,03)
- 92 U Уран (а.м. 238,02)
- 93 Np Нептуний (а.м. 237,04)
- 94 Pu Плутоний (а.м. 244,06)
- 95 Am Америций (а.м. 243,06)
- 96 Cm Кюрий (а.м. 247,07)
- 97 Bk Берклий (а.м. 247,07)
- 98 Cf Калифорний (а.м. 251,07)
- 99 Es Эйнштейний (а.м. 252,08)
- 100 Fm Фермий (а.м. 257,08)
- 101 Md Менделевий (а.м. 258,09)
- 102 No Нобелий (а.м. 259,1)
- 103 Lr Лоуренсий (а.м. 260,1)
- 104 Rf Резерфордий (а.м. 261)
- 105 Db Дубний (а.м. 262)
- 106 Sg Сиборгий (а.м. 266)
- 107 Bh Борий (а.м. 267)
- 108 Hs Хассий (а.м. 269)
- 109 Mt Мейтнерий (а.м. 276)
- 110 Ds Дармштадтий (а.м. 227)
- 111 Rg Ренгений (а.м. 280)
- 112 Cn Коперниций (а.м. 285)
- 113 Uut Унунтрий (а.м. 284)
- 114 Uuq Унунквадий (а.м. 289)
- 115 Uup Унунпентий (а.м. 288)
- 116 Uuh Унунгексий (а.м. 293)
- 117 Uus Унунсептий (а.м. 294)
- 118 Uuo Унуноктий (а.м. 294)
- 119 Uuе Унуненний (а.м. 316)
- 120 Ubn Унбинилий (а.м. 320)
- 121 Ubu Унбиуний (а.м. 320)
- 122 Ubb Унбибий
- 123 Ubt Унбитрий
- 124 Ubq Унбиквадий
- 125 Ubp Унбипентий (а.м. 332)
- 126 Ubn Унбигексий (а.м. 322)
Другие заметки по химии