Периодическая таблица менделеева
Содержание:
- Эрнест Резерфорд первый получил Нобелевскую премию по химии
- XIX век
- История таблицы Менделеева: как все начиналось
- Гранит считается наилучшим проводником звука
- Ртуть остается жидкой при комнатной температуре
- Математическая карта
- Предпосылки открытия периодического закона
- Интересные факты о металлах из таблицы менделеева. Металл против монахов
- Как открывают новые химические элементы?
- Серебро обладает бактерицидными свойствами
- Химия вокруг нас интересные факты. 10 фактов о воде, которых Вы не знали. Рассказывают химики.
- Цезий как эталон самого точного времени в мире
- Как пахнут книги
- Интересные факты о химических элементах таблицы Менделеева. Интересные факты о таблице Менделеева
Эрнест Резерфорд первый получил Нобелевскую премию по химии

Эрнест Резерфорд — это известный всему миру английский физик, который родился в Новой Зеландии. Большое значение в его жизни оказали учителя колледжа, которые преподавали физику и химию.
Однажды им была получена степень бакалавра естественных наук. В том колледже, в котором он обучался, шла из года в год одна традиция. Студент, который получал здесь степень магистра, должен был проводить какие-либо исследования, чтобы получить затем степень бакалавра.
Эрнест стал основоположником ядерной физики, который в 1908 году получил Нобелевскую премию по химии. На удивление, этого не мог ожидать никто. Единственное необычное превращение, которое пришлось испытать Резерфорду за всю свою жизнь, так это превращение из физика в известного всему миру химика.
XIX век
| Элемент | Год | Кто открыл | Страна |
| Ниобий | 1801 | Ч. Хэтчетт | Великобритания |
| Тантал | 1802 | А. Экеберг | Швеция |
| Палладий | 1803 | У. Волластон | Великобритания |
| Церий | 1803 | Й. Берцелиус, В. Хизингер и М. Г. Клапрот | Швеция и Германия |
| Иридий | 1804 | C. Теннант | Великобритания |
| Осмий | 1804 | C. Теннант | Великобритания |
| Родий | 1804 | У. Волластон | Великобритания |
| Натрий | 1807 | Г. Дэви | Великобритания |
| Калий | 1807 | Г. Дэви | Великобритания |
| Бор | 1808 | Ж. Гей-Люссак, Л. Тенар | Франция |
| Кальций | 1808 | Г. Дэви | Великобритания |
| Магний | 1808 | Г. Дэви | Великобритания |
| Иод | 1811 | Б. Куртуа | Франция |
| Кадмий | 1817 | Ф. Штромейер | Германия |
| Селен | 1817 | Й. Берцелиус | Швеция |
| Литий | 1817 | И. Арфведсон | Швеция |
| Кремний | 1823 | Й. Берцелиус | Швеция |
| Алюминий | 1825 | X. Эрстед | Дания |
| Бром | 1826 | А. Балар | Франция |
| Торий | 1828 | Й. Берцелиус | Швеция |
| Ванадий | 1830 | Н. Сефстрём | Швеция |
| Лантан | 1839 | К. Мосандер | Швеция |
| Эрбий | 1843 | К. Мосандер | Швеция |
| Тербий | 1843 | К. Мосандер | Швеция |
| Рутений | 1844 | К. К. Клаус | Россия (Казань) |
| Рубидий | 1861 | Р. Бунзен, Г. Кирхгоф | Германия |
| Цезий | 1861 | Р. Бунзен, Г. Кирхгоф | Германия |
| Таллий | 1861 | У. Крукс | Великобритания |
| Индий | 1863 | Ф. Райх, Т. Рихтер | Германия |
| Галлий | 1875 | П. Лекок де Буабодран | Франция |
| Иттербий | 1878 | Ж. Мариньяк | Швейцария |
| Тулий | 1879 | П. Клеве | Швеция |
| Самарий | 1879 | П. Лекок де Буабодран | Франция |
| Гольмий | 1879 | П. Клеве | Швеция |
| Скандий | 1879 | Л. Нильсон | Швеция |
| Празеодим | 1885 | К. Ауэр фон Вельсбах | Австро-Венгрия |
| Неодим | 1885 | К. Ауэр фон Вельсбах | Австро-Венгрия |
| Фтор | 1886 | А. Муассан | Франция |
| Германий | 1886 | К. Винклер | Германия |
| Гадолиний | 1886 | П. Лекок де Буабодран | Франция |
| Диспрозий | 1886 | П. Лекок де Буабодран | Франция |
| Аргон | 1894 | У. Рамзай, Дж. Рэлей | Великобритания |
| Гелий | 1895 | У. Рамзай, У. Крукс | Великобритания |
| Неон | 1898 | У. Рамзай, М. Траверс | Великобритания |
| Ксенон | 1898 | У. Рамзай, М. Траверс | Великобритания |
| Криптон | 1898 | У. Рамзай, М. Траверс | Великобритания |
| Полоний | 1898 | П. Кюри, М. Склодовская-Кюри | Франция |
| Радий | 1898 | П. Кюри, М. Склодовская-Кюри, Г. Бемон | Франция |
| Радон | 1899 | Р. Оуэнс, Э. Резерфорд | Великобритания |
| Актиний | 1899 | А. Дебьерн | Франция |
История таблицы Менделеева: как все начиналось
Попытки классифицировать и систематизировать известные химические элементы предпринимались задолго до Дмитрия Менделеева. Свои системы элементов предлагали такие известные ученые, как Деберейнер, Ньюлендс, Мейер и другие. Однако из-за нехватки данных о химических элементах и их правильных атомных массах предложенные системы были не совсем достоверными.
История открытия таблицы Менделеева начинается в 1869 году, когда российский ученый на заседании Русского химического общества рассказал своим коллегам о сделанном им открытии. В предложенной ученым таблице химические элементы располагались в зависимости от их свойств, обеспечивающихся величиной их молекулярной массы.
Интересной особенностью таблицы Менделеева было также наличие пустых клеток, которые в будущем были заполнены открытыми химическими элементами, предсказанными ученым (германий, галлий, скандий). После открытия периодической таблицы в нее много раз вносились добавления и поправки. Совместно с шотландским химиком Уильямом Рамзаем Менделеев добавил в таблицу группу инертных газов (нулевую группу).
В дальнейшем история периодической таблицы Менделеева была напрямую связана с открытиями в другой науке – физике. Работа над таблицей периодических элементов продолжается до сих пор, и современные ученые добавляют новые химические элементы по мере их открытия. Значение периодической системы Дмитрия Менделеева сложно переоценить, так как благодаря ей:
- Систематизировались знания о свойствах уже открытых химических элементов;
- Появилась возможность прогнозирования открытия новых химических элементов;
- Начали развиваться такие разделы физики, как физика атома и физика ядра;
Существует множество вариантов изображения химических элементов согласно периодическому закону, однако наиболее известный и распространенный вариант – это привычная для каждого таблица Менделеева.
Гранит считается наилучшим проводником звука

Звук — это определенные механические колебания, которые происходят в разных средах. Нашим слуховым органом он также может восприниматься. Совсем недавно ученые пришли к такому выводу, что гранит в 10 раз лучше проводит звук, чем сам воздух, которым мы дышим. При этом возрастает не только скорость передачи звука, но и дальность, на которую возможно передать этот звук.
В чем же секрет? На самом деле все просто. Гранит считается одним из самых прочных материалов, которые можно встретить на нашей Земле. Именно поэтому в граните скорость звука может быть намного выше.
Приведем простой пример. Если кто-то делает ремонт в панельном доме, то звук дрели можно будет слышать через весь подъезд.
Ртуть остается жидкой при комнатной температуре

Ртуть — это один из известных элементов, который находится в таблице Менделеева. При нормальных условиях, он может быть только в жидком состоянии.
Известно, что ртуть появилась еще в древние времена. Очень часто ее находили на некоторых горных породах. Но в большинстве случаев, получали благодаря обжигу.
Греки и римляне использовали этот элемент для того, чтобы очищать золото. В настоящее время это довольно редкий металл. В небольших количествах его можно найти в Испании, Дагестане, Словении, Киргизии.
Но стоит отметить, что ртуть — это единственный металл, который имеет жидкое состояние при комнатной температуре. При температуре, например, в -39, она становится очень твердой, а если нагреть до 360 градусов, то преобразуется в пар.
Математическая карта
Во многих случаях в истории науки великие предсказания, основанные на новых уравнениях, оказывались верными. Каким-то образом математика раскрывает некоторые природные секреты, прежде чем экспериментаторы их обнаружат. Один из примеров — антиматерия, другой — расширение Вселенной. В случае Менделеева, предсказания новых элементов возникли без какой-либо творческой математики. Но на самом деле Менделеев открыл глубокую математическую карту природы, поскольку его таблица отражала значение квантовой механики, математических правил, управляющих атомной архитектурой.
В своей книге Менделеев отметил, что «внутренние различия материи, которую составляют атомы», могут быть ответственны за периодически повторяющиеся свойства элементов. Но он не придерживался этой линии мышления. По сути, многие годы он размышлял о том, насколько важна атомная теория для его таблицы.
Но другие смогли прочитать внутреннее послание таблицы. В 1888 году немецкий химик Йоханнес Вислицен объявил, что периодичность свойств элементов, упорядоченных по массе, указывает на то, что атомы состоят из регулярных групп более мелких частиц. Таким образом, в некотором смысле таблица Менделеева действительно предвидела (и предоставила доказательства) сложную внутреннюю структуру атомов, в то время как никто не имел ни малейшего представления о том, как на самом деле выглядел атом или имел ли он какую-нибудь внутреннюю структуру вовсе.
К моменту смерти Менделеева в 1907 году ученые знали, что атомы делятся на части: электроны, переносящие отрицательный электрический заряд, плюс некоторый положительно заряженный компонент, делающий атомы электрически нейтральными. Ключом к тому, как эти части выстраиваются, стало открытие 1911 года, когда физик Эрнест Резерфорд, работающий в Манчестерском университете в Англии, обнаружил атомное ядро. Вскоре после этого Генри Мозли, работавший с Резерфордом, продемонстрировал, что количество положительного заряда в ядре (число протонов, которое он содержит, или его «атомное число») определяет правильный порядок элементов в периодической таблице.
Генри Мозли.
Атомная масса была тесно связана с атомным числом Мозли — достаточно тесно, чтобы упорядочение элементов по массе только в нескольких местах отличалось от упорядочения по числу. Менделеев настаивал на том, что эти массы были неправильными и нуждались в повторном измерении, и в некоторых случаях оказался прав. Осталось несколько расхождений, но атомное число Мозли прекрасно легло в таблицу.
Примерно в то же время датский физик Нильс Бор понял, что квантовая теория определяет расположение электронов, окружающих ядро, и что самые дальние электроны определяют химические свойства элемента.
Подобные расположения внешних электронов будут периодически повторяться, объясняя закономерности, которые первоначально выявила таблица Менделеева. Бор создал свою собственную версию таблицы в 1922 году, основываясь на экспериментальных измерениях энергий электронов (наряду с некоторыми подсказками из периодического закона).
Таблица Бора добавила элементы, открытые с 1869 года, но это был тот же периодической порядок, открытый Менделеевым. Не имея ни малейшего представления о квантовой теории, Менделеев создал таблицу, отражающую атомную архитектуру, которую диктовала квантовая физика.
Новая таблица Бора не стала ни первым, ни последним вариантом изначального дизайна Менделеева. Сотни версий периодической таблицы с тех пор были разработаны и опубликованы. Современная форма — в горизонтальном дизайне в отличие от первоначальной вертикальной версии Менделеева — стала широко популярной только после Второй мировой войны, во многом благодаря работе американского химика Гленна Сиборга.
Сиборг и его коллеги создали несколько новых элементов синтетически, с атомными числами после урана, последнего природного элемента в таблице. Сиборг увидел, что эти элементы, трансурановые (плюс три элемента, предшествовавшие урану), требовали новой строки в таблице, которую не предвидел Менделеев. Таблица Сиборга добавила строку для тех элементов под аналогичным рядом редкоземельных элементов, которым тоже не было места в таблице.
Вклад Сиборг в химию принес ему честь назвать собственный элемент — сиборгий с номером 106. Это один из нескольких элементов, названных в честь известных ученых. И в этом списке, конечно, есть элемент 101, открытый Сиборгом и его коллегами в 1955 году и названный менделевием — в честь химика, который прежде всех остальных заслужил место в периодической таблице.
Заходите на наш канал с новостями, если хотите больше подобных историй.
Предпосылки открытия периодического закона
Попытки классификации химических элементов
Периодический закон был открыт (сформулирован) в 1869 году Д.И. Менделеевым. К тому времени было уже известно более 60-ти химических элементов. По мере открытия новых элементов подтверждалась мысль о том, что многообразие окружающего мира обусловлено различными качественными и количественными сочетаниями химических элементов. Вполне закономерными были попытки исследователей выявить взаимосвязь между химическими элементами как с качественной, так и с количественной стороны.
По мере накопления фактов об элементах возникла необходимость в их классификации. Вначале ученые пытались все химические элементы разделить на две группы – металлы и неметаллы (А.Лавуазье, Й.Я. Берцелиус).
Таблица Менделеева
При изучении важнейших классов неорганических соединений выяснилось, что типичные металлы отличаются от типичных неметаллов не только по физическим, но и по химическим свойствам.
Типичные металлы, как например кальций Ca, образуют основные оксиды, которым соответствуют основания:
2Ca O2 → 2CaO
металл основной оксид (кальций) (оксид кальция)
CaO H2O → Ca(OH)2
основной оксид основание
Неметаллы, например сера S, образуют кислотные оксиды, которым соответствуют кислоты:
2S 3O2 → 2SO3
неметалл (сера) — кислотный оксид (оксид серы) SO3 H2O → H2SO4
кислотный оксид — кислота (серная)
Металлы, как правило, реагируют с кислотами, замещая в них атомы водорода H, с образованием солей. Для неметаллов реакция с кислотами нехарактерна.
Позже выяснилось, что классификация химических элементов на металлы и неметаллы является неполной. Так как, существуют химические элементы, которые проявляют двойственную природу. Оксиды и гидроксиды этих элементов способны реагировать и с кислотами и со щелочами (такие оксиды и гидроксиды называются амфотерными)
В 1817 году немецкий химик И.В. Деберейнер на основе сходства некоторых элементов расположил их отдельными триадами (Li, Na, K и Ca, Sr, Ba). При этом он впервые обнаружил, что атомная масса среднего элемента равна среднеарифметической сумме атомных масс крайних. Эта работа была одной из первых по систематизации элементов в зависимости от атомной массы, признанной основной количественной характеристикой элемента.
Предшественники Д.И. Менделеева обнаружили группы элементов, сходных по химическим свойствам, причем разница между атомными массами родственных элементов в группе равна некоторой постоянной величине.
Однако эти авторы не пошли дальше установления частных закономерностей внутри групп. В одних случаях различные естественные группы сопоставлялись чисто эмпирически, в рамках единой таблицы, а в других делались попытки поиска конкретных закономерностей.
Работы предшественников подготовили почву для открытия Д.И. Менделеева.
Интересные факты о металлах из таблицы менделеева. Металл против монахов
Антимониум — серебристо-белый металл, среди химиков больше известный как сурьма. Этот металл известен уже много тысяч лет. Например, археологами доказано, что примерно три тысячи лет назад в Вавилоне из сурьмы делали сосуды. Но чаще, конечно, применялся не чистый металл, а его сульфид — «сурьмяный блеск».
В 1604 году появилось первое описание получения сурьмы из соединений. Это описание было в книге довольно известного монаха, а по совместительству алхимика, Василия Валентина.
Василий Валентин верил, что соединения сурьмы могут помочь очистить организм от «вредоносных начал». Он пытался применять сурьму в качестве лекарства. Например, он считал отличным «рвотным средством» вино, которое было выдержано в сурьмяных сосудах. А как вам «вечные пилюли», которые можно было использовать много раз — они просто проходили весь кишечный тракт? Все эти лекарства Василий использовал на монахах, и некоторых из них забирала мучительная смерть. Вот откуда взялось название «антимониум» — противомонашеский металл.

Сегодня есть мнение, что такого человека как Василий Валентин не существовало, ведь его не было в списках монахов ордена, к которому он себя причислял. Вполне возможно, что все его книги — коллективный труд нескольких алхимиков.
И ещё интересный факт про сурьму: в России это название произошло от турецкой косметической процедуры — «чернение бровей». И хотя в качестве краски для бровей сурьму употребляли редко, выражение насурьмить брови» довольно часто можно было услышать в быту.
Как открывают новые химические элементы?
В 2019 году таблице Менделеева исполнилось 150 лет. Первый ее вариант содержал лишь 63 элемента. По состоянию на начало 2020 года учеными официально открыто 118 химических элементов, которые имеют соответствующие порядковые номера с 1 по 118. При этом 94 элемента имеют природное происхождение, а еще 24 открыты искусственным путем – при помощи проведения ядерных реакций.
Интересный факт: последний 118 химический элемент, официально открытый и подтвержденный 28 ноября 2016, носит название оганесон в честь Юрия Оганесяна – знаменитого академика. Это второй элемент, названный в честь ныне живущего человека (первый – сиборгий).
Раньше ученые открывали элементы, обнаруживая их в природе. Для этого исследовали различные минералы, разделяли их на отдельные компоненты. Но они не могут быть в бесконечном количестве – после урана последующие открытия осуществляются лишь синтетическим путем.
Как именно происходит процесс открытия нового элемента? Говоря простым языком, производится реакция слияния двух ядер. Одно ядро выступает «мишенью», а второе – атакующей частицей. Визуально это можно представить в виде капли жидкости, которая вибрирует и, в итоге, разделяется на две капли – образуется новый элемент.
Сложность заключается в том, что одни элементы могут существовать долго, а другие распадаются буквально за считанные минуты. Это затрудняет изучение и открытие новых элементов. Также ученые пытаются создать тяжелые элементы, что на практике является еще более сложной задачей.
В современной версии таблицы элементы 104-118 являются сверхтяжелыми. Это значит, что они обладают существенной атомной массой. Элементов, тяжелее урана, не обнаружено – все последующие образуются только искусственно. В настоящее время ученые занимаются активными поисками элементов под номерами 119 и 120.
Современная Периодическая система
Основная цель – понять, насколько большой может оказаться таблица, и какие силы заставляют столь тяжелые атомы держаться вместе. Сверхтяжелые элементы открывают путем объединения двух легких. По такой схеме были обнаружены элементы 113, 115, 117 и 118.
Интересный факт: ученые предполагают наличие некоторых элементов, но официально они еще не обнаружены. Такие элементы получают временное название (с приставкой Un- или Ун- в русском языке) и порядковый номер в таблице в соответствии с ожидаемой атомной массой. Например, 119 – Унуненний, 120 – Унбинилий и др.
Подобные исследования происходят лишь в считанных лабораториях, расположенных в разных странах мира. Есть такой специализированный объект и в России. Главным российским научным центром в данной области является Объединенный институт ядерных исследований, расположенный в технополисе Дубна (Московская область).
Именно здесь за последние 20 лет было искусственно создано 5 элементов – со 114 по 118. Также в Дубне создается Фабрика сверхтяжелых элементов – установка, которая должна упростить синтез.
Фабрика сверхтяжелых элементов
По состоянию на начало 2020 года официально подтверждено и занесено в таблицу Менделеева 118 химических элементов. Последний 118-й элемент, оганесон, синтезирован и утвержден в 2016 году. Назван в честь академика Оганесяна, который внес существенный вклад в экспериментальную ядерную физику. В современной науке открытие новых элементов – сложный и длительный процесс. Новые элементы создаются искусственным путем. Ученые активно работают над поиском 119 и 120 элементов Периодической системы.
Серебро обладает бактерицидными свойствами

Серебро появилось на Земле очень давно. Оно играло довольно большую роль в культурных традициях разных народов. Например, в Ассирии оно считалось священным металлом.
Некоторое количество серебра можно встретить в земной коре. В чистом виде — металл довольно тяжелый. С течением времени оно постоянно тускнеет.
В настоящее время его применение активно используется во многих отраслях. Например, в медицине. Уже очень давно ученые писали о бактерицидном действии. Многие лекарственные препараты представляют собой гидрозоли серебра.
Стоит отметить, что еще 4 тысячи лет назад, его использовали при борьбе с различными инфекциями. Древние египтяне использовали серебреные пластинки для прикладывания к ранам. Таким образом, они быстрее заживлялись и проходили.
Также многие используют серебро для очистки воды. Оно способно убивать все микроорганизмы и бактерии.
Химия вокруг нас интересные факты. 10 фактов о воде, которых Вы не знали. Рассказывают химики.

Мы имеем контакт с водой каждый день, однако не всегда задумываемся об этом простом, но и в то же время удивительно сложномвеществе Факт №1. Белок в воде Морская вода – весьма питательная субстанция. В 1 куб. см такой воды содержится 1.5 мг белка и других веществ. Ученые считают, что один только Атлантический океан по своей питательности оценивается в 20 тыс. урожаев, которые собирают за год по всей суше.
Факт №2. Горючая вода Существует и опасная вода. Так, например, в Азербайджане есть вода, в которой много метана, поэтому она может загореться, если поднести к ней спичку. А в Сицилии в одном из озер есть подводные источники кислоты, которые отравляют всю воду в этом водоеме.
Факт №3. Жизнь длиною в 35 тонн воды. Без воды человек может прожить очень не долго. Потребность в воде стоит на втором месте после кислорода. Без еды человек может прожить около шести недель, а без воды – пять-семь суток. За всю свою жизнь человек выпивает примерно 35 т воды.
Факт №4. Огромные запасы пресной воды Где больше всего воды? Ответ кажется очевидным: в Мировом океане. Однако на самом деле, в мантии Земли воды содержится в 10-12 раз больше, чем в Мировом океане. При этом почти вся имеющаяся на планете масса воды не пригодна для питья. Мы можем пить только 3% воды – именно столько у нас запасов пресной воды. Но даже большая часть этих 3% недоступна, так как содержится в ледниках.
Факт №5. Потребность воды для жизни Если человек теряет 2% воды от массы своего тела, то у него возникает сильная жажда. Если проценты потерянной воды увеличатся до 10, то у человека начнутся галлюцинации. При потере в 12% человек не сможет восстановиться без помощи врача. При потере в 20% человек умирает.
Факт №6. Вода, как основа жизни Вода – основа жизни. Все живые животные и растительные существа состоят из воды: животные – на 75%, рыбы – на 75%, медузы – на 99%, картофель — на 76%, яблоки — на 85%, помидоры — на 90%, огурцы — на 95%, арбузы — на 96%. Даже человек состоит из воды. 86% воды содержится в теле у новорожденного и до 50% у пожилых людей.
Факт №7. Стеклянная вода Что будет, если взять замерзшую чистую воду и продолжить охлаждение? С водой произойдут чудесные превращения. При минус 120 градусах по Цельсию вода становится сверхвязкой или тягучей, а при температуре ниже минус 135 градусов она превращается в «стеклянную» воду. «Стеклянная» вода – это твердое вещество, в котором отсутствует кристаллическая структура, как в стекле.
Факт №8. Сверхохлаждение воды Все хорошо помнят из школьного курса физики, что вода замерзает при 0 градусов, а при 100 градусах закипает. Однако существует так называемое сверхохлаждение воды. Таким свойством обладает очень чистая вода – без примесей. Даже при охлаждении ниже точки замерзания такая вода остается жидкой. Но и в том, и в другом случае существуют температуры, при которых вода станет льдом или закипит.
Факт №9. Лед из горячей воды добыть проще,чем из холодной Какая вода быстрее превратится в лед: горячая или холодная? Если рассуждать логически, то, конечно, холодная. Ведь горячей нужно сначала остыть, а потом уже замерзнуть, а вот холодной остывать не нужно. Однако опыты показывают, что в лед быстрее превращается именно горячая вода.Точного ответа на вопрос, почему все-таки горячая вода замерзает быстрее холодной, до сих пор не существует. Возможно, дело в разнице в переохлаждении, испарении, образовании льда, конвекции, либо причина в воздействии разжиженных газов на горячую и холодную воду.
Цезий как эталон самого точного времени в мире
Цезий – прекрасный пример управляемого хаоса. Этот элемент известен как радиоактивный отход от ядерных взрывов. Цезий является одним из пяти элементов, которые находятся в жидком состоянии при комнатной температуре.
Но самое удивительное изменение состояния цезия происходит, когда вы помещаете его в воду. Вот что при этом происходит:
Также у цезия электронные переходы настолько точны, что он стал использоваться в качестве основного стандарта для определения самого точного в мире времени.
Так, секунда – это время, равное 9 192 631 770 периодам излучения, соответствующего переходу между двумя сверхтонкими уровнями основного состояния атома цезия-133.
Цезий применяется в атомных часах. Вот как они выглядят:
hodinkee.com
Эти атомные часы настолько точны, что не потеряют ни секунды за 20 миллионов лет. Это безумие, как такой нестабильный элемент может быть использован, чтобы стать нашим точным определением времени.
Как пахнут книги
Наверное, почти все люди любят запах старых и новых книг. Он появляется благодаря сотням органических соединений – клей и чернила, продукты разрушения целлюлозы и лигнина.
В старых книгах идёт процесс разрушения бумаги, а потому меняется и запах. Также, ванилин придаёт книге, как бы странно это ни звучало, запах ванили, миндальный запах появляется благодаря фурфуролу и бензальдегиду, сладковатый – благодаря толуолу.
На запах новых книг влияет типографская краска, клеевые вещества, способы отбелки бумаги. Различные вещества – перекись водорода, хлор – отбеливают и разлагают целлюлозу с образованием различных летучих веществ.
Любимый всеми запах книг – набор различных соединений и цепочек реакций, химия.
Интересные факты о химических элементах таблицы Менделеева. Интересные факты о таблице Менделеева
Благодаря Генеральной Ассамблее ООН 2019 официально стал Международным годом таблицы Менделеева. Расскажем несколько интересных фактов о периодической таблице химических элементов.
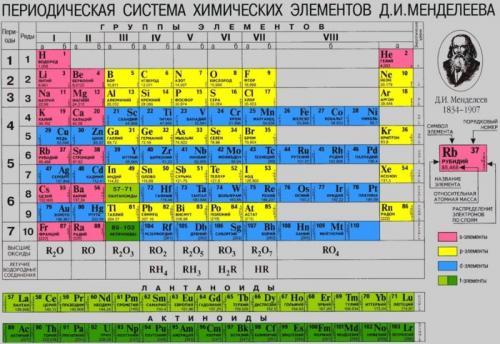
Таблица Менделеева
Родители смогут вспомнить школьную программу, а школьники узнают полезную информацию для расширения кругозора и успехов на уроках и олимпиадах по химии.
Интересные факты об истории таблицы Менделеева
Факт #1. Создателем таблицы считается Дмитрий Менделеев, но до него похожую схему представил научному сообществу Джон Ньюленд. Правда, его не восприняли всерьез.
Факт #2. Российский ученый Дмитрий Иванович впервые опубликовал свой вариант таблицы в 1869 году, окончательный вид с доработками и улучшениями открытие приобрело только в 1871 году.
Факты об элементах таблицы Менделеева
У большинства элементов таблицы Менделеева есть своя увлекательная история открытия и необычные свойства. Опишем некоторые из них.
Факт #1 . Благодаря урану (U) ученый Анри Беккерель получил Нобелевскую премию. Он понял, что вещество радиоактивно, когда случайно положил соли урана на фотопластинку. А еще уран — последний по номеру природный элемент в таблице, остальные вещества можно создать только искусственным путем.
Факт #2 . 200 лет назад исследователи Льюис и Кларк прошли через всю Америку к Тихому океану. Они взяли с собой в путь ртутное слабительное. А современные ученые по следам ртути (Hg), которая со временем не разлагается, смогли узнать точное место лагеря путешественников.
Факт #3 . Галлий (Ga) стал первым пробелом в таблице, заполненным уже после смерти ученого. Металлический галлий известен тем, что он сохраняет твердость при комнатной температуре, но в руках плавится.
Факт #4. Одни наименования химических элементов произошли от латинских слов, связанных со свойствами веществ. Некоторые элементы получили названия в честь ученых. А часть веществ носит имена героев мифов.
Факт #5. Элемент титан (Ti) назвали именем могучих сыновей богини Геи . Это один из самых твердых металлов. А его диаксид переливаетсямвсеми цветами радуги.
Факт #6. Тантал (Ta) носит имя героя древнегреческих мифов , совершившего несколько непростительных преступлений.
Факт #7. Торий (Th) назвали в честь бога грома Тора.
Факт #8. Ванадий (V) отличается соединениями с необычной окраской, поэтому назван именем древнескандинавской богини красоты.
Факт #9. Уран (U), Нептуний (Np) и Плутоний (Pu) также носят имена богов Урана, Нептуна (Посейдона) и Плутона (Аида).
Мифы о таблице Менделеева
Факт #1. Периодическая таблица химических элементов также известна распространенными мифами. Самый популярный гласит, что ученый однажды увидел сразу всю таблицу во сне. Но исследование жизни Менделеева говорит о том, что на самом деле он потратил немало времени и сил на свое открытие.
Факт #2. По другой легенде буквы армянского алфавита связаны с таблицей Менделеева. В разборе армянских названий таких веществ, как золото, серебро, свинец и ртуть, некая связь действительно прослеживается. Но это, скорее, совпадение. Армянские ученые вряд ли могли заранее предугадать открытие всех элементов таблицы.