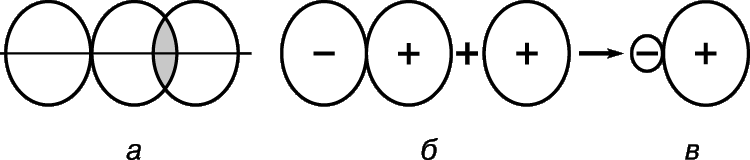§ 12. ковалентная полярная химическая связь
Содержание:
Пара- и ортоводород
Схематическое изображение спиновых изомеров водорода
Ядра атомов водорода, входящие в состав молекулы, являются протонами — фермионами со спином 1/2. По правилам сложения спинов ядерный спин молекулы может быть 0 или 1. Молекулы водорода с суммарным ядерным спином 0 называют параводородом, а молекулы с суммарным ядерным спином 1 и тремя возможными проекциями (−1, 0, 1) называют ортоводородом. В состоянии термодинамического равновесия при комнатной температуре отношение между ортоводородом и параводородом составляет 3:1. Однако при низких температурах в состоянии термодинамического равновесия молекулы параводорода доминируют благодаря разным вращательным свойствам: параводород является симметричным ротатором, ортоводород — несимметричным ротатором. Переход ортоводорода в параводород — медленный процесс, и состояние термодинамического равновесия при низких температурах устанавливается долго.
Тренировочные задания
1. Ковалентной неполярной связью образовано каждое из веществ, формулы которых
1) O2, H2, N2 2) Al, O3, H2SO4 3) Na, H2, NaBr 4) H2O, O3, Li2SO4
2. Ковалентной полярной связью образовано каждое из веществ, формулы которых
1) O2, H2SO4, N2 2) H2SO4, H2O, HNO3 3) NaBr, H3PO4, HCl 4) H2O, O3, Li2SO4
3. Только ионной связью образовано каждое из веществ, формулы которых
1) CaO, H2SO4, N2 2) BaSO4, BaCl2, BaNO3 3) NaBr, K3PO4, HCl 4) RbCl, Na2S, LiF
4. Металлическая связь характерна для элементов списка
1) Ba, Rb, Se 2) Cr, Ba, Si 3) Na, P, Mg 4) Rb, Na, Cs
5. Соединениями только с ионной и только с ковалентной полярной связью являются соответственно
1) HCl и Na2S 2) Cr и Al(OH)3 3) NaBr и P2O5 4) P2O5 и CO2
6. Ионная связь образуется между элементами
1) хлором и бромом 2) бромом и серой 3) цезием и бромом 4) фосфором и кислородом
7. Ковалентная полярная связь образуется между элементами
1) кислородом и калием 2) серой и фтором 3) бромом и кальцием 4) рубидием и хлором
8. В летучих водородных соединениях элементов VA группы 3-го периода химическая связь
1) ковалентная полярная 2) ковалентная неполярная 3) ионная 4) металлическая
9. В высших оксидах элементов 3-го периода вид химической связи с увеличением порядкового номера элемента изменяется
1) от ионной связи к ковалентной полярной связи 2) от металлической к ковалентной неполярной 3) от ковалентной полярной связи до ионной связи 4) от ковалентной полярной связи до металлической связи
10. Длина химической связи Э–Н увеличивается в ряду веществ
1) HI – PH3 – HCl 2) PH3 – HCl – H2S 3) HI – HCl – H2S 4) HCl – H2S – PH3
11. Длина химической связи Э–Н уменьшается в ряду веществ
1) NH3 – H2O – HF 2) PH3 – HCl – H2S 3) HF – H2O – HCl 4) HCl – H2S – HBr
12. Число электронов, которые участвуют в образовании химических связей в молекуле хлороводорода, —
1) 4 2) 2 3) 6 4) 8
13. Число электронов, которые участвуют в образовании химических связей в молекуле P2O5, —
1) 4 2) 20 3) 6 4) 12
14. В хлориде фосфора (V) химическая связь
1) ионная 2) ковалентная полярная 3) ковалентная неполярная 4) металлическая
15. Наиболее полярная химическая связь в молекуле
1) фтороводорода 2) хлороводорода 3) воды 4) сероводорода
16. Наименее полярная химическая связь в молекуле
1) хлороводорода 2) бромоводорода 3) воды 4) сероводорода
17. За счёт общей электронной пары образована связь в веществе
1) Mg 2) H2 3) NaCl 4) CaCl2
18. Ковалентная связь образуется между элементами, порядковые номера которых
1) 3 и 9 2) 11 и 35 3) 16 и 17 4) 20 и 9
19. Ионная связь образуется между элементами, порядковые номера которых
1) 13 и 9 2) 18 и 8 3) 6 и 8 4) 7 и 17
20. В перечне веществ, формулы которых соединения только с ионной связью, это
1) NaF, CaF2 2) NaNO3, N2 3) O2, SO3 4) Ca(NO3)2, AlCl3
Образование и виды ковалентной связи
Существуют два механизма образования ковалентной связи: обменный механизм и донорно-акцепторный механизм:
обменный механизм. При обменном механизме для образования общей электронной пары два связывающихся атома предоставляют по одному неспаренному электрону. Именно так происходит, например, при образовании молекулы водорода.
Рис. 2. Образование молекула водорода.
Общая электронная пара принадлежит каждому из связанных атомов, то есть электронная оболочка у них завершена.
донорно-акцепторный механизм. При донорно-акцепторном механизме общую электронную пару представляет один из связывающихся атомов, тот, который является более электроотрицательным. Второй атом представляет свободную орбиталь для общей электронной пары.
Рис. 3. Образование иона аммония.
Так образуется ион аммония NH4 +. Этот положительно заряженный ион (катион) образуется при взаимодействии газа аммиака с любой кислотой. В растворе кислоты существуют катионы водорода (протоны), в водородной среде образующие катион гидроксония H3O+. Формула аммиака NH3: молекула состоит из одного атома азота и трех атомов водорода, связанных одинарными ковалентными связями по обменному механизму. У атома азота остается при этом одна неподеленная электронная пара. Ее он предоставляет в качестве общей, как донор, иону водорода H+, имеющему свободную орбиталь.
Ковалентная химическая связь в химических веществах может быть полярной и неполярной. Связь не имеет дипольного момента, то есть полярности, если связаны два атома одного и того же элемента, имеющие одно и то же значение электроотрицательности. Так, в молекуле водорода связь неполярная.
В молекуле хлороводорода HCl ковалентной одинарной связью соединены атомы с разной электроотрицательностью. Общая электронная пара оказывается сдвинутой в сторону хлора, у которого выше сродство к электрону и электроотрицательность. Возникает дипольный момент, связь становится полярной. При этом происходит частичное разделение заряда: атом водорода становится положительным концом диполя, а атом хлора – отрицательным.
Любая ковалентная связь обладает следующими характеристиками: энергия, длина, кратность, полярность, поляризуемость, насыщаемость, направленность в пространстве
Что мы узнали?
Ковалентная химическая связь образуется перекрытием пары валентных электронных облаков. Этот вид связи может образовываться по донорно-акцепторному механизму, а также по обменному механизму. Ковалентная связь бывает полярной и неполярной и характеризуется наличием длины, кратности, полярности, направленности в пространстве.
Энергия электронных состояний
Энергия электронных состояний находится усреднением гамильтониана на волновых функциях
- E=∫ψ∗H^ψdV1dV2{\displaystyle {\mathcal {E}}=\int \psi ^{*}{\hat {H}}\psi dV_{1}dV_{2}}.
Для двух возможных волновых функций основного состояния она приобретает вид
- Esymasym=2E1s+e2R+Q±A1±S2{\displaystyle {\mathcal {E}}_{sym/asym}=2E_{1s}+{\frac {e^{2}}{R}}+{\frac {Q\pm A}{1\pm S^{2}}}},
где R=|R1−R2|{\displaystyle R=|\mathbf {R} _{1}-\mathbf {R} _{2}|} — расстояние между ядрами, E1s{\displaystyle E_{1s}} — значение энергии основного состояния атома водорода, S{\displaystyle S} — интеграл перекрытия, который определяется выражением
- S(R)=∫ψ1s(|r−R1|)ψ1s(|r−R2|)dV{\displaystyle S(R)=\int \psi _{1s}(|\mathbf {r} -\mathbf {R} _{1}|)\psi _{1s}(|\mathbf {r} -\mathbf {R} _{2}|)dV},
Q{\displaystyle Q} — кулоновский интеграл, определяемый как
- Q(R)=e2∫ψ1s2(|r1−R1|)ψ1s2(|r2−R2|)1|r1−r2|−1|r1−R2|−1|r2−R1|dV1dV2{\displaystyle Q(R)=e^{2}\int \psi _{1s}^{2}(|\mathbf {r} _{1}-\mathbf {R} _{1}|)\psi _{1s}^{2}(|\mathbf {r} _{2}-\mathbf {R} _{2}|)\leftdV_{1}dV_{2}},
A{\displaystyle A} — обменный интеграл, равный
- A(R)=e2∫ψ1s(|r1−R1|)ψ1s(|r2−R2|)ψ1s(|r2−R1|)ψ1s(|r1−R2|)1|r1−r2|{\displaystyle A(R)=e^{2}\int \psi _{1s}(|\mathbf {r} _{1}-\mathbf {R} _{1}|)\psi _{1s}(|\mathbf {r} _{2}-\mathbf {R} _{2}|)\psi _{1s}(|\mathbf {r} _{2}-\mathbf {R} _{1}|)\psi _{1s}(|\mathbf {r} _{1}-\mathbf {R} _{2}|)\left[{\frac {1}{|\mathbf {r} _{1}-\mathbf {r} _{2}|}}\right.}.
Энергия молекулы водорода состоит из удвоенной энергии атома водорода, энергии кулоновского отталкивания между ядрами и членов, определяющих взаимодействие электронов между собой и с другим ядром. В зависимости от спинового состояния в формуле для E{\displaystyle {\mathcal {E}}} следует выбирать знак «+» или знак «-». Знак «+» отвечает синглетному состоянию, знак «-» — триплетному.
Величина Q(R){\displaystyle Q(R)} — это средняя энергия кулоновского взаимодействия между двумя электронами и электронов с «чужим ядром». Величина A(R){\displaystyle A(R)} определяет вклад в энергию обменного взаимодействия, которая не имеет аналога в классической механике. Именно этот член определяет существенное различие между синглетными и триплетными состояниями.
Движение ядер в молекуле водорода
Гамильтониан, описывающий относительное движение двух ядер в молекуле водорода имеет вид
- H^nucl=−ℏ22μR2∂∂R(R2∂∂R)+L^22μR2+Esym(R){\displaystyle {\hat {H}}_{nucl}=-{\frac {\hbar ^{2}}{2\mu R^{2}}}{\frac {\partial }{\partial R}}\left(R^{2}{\frac {\partial }{\partial R}}\right)+{\frac {{\hat {L}}^{2}}{2\mu R^{2}}}+{\mathcal {E}}_{sym}(R)},
где μ=M2{\displaystyle \mu =M/2} — приведённая масса двух ядер, Esym(R){\displaystyle {\mathcal {E}}_{sym}(R)} — энергия синглетного электронного состояния, зависящая от расстояния между ядрами (определена в предыдущем разделе), L^{\displaystyle {\hat {L}}} — оператор углового момента, описывающий вращение молекулы.
Вращение
Оператор углового момента коммутирует с гамильтонианом, поэтому собственные функции гамильтониана можно выбрать общими с собственными функциями оператора углового момента, то есть сферические гармоники:
- L^2Ylm=ℏ2l(l+1)Ylm{\displaystyle {\hat {L}}^{2}Y_{lm}=\hbar ^{2}l(l+1)Y_{lm}}.
Вклад вращения в энергию молекулы равен
- Erot=ℏ2l(l+1)2μR2{\displaystyle E_{rot}={\frac {\hbar ^{2}l(l+1)}{2\mu R^{2}}}}.
Этот вклад мал, потому, что массы ядер намного больше, чем массы электронов. Он зависит от расстояния между ядрами R. При колебаниях ядер это расстояние меняется, поэтому вращательное движение, строго говоря, невозможно отделить от колебательного. Однако при малых l и при малых энергиях колебательного движения можно считать, что R равняется определённому среднему значению.
Вращательные уровни вырождены относительно магнитного квантового числа ml. Кратность вырождения 2l+1.
Колебания атомов
Вблизи минимума функцию Esym(R)+ℏ2l(l+1)2μR2{\displaystyle {\mathcal {E}}_{sym}(R)+{\frac {\hbar ^{2}l(l+1)}{2\mu R^{2}}}} можно разложить в ряд Тейлора, ограничившись только квадратичным членом.
- U(R)≈Esym(R)+ℏ2l(l+1)2μR2=E(R)+ℏ2l(l+1)2μR2+μω22(R−R2){\displaystyle U(R)\approx {\mathcal {E}}_{sym}(R)+{\frac {\hbar ^{2}l(l+1)}{2\mu R^{2}}}={\mathcal {E}}(R_{0})+{\frac {\hbar ^{2}l(l+1)}{2\mu R_{0}^{2}}}+{\frac {\mu \omega ^{2}}{2}}(R-R_{0}^{2})},
где
- μω2=d2UdR2|R=R{\displaystyle \mu \omega ^{2}=\left.{\frac {d^{2}U}{dR^{2}}}\right|_{R=R_{0}}}
Таким образом, задача об энергетических состояниях колебания ядер сводится к задаче квантового гармонического осциллятора. Следовательно, для низших колебательных и вращательных уровней энергия молекулы водорода равна
- Es,n,l=Esym(R)+ℏ2l(l+1)2μR2+ℏω(v+12){\displaystyle E_{s,n,l}={\mathcal {E}}_{sym}(R_{0})+{\frac {\hbar ^{2}l(l+1)}{2\mu R^{2}}}+\hbar \omega \left(v+{\frac {1}{2}}\right)},
где v=,1…{\displaystyle v=0,1\ldots } — колебательное квантовое число.
Низшая энергия колебания ℏω2{\displaystyle {\frac {\hbar \omega }{2}}} отвечает нулевым колебаниям.
При больших значениях квантовых чисел n и l колебательное и вращательное движение разделить невозможно.
Таким образом, энергию молекулы при малых квантовых числах можно записать в виде трёх слагаемых — электронного, колебательного и вращательного:
- Es,n,l=Eel+Ev+Er{\displaystyle E_{s,n,l}=E_{el}+E_{v}+E_{r}}
Малым параметром задачи является отношение массы электрона к массе протона. Электронное слагаемое не зависит от этого отношения, колебательное пропорционально mM{\displaystyle {\sqrt {m/M}}}, вращательное пропорционально mM{\displaystyle m/M}. Поэтому
- Eel≫Ev≫Er{\displaystyle E_{el}\gg E_{v}\gg E_{r}}.
Следовательно, электронный уровень расщепляется на несколько колебательных, каждый из которых, в свою очередь, расщепляется на вращательные. Поскольку энергии вращательных уровней близки, то в оптических спектрах они сливаются в полосы — образуется полосатый спектр, который наблюдается для молекулы HD. Для симметричной молекулы H2 переходы между орбитальными и колебательными уровнями запрещены правилами отбора, поэтому молекулярный протий не поглощает в инфракрасной области.
Ионная связь
При описании строения атомов было показано, что все атомы, за исключением атомов благородных газов, стремятся присоединить или отдать электроны. Причина — образование устойчивого восьмиэлектронного внешнего уровня (как у благородных газов). При приёме или отдаче электронов возникают электрические заряды и, как следствие, электростатическое взаимодействие частиц. Так возникает ионная связь.
Ионная связь — это связь между ионами.
Ионы — это устойчивые заряженные частицы, которые образуются в результате приема или отдачи электронов.
Например, в реакции участвует атом активного металла и активного неметалла:
В этом процессе атом металла (натрия) отдаёт электроны (рис. 14).

Таким образом, в этом процессе образовалась устойчивая частица (8 электронов на внешнем уровне), которая имеет заряд, так как у ядра атома натрия заряд по-прежнему +11, а оставшиеся электроны имеют суммарный заряд –10. Поэтому заряд иона натрия +1. Кратко запись этого процесса выглядит так:
Что происходит с атомом серы? Этот атом принимает электроны до завершения внешнего уровня (рис. 15).
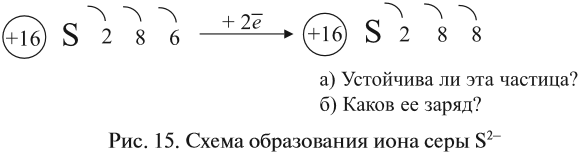
Простой подсчёт показывает, что эта частица имеет заряд:
Кратко:
Разноименно заряженные ионы притягиваются, в результате чего возникает ионная связь и «ионная молекула»:
Существуют и другие способы образования ионов (см. урок 6).
Формально сульфиду натрия приписывают именно такой состав молекулы, хотя вещество, состоящее из ионов, имеет приблизительно такое строение (рис. 16).
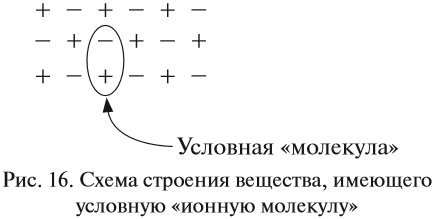
Таким образом, можно сказать определённо, что вещества, состоящие из ионов, не содержат отдельных молекул! В этом случае можно говорить лишь об условной «ионной молекуле».
Задание 4.1. Покажите, как происходит переход электронов при возникновении ионной связи между атомами:
- кальцием и хлором;
- алюминием и кислородом.
Помните! Атом металла отдаёт внешние электроны; атом неметалла принимает недостающие электроны.
Вывод. Ионная связь по описанному выше механизму образуется между атомами активных металлов и активных неметаллов.

Продолжим!
В воде кластеры периодически разрушаются и образуются снова. Время перескока составляет 10-12 секунд.
Так как, строение молекулы воды несимметрично, то центры тяжести положительных и отрицательных зарядов ее не совпадают. Молекулы имеют два полюса — положительный и отрицательный, создающие, как магнит, молекулярные силовые поля. Такие молекулы называют полярными, или диполями, а количественную характеристику полярности определяют электрическим моментом диполя, выражаемым произведением расстояния l между электрическими центрами тяжести положительных и отрицательных зарядов молекулы на заряд e в абсолютных электростатических единицах: p = l·e
Для воды дипольный момент очень высокий: p = 6,13·10-29 Кл·м.
Кластеры воды на границах раздела фаз (жидкость-воздух) выстраиваются в определенном порядке, при этом все кластеры колеблются с одинаковой частотой, приобретая одну общую частоту. При таком движении кластеров, учитывая, что входящие в кластер молекулы воды являются полярными, то есть, имеют большой дипольный момент, следует ожидать появления электромагнитного излучения. Это излучение отличается от излучения свободных диполей, так как диполи являются связанными и колеблются совместно в кластерной структуре.
Частота колебаний кластеров воды и соответственно, частота электромагнитных колебаний может быть определена по следующей формуле:
aМ
V
Объем кластера определяется с учетом размеров фрактальной замкнутой структуры кластера или по аналогии с размерами домена белка.При комнатной температуре 18°С частота колебаний кластера f равна 6,79·109 Гц, то есть длина волны в свободном пространстве должна составлять λ = 14,18 мм.
Но что, же будет происходить при воздействии на воду внешнего электромагнитного излучения? Поскольку вода является самоорганизованной структурой и содержит как упорядоченные в кластеры элементы, так и свободные молекулы, то при воздействии внешнего электромагнитного излучения будет происходить следующее. При сближении молекул воды (расстояние изменяется от R до R1) энергия взаимодействия изменяется на большую величину, чем при их взаимном удалении (расстояние изменяется от R до R2).
Но, поскольку молекулы воды имеют большой дипольный момент, то в случае внешнего электромагнитного поля, они будут совершать колебательные движения (например, от R1 до R2). При этом в силу приведенной зависимости приложенное электромагнитное поле будет больше способствовать притяжению молекул и тем самым организованности системы в целом, т.е. образованию гексагональной структуры.
При наличии же примесей в водной среде, они покрываются гидратной оболочкой таким образом, что общая энергия системы стремится принять минимальное значение. И если общий дипольный момент гексагональной структуры равен нулю, то в присутствие примесей гексагональная структура вблизи них нарушается таким образом, чтобы система приняла минимальное значение, в ряде случаев шестиугольники преобразуются в пятиугольники, и гидратная оболочка имеет форму близкую к шару. Примеси (например, ионы Na+) могут стабилизировать структуру, делать ее более устойчивой к разрушению.
Самоорганизованная система воды при воздействии электромагнитного излучения не будет перемещаться как единое целое, но каждый элемент гексагональной, а в случае примесей локально и другого вида, структуры будет смещаться, т.е. будет происходить искажение геометрии структуры, т.е. возникать напряжения. Такое свойство воды очень напоминает полимеры. Но полимерные структуры обладают большими временами релаксации, которые составляют не 10-11–10-12 с, а минуты и больше. Поэтому энергия квантов электромагнитного излучения, переходя во внутреннюю энергию организованной водной структуры в результате её искажений, будет накапливаться ею, пока не достигнет энергии водородной связи, которая в 500–1000 раз больше энергии электромагнитного поля. При достижении этой величины происходит разрыв водородной связи, и структура разрушается.
Это можно сравнить со снежной лавиной, когда происходит постепенное, медленное накапливание массы, а затем стремительный обвал. В случае с водой происходит разрыв не только слабой связи между кластерами, но и более сильных связей — в строении молекул воды. В результате этого разрыва могут образовываться Н+, ОН–, и гидратированный электрон е–. Голубой цвет чистой воды обязан наличию именно этих электронов, а не только рассеянию естественного света.
Металлическая химическая связь
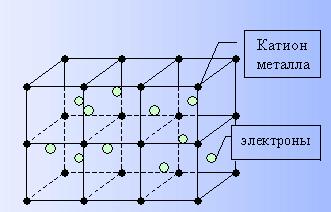
Металлическая связь — это связь, которую образуют относительно свободные электроны между ионами металлов, образующих кристаллическую решетку.
У атомов металлов на внешнем энергетическом уровне обычно расположены от одного до трех электронов. Радиусы у атомов металлов, как правило, большие — следовательно, атомы металлов, в отличие от неметаллов, достаточно легко отдают наружные электроны, т.е. являются сильными восстановителями.
Отдавая электроны, атомы металлов превращаются в положительно заряженные ионы. Оторвавшиеся электроны относительно свободно перемещаются между положительно заряженными ионами металлов. Между этими частицами возникает связь, т.к. общие электроны удерживают катионы металлов, расположенные слоями, вместе, создавая таким образом достаточно прочную металлическую кристаллическую решетку. При этом электроны непрерывно хаотично двигаются, т.е. постоянно возникают новые нейтральные атомы и новые катионы.
Межмолекулярные взаимо-действия
Отдельно стоит рассмотреть взаимодействия, возникающие между отдельными молекулами в веществе — межмолекулярные взаимодействия. Межмолекулярные взаимодействия — это такой вид взаимодействия между нейтральными атомами, при котором не появляеются новые ковалентные связи. Силы взаимодействия между молекулами обнаружены Ван-дер Ваальсом в 1869 году, и названы в честь него Ван-дар-Ваальсовыми силами. Силы Ван-дер-Ваальса делятся на ориентационные, индукционные и дисперсионные. Энергия межмолекулярных взаимодейстий намного меньше энергии химической связи.
Ориентационные силы притяжения возникают между полярными молекулами (диполь-диполь взаимодействие). Эти силы возникают между полярными молекулами. Индукционные взаимодействия — это взаимодействие между полярной молекулой и неполярной. Неполярная молекула поляризуется из-за действия полярной, что и порождает дополнительное электростатическое притяжение.
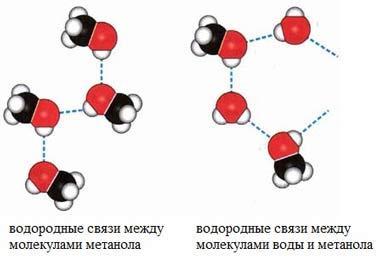
Особый вид межмолекулярного взаимодействия — водородные связи. Водородные связи — это межмолекулярные (или внутримолекулярные) химические связи, возникающие между молекулами, в которых есть сильно полярные ковалентные связи — H-F, H-O или H-N. Если в молекуле есть такие связи, то между молекулами будут возникать дополнительные силы притяжения.
Механизм образования водородной связи частично электростатический, а частично — донорно–акцепторный. При этом донором электронной пары выступают атом сильно электроотрицательного элемента (F, O, N), а акцептором — атомы водорода, соединенные с этими атомами. Для водородной связи характерны направленность в пространстве и насыщаемость.
Водородную связь можно обозначать точками: Н ··· O. Чем больше электроотрицательность атома, соединенного с водородом, и чем меньше его размеры, тем крепче водородная связь. Она характерна прежде всего для соединений фтора с водородом, а также кислорода с водородом, в меньшей степени азота с водородом.
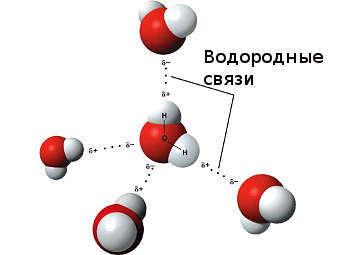
Водородные связи возникают между следующими веществами:
— фтороводород HF (газ, раствор фтороводорода в воде — плавиковая кислота), вода H2O (пар, лед, жидкая вода):
— раствор аммиака и органических аминов — между молекулами аммиака и воды;
— органические соединения, в которых связи O-H или N-H: спирты, карбоновые кислоты, амины, аминокислоты, фенолы, анилин и его производные, белки, растворы углеводов — моносахаридов и дисахаридов.
Водородная связь оказывает влияние на физические и химические свойства веществ. Так, дополнительное притяжение между молекулами затрудняет кипение веществ. У веществ с водородными связями наблюдается аномальное повышение тепературы кипения.
Например, как правило, при повышении молекулярной массы наблюдается повышение температуры кипения веществ. Однако в ряду веществ H2O-H2S-H2Se-H2Te мы не наблюдаем линейное изменение температур кипения.
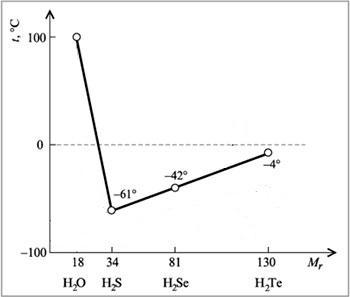
А именно, у воды температура кипения аномально высокая — не меньше -61оС, как показывает нам прямая линия, а намного больше, +100 оС. Эта аномалия объясняется наличием водородных связей между молекулами воды. Следовательно, при обычных условиях (0-20оС) вода является жидкостью по фазовому состоянию.
Волновые функции
Схематическое изображение симметричной волновой функции молекулы водорода и образования ковалентной связи
Схематическое изображение антисимметричной волновой функции молекулы водорода
Исходя из принципа тождественности частиц и учитывая то, что электроны являются фермионами, волновая функция молекулы водорода должна быть антисимметричной относительно перестановки электронов. Независимость гамильтониана от спиновых переменных позволяет выбрать её в виде произведения двух функций, одна из которых зависит только от координат и называется координатной волновой функцией, а вторая зависит только от спинов и называется спиновой функцией.
Существуют два возможных типа спиновых функций для двух электронов: с параллельными спинами и с антипараллельными спинами. Функции с параллельными спинами симметричны относительно перестановки электронов и образуют триплетные состояния, в которых суммарный спин равен единице. Функции с антипараллельными спинами образуют синглетные состояния с нулевым суммарным спином (см. Мультиплетность, Состояние (квантовая механика)). Они антисимметричны относительно перестановки электронов.
Поскольку волновая функция электрона должна быть антисимметричной относительно перестановки, она может быть произведением либо
- симметричной координатной функции на антисимметричную спиновую функцию, либо
- антисимметричной координатной функции на симметричную спиновую функцию.
Симметричную и антисимметричную координатные функции основного состояния в нулевом приближении теории возмущений можно построить исходя из волновых функций основного состояния атома водорода ψ1s{\displaystyle \psi _{1s}} .
- ψsym=12(ψ1s1(r1)ψ1s2(r2)+ψ1s1(r2)ψ1s2(r1)){\displaystyle \psi _{sym}={\frac {1}{\sqrt {2}}}\left(\psi _{1s1}(\mathbf {r} _{1})\psi _{1s2}(\mathbf {r} _{2})+\psi _{1s1}(\mathbf {r} _{2})\psi _{1s2}(\mathbf {r} _{1})\right)}
- ψasym=12(ψ1s1(r1)ψ1s2(r2)−ψ1s1(r2)ψ1s2(r1)){\displaystyle \psi _{asym}={\frac {1}{\sqrt {2}}}\left(\psi _{1s1}(\mathbf {r} _{1})\psi _{1s2}(\mathbf {r} _{2})-\psi _{1s1}(\mathbf {r} _{2})\psi _{1s2}(\mathbf {r} _{1})\right)}
Первый член каждой из приведенных волновых функций отвечает локализации электрона, пронумерованного индексом 1 на атоме с индексом 1 и электрона, пронумерованного индексом 2 на атоме с индексом 2. Второй член отвечает ситуации, когда первый электрон принадлежит второму атому, а второй — первому. При смене нумерации электронов первая (симметричная) функция не меняется, вторая (антисимметричная) — меняет знак.
Свойства соединений с ковалентной связью
Вещества с ковалентными связями делятся на две неравные группы: молекулярные и атомные (или немолекулярные), которых значительно меньше, чем молекулярных.
Молекулярные соединения в обычных условиях могут находиться в различных агрегатных состояниях: в виде газов (CO2 , NH3 , CH4 , Cl2 , O2 , NH3 ), легколетучих жидкостей (Br2 , H2O, C2H5OH ) или твердых кристаллических веществ, большинство из которых даже при очень незначительном нагревании способны быстро плавиться и легко сублимироваться (S8 , P4 , I2 , сахар С12Н22О 11 , «сухой лед» СО2 ).
Низкие температуры плавления, возгонки и кипения молекулярных веществ объясняются очень слабыми силами межмолекулярного взаимодействия в кристаллах. Именно поэтому для молекулярных кристаллов не присуща большая прочность, твердость и электрическая проводимость (лед или сахар). При этом вещества с полярными молекулами имеют более высокие температуры плавления и кипения, чем с неполярными. Некоторые из них растворимы в воде или других полярных растворителях. А вещества с неполярными молекулами, наоборот, лучше растворяются в неполярных растворителях (бензол, тетрахлорметан). Так, йод, у которого молекулы неполярные, не растворяется в полярной воде, но растворяется в неполярной CCl4 и малополярном спирте.
Немолекулярные (атомные) вещества с ковалентными связями (алмаз, графит, кремний Si, кварц SiO2 , карборунд SiC и другие) образуют чрезвычайно прочные кристаллы, за исключением графита, кристаллическая решетка которого имеет слоистую структуру. Например, кристаллическая решетка алмаза — правильный трехмерный каркас, в котором каждый sр3-гибридизованный атом углерода соединен с четырьмя соседними атомами С σ-связями. По сути весь кристалл алмаза — это одна огромная и очень прочная молекула. Аналогичное строение имеют и кристаллы кремния Si, который широко применяется в радиоэлектронике и электронной технике. Если заменить половину атомов С в алмазе атомами Si, не нарушая каркасную структуру кристалла, то получим кристалл карборунда — карбида кремния SiC — очень твердого вещества, используемого в качестве абразивного материала. А если в кристаллической решетке кремния между каждыми двумя атомами Si вставить по атому О, то образуется кристаллическая структура кварца SiO2 — тоже очень твердого вещества, разновидность которого также используют как абразивный материал.
Кристаллы алмаза, кремния, кварца и подобные им по структуре — это атомные кристаллы, они представляют собой огромные «супермолекулы», поэтому их структурные формулы можно изобразить не полностью, а только в виде отдельного фрагмента, например:
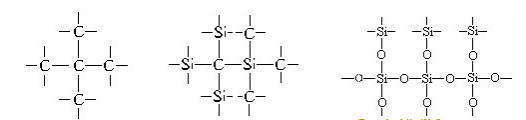
Кристаллы алмаза, кремния, кварца
Немолекулярные (атомные) кристаллы, состоящие из соединенных между собой химическими связями атомов одного или двух элементов, относятся к тугоплавким веществам. Высокие температуры плавления обусловлены необходимостью затраты большого количества энергии для разрыва прочных химических связей при плавлении атомных кристаллов, а не слабого межмолекулярного взаимодействия, как в случае молекулярных веществ. По этой же причине многие атомные кристаллов при нагревании не плавятся, а разлагаются или сразу переходят в парообразное состояние (возгонка), например, графит сублимируется при 3700oС.
Немолекулярные вещества с ковалентными связями нерастворимые в воде и других растворителях, большинство из них не проводит электрический ток (кроме графита, которому присуща электропроводность, и полупроводников — кремния, германия и др.).