Молекула
Содержание:
Геометрия молекул. Гибридизация.
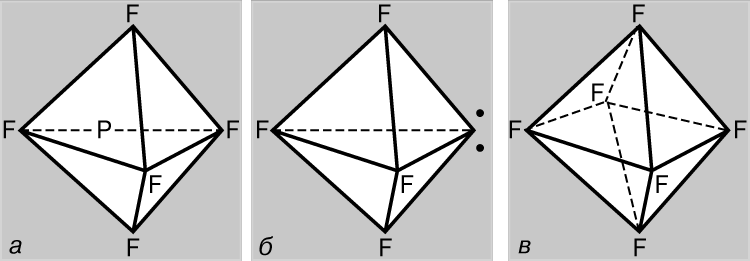
Все атомные орбитали, кроме s, сферически несимметричны, и степень их перекрывания с АО других атомов зависит от взаимной ориентации орбиталей. Так, р-АО будет перекрываться с АО другого атома в наибольшей степени, если последняя расположена вдоль ее оси (рис. 4,а). Это означает, что связи, образующиеся в результате перекрывания АО, должны обладать специфической геометрией. Рассмотрим атом углерода в 5S-состоянии. У него имеется по одному электрону на трех р-орбиталях и на четвертой, сферически симметричной s-орбитали. Казалось бы, три связи, которые он образует, будут отличаться от четвертой, при этом р-связи будут располагаться во взаимно перпендикулярных направлениях вдоль осей р-АО. На самом деле наблюдается другая, совершенно симметричная картина. Проще всего объяснить ее следующим образом. Набор орбиталей (2s)+(2px)+(2py)+(2pz) – это некий объем «орбитального пространства», способный удерживать четыре пары электронов. Мы можем получить эквивалентное описание этой ситуации, смешав все орбитали и разделив их сумму на четыре равные части, так что на каждой из образовавшихся смешанных, или гибридных, орбиталей будет располагаться одна пара электронов. Следовательно, 5S-состояние углерода можно представить в виде (1s)2(t1)(t2)(t3)(t4), где ti – гибридные орбитали, что с успехом объясняет образование симметричной молекулы четырехвалентного углерода. Рассмотрим теперь, что произойдет при смешивании р-АО с s-АО. Усиление одной половины р-гантели при интерференции неизменно будет сопровождаться ослаблением другой ее половины (рис. 4,б), в результате чего образуется асимметричная гибридная орбиталь (рис. 4,в). Она будет эффективно перекрываться другими орбиталями, ориентированными в том же направлении, с образованием достаточно прочных связей. Это одна из причин, почему атом углерода предпочитает образовывать связи через гибридизацию АО. Но есть и другая причина. Рассмотрим типичное соединение четырехвалентного углерода, например метан СН4. В нем каждый водородный атом удерживается вблизи атома углерода парой обобществленных электронов. Эти пары взаимно отталкиваются, и оптимальной является такая конфигурация молекулы, при которой они находятся друг от друга на максимально возможном расстоянии. В этом случае атомы водорода будут располагаться в вершинах правильного тетраэдра, а атом углерода – в его центре. Такая геометрия может реализоваться с помощью т.н. sp3-гибридных орбиталей, каждая из которых образована 1/4 частью 2s-АО и одной из 2р-АО. Все эти орбитали одинаковы по форме, легко образуют связи и направлены от углеродного атома в центре правильного тетраэдра к четырем его вершинам (рис. 1,г).
Атом азота мог бы образовать связи только с помощью 2р-АО, углы между которыми составляли бы 90°, но взаимное отталкивание пар связывающих электронов и пар несвязывающих электронов 2-й оболочки минимизируется, если в образовании связей участвуют «тетраэдрические» sp3-орбитали. Здесь, однако, проявляется еще одна особенность. Для иона N+ конфигурации (1s)2(2s)(2p)3 и (1s)2(t)4, где t – sp3-гибридные АО, действительно эквивалентны. Другое дело – нейтральный атом азота, 7-й электрон которого может занять либо 2s-АО, и тогда получится конфигурация (1s)2(2s)(2p)4, либо t-АО в конфигурации (1s)2(t)5. Поскольку 2s-АО расположена ниже 2p-АО и, следовательно, ниже любой sp-гибридной орбитали, первая конфигурация оказывается энергетически более выгодной и можно было бы ожидать, что при прочих равных условиях трехвалентный азот предпочтет «негибридизованную» конфигурацию. Однако взаимного расталкивания пар электронов, по-видимому, достаточно для того, чтобы произошла гибридизация, при которой валентные углы в таком соединении азота, как аммиак NH3, близки к соответствующим углам в правильном тетраэдре, т.е. к 109°. То же относится и к двухвалентному кислороду в составе молекулы воды Н2О. Во всех этих случаях связанные атомы занимают три (или две) вершины тетраэдра, а пары неподеленных электронов 2-й оболочки – оставшиеся вершины.
Аналогичные рассуждения применимы и к другим типичным элементам IV, V и VI групп периодической таблицы. Четырехвалентные элементы IV группы (Si, Ge, Sn и Pb) всегда образуют тетраэдрические структуры, однако другие элементы V и VI групп (P, S, As, Se, Sb, Te) отличаются от азота и кислорода и образуют соединения с валентными углами, близкими к 90°. По-видимому, из-за большего размера этих атомов взаимного отталкивания валентных электронов оказывается недостаточно, чтобы стала возможна гибридизация, наблюдаемая для N и О.
Электрические и оптические свойства молекул
Поведение вещества в электрическом поле определяется основными электрическими характеристиками молекул — постоянным дипольным моментом и поляризуемостью.
Дипольный момент означает несовпадение «центров тяжести» положительных и отрицательных зарядов в молекуле (электрическую асимметрию молекулы). То есть молекулы, имеющие центр симметрии, например H2, лишены постоянного дипольного момента, и наоборот.
Поляризуемость — это способность электронной оболочки любой молекулы перемещаться под действием электрического поля, в результате чего в молекуле образуется наведенный дипольный момент. Значение дипольного момента и поляризуемости находят экспериментально с помощью измерения диэлектрической проницаемости.
Оптические свойства вещества характеризуют его поведение в переменном электрическом поле световой волны и определяются поляризуемостью молекулы этого вещества. С поляризуемостью непосредственно связаны преломление и рассеяние света, оптическая активность и другие явления, изучаемые молекулярной оптикой.
Моль вещества
Массы отдельных молекул и атомов очень малы, поэтому в расчётах удобнее использовать не абсолютные значения масс, а относительные.
Относительная молекулярная масса (или относительная атомная масса) вещества Мr – это отношение массы молекулы (или атома) данного вещества к 1/12 массы атома углерода. Мr = (m) : (m0C / 12)
где m – масса молекулы (или атома) данного вещества, m0C – масса атома углерода.
Относительная молекулярная (или атомная) масса вещества показывает, во сколько раз масса молекулы вещества больше 1/12 массы изотопа углерода С12. Относительная молекулярная (атомная) масса выражается в атомных единицах массы.
Атомная единица массы – это 1/12 массы изотопа углерода С12. Точные измерения показали, что атомная единица массы составляет 1,660*10-27 кг, то есть 1 а.е.м. = 1,660 * 10-27 кг Относительная молекулярная масса вещества может быть вычислена путём сложения относительных атомных масс элементов, входящих в состав молекулы вещества. Относительная атомная масса химических элементов указана в периодической системе химических элементов Д.И. Менделеева.
В периодической системе Д.И. Менделеева для каждого элемента указана атомная масса, которая измеряется в атомных единицах массы (а.е.м.). Например, атомная масса магния равна 24,305 а.е.м., то есть магний в два раза тяжелее углерода, так как атомная масса углерода равна 12 а.е.м. (это следует из того, что 1 а.е.м. = 1/12 массы изотопа углерода, который составляет большую часть атома углерода).
Зачем измерять массу молекул и атомов в а.е.м., если есть граммы и килограммы? Конечно, можно использовать и эти единицы измерения, но это будет очень неудобно для записи (слишком много чисел придётся использовать для того, чтобы записать массу). Чтобы найти массу элемента в килограммах, нужно атомную массу элемента умножить на 1 а.е.м. Атомная масса находится по таблице Менделеева (записана справа от буквенного обозначения элемента). Например, вес атома магния в килограммах будет: m0Mg = 24,305 * 1 a.e.м. = 24,305 * 1,660 * 10-27 = 40,3463 * 10-27 кг Массу молекулы можно вычислить путём сложения масс элементов, которые входят в состав молекулы. Например, масса молекулы воды (Н2О) будет равна: m0Н2О = 2 * m0H + m0O = 2 * 1,00794 + 15,9994 = 18,0153 a.e.м. = 29,905 * 10-27 кг
Количество вещества принято считать пропорциональным числу частиц. Количество вещества – это физическая величина, характеризующая относительное число молекул и атомов в теле. Единица количества вещества называется молем (моль).
Моль равен количеству вещества системы, в которой содержится столько же молекул, сколько содержится атомов в 0,012 кг углерода С12. То есть, если у нас есть система с каким-либо веществом, и в этой системе столько же молекул этого вещества, сколько атомов в 0,012 кг углерода, то мы можем сказать, что в этой системе у нас 1 моль вещества.
Постоянная Авогадро
Количество вещества ν равно отношению числа молекул в данном теле к числу атомов в 0,012 кг углерода, то есть количеству молекул в 1 моле вещества. ν = N / NA где N – количество молекул в данном теле, NA – количество молекул в 1 моле вещества, из которого состоит тело.
NA – это постоянная Авогадро. Количество вещества измеряется в молях.
Постоянная Авогадро – это количество молекул или атомов в 1 моле вещества. Эта постоянная получила своё название в честь итальянского химика и физика Амедео Авогадро (1776 – 1856).
В 1 моле любого вещества содержится одинаковое количество частиц. NA = 6,02 * 1023 моль-1
Молярная масса – это масса вещества, взятого в количестве одного моля: μ = m * NA где m – масса молекулы.
Молярная масса выражается в килограммах на моль (кг/моль = кг*моль-1).
Молярная масса связана с относительной молекулярной массой соотношением: μ = 10-3 * Mr Масса любого количества вещества m равна произведению массы одной молекулы m на количество молекул: m = mN = mNAν = μν Количество вещества равно отношению массы вещества к его молярной массе: ν = m / μ Массу одной молекулы вещества можно найти, если известны молярная масса и постоянная Авогадро: m = m / N = m / νNA = μ / NA Более точное определение массы атомов и молекул достигается при использовании масс-спректрометра – прибора, в котором происходит разделение пучком заряженных частиц в пространстве в зависимости от их массы заряда при помощи электрических и магнитных полей.
Для примера найдём молярную массу атома магния. Как мы выяснили выше, масса атома магния равна m0Mg = 40,3463 * 10-27кг. Тогда молярная масса будет: μ = m0Mg * NA = 40,3463 * 10-27 * 6,02 * 1023 = 2,4288 * 10-2 кг/моль То есть в одном моле «помещается» 2,4288 * 10-2 кг магния. Ну или примерно 24,28 грамм.
Как видим, молярная масса (в граммах) практически равна атомной массе, указанной для элемента в таблице Менделеева. Поэтому когда указывают атомную массу, то обычно делают так:
Атомная масса магния равна 24,305 а.е.м. (г/моль).
Движение молекул в газах, жидкостях и твёрдых телах
Агрегатные состояния вещества (от латинского aggrego – присоединяю, связываю) – состояния одного и того же вещества, переходы между которыми сопровождаются изменением его физических свойств. В этом и заключается изменение агрегатных состояний вещества.
Примеры веществ молекулярного строения
К молекулярным веществам относятся:
- Большинство простых веществ-неметаллов: кислород (O2), сера (S2), фосфор (P4), водород (H2), азот (N2), хлор (Cl2), фтор (F2), бром (Br2), йод (I2);
- Соединения веществ-неметаллов друг с другом: аммиак (NH3), углекислый газ (CO2), серная кислота (HSO4), оксид азота (N2O5);
- Сахар;
- Нафталин.
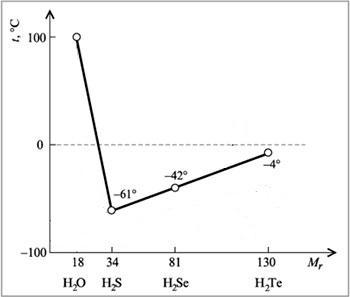
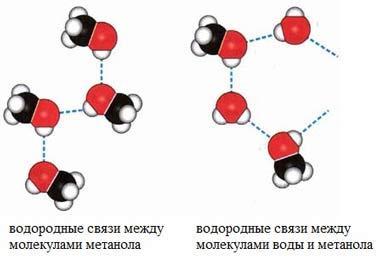
Молекулярная кристаллическая решетка образована молекулами, которые соединены между собой слабыми силами межмолекулярного притяжения. Поэтому эти вещества летучи (их можно обнаружить по запаху), имеют низкие температуры плавления, малую твердость (хрупкие) и являются диэлектриками (практически не проводят электрический ток).
Чаще всего молекулярные вещества при нормальных условиях находятся в жидком или газообразном агрегатном состоянии. Некоторые молекулярные вещества могут быть в твердом виде, но их отличительными свойствами являются: легкоплавкость и растворимость в воде (если в узлах полярные молекулы). Примерами таких веществ могут служить: сахар, глюкоза, нафталин, CO2 (“сухой лед”).
Рис. 3. Молекулярные кристаллические решетки, например: кислород, сера йод, вода:.
Атомов в составе молекулы может быть от 2 штук до бесконечности. Одно из первых мест по количеству атомов занимает молекула ДНК (дезоксирибонуклеиновая — кислота). В одной молекуле ДНК содержится атомов:
- углерода — 5750;
- водорода — 7227;
- кислорода — 4131;
- азота — 2215;
- фосфора — 590.
Что мы узнали?
Итак, мы узнали, что к веществам с молекулярным строением относятся газообразные, жидкие и твердые вещества, молекулярная кристаллическая решетка которых образована молекулами, соединенными между собой слабыми силами межмолекулярного притяжения. Такие вещества летучи (обнаруживаются по запаху), имеют низкие температуры плавления, малую твердость (хрупкие) и являются диэлектриками (практически не проводят электрический ток).
Движение молекул в жидкостях
В жидкостях молекулы не только колеблются около положения равновесия, но и совершают перескоки из одного положения равновесия в соседнее. Эти перескоки происходят периодически. Временной отрезок между такими перескоками получил названиесреднее время оседлой жизни (или среднее время релаксации) и обозначается буквой ?. Иными словами, время релаксации – это время колебаний около одного определённого положения равновесия. При комнатной температуре это время составляет в среднем 10-11 с. Время одного колебания составляет 10-12…10-13 с.
Жидкости, как и твёрдые тела, сохраняют свой объём, но не имеют собственной формы. Поэтому они принимают форму сосуда, в котором находятся. Жидкость обладает таким свойством, кактекучесть. Благодаря этому свойству жидкость не сопротивляется изменению формы, мало сжимается, а её физические свойства одинаковы по всем направлениям внутри жидкости (изотропия жидкостей). Впервые характер молекулярного движения в жидкостях установил советский физик Яков Ильич Френкель (1894 – 1952).
Структура атома
Атомы состоят из еще меньших, чем они сами, частиц, называемых элементарными. Центром атома является его ядро. Оно состоит из элементарных частиц двух видов — протонов и нейтронов. Есть в атоме также другие элементарные частицы — электроны; они вращаются вокруг ядра. Существует множество разных элементарных частиц. Ученые считают, что протоны и нейтроны состоят из кварков. Элементарные частицы, входящие в состав атома, удерживаются вместе благодаря своим электрическим зарядам. Протоны заряжены положительно, а электроны — отрицательно. Нейтроны заряда не имеют, т.е. являются электрически нейтральными. Частицы, несущие противоположные электрические заряды, притягиваются друг к другу. Притяжение отрицательно заряженных электронов к положительно заряженным протонам, находящимся в атомном ядре, удерживает электроны на орбитах около этого ядра. В состав атома входит одинаковое число положительно заряженных протонов и отрицательно заряженных электронов, и атом электрически нейтрален.
Электроны в атоме находятся на разных энергетических уровнях, или оболочках. Каждая оболочка состоит из определенного числа электронов. Когда очередная оболочка заполняется, новые электроны попадают на следующую оболочку. Большую часть объема атома занимает пустое пространство между элементарными частицами. Отрицательно заряженные электроны удерживаются на своих энергетических уровнях силой притяжения к положительно заряженным протонам ядра.
Строение атома часто описывают строгой диаграммой, однако сегодня ученые полагают, что электроны существуют на своих орбитах в размытом состоянии. Это представление отражено на рисунке, где электронные орбиты представлены в виде «облаков». Так вы бы увидели молекулу под электронным микроскопом. Равными цветами показаны разные уровни плотности электронов. Бирюзовым цветом отмечена область наибольшей плотности.
Представление структуры молекул
Молекулы состоят из электронов и атомных ядер, расположение последних в молекуле передаёт структурная формула (для передачи состава используется т. н. брутто-формула). Молекулы белков и некоторых искусственно синтезированных соединений могут содержать сотни тысяч атомов. Отдельно рассматриваются макромолекулы полимеров.
Молекулы являются объектом изучения теории строения молекул, квантовой химии, аппарат которых активно использует достижения квантовой физики, в том числе релятивистских её разделов. Также в настоящее время развивается такая область химии, как молекулярный дизайн. Для определения строения молекул конкретного вещества современная наука располагает колоссальным набором средств: электронная спектроскопия, колебательная спектроскопия, ядерный магнитный резонанс и электронный парамагнитный резонанс и многие другие, но единственными прямыми методами в настоящее время являются дифракционные методы, как то: рентгеноструктурный анализ и дифракция нейтронов.