15 самых интригующих фактов об атомах
Содержание:
- Представление структуры молекул
- Молекулы газов
- Связи с участием d-орбиталей.
- Спектры и строение молекул
- Лучшие ответы
- Электрическая сила
- Хаотическое движение частиц
- Взаимодействие атомов при образовании молекулы
- Сравнение атома и молекулы
- Чем атом отличается от молекулы
- Молекулы в химии, физике и биологии
- Атом и молекула: отличные свойства
- Строение вещества
- Электрические и оптические свойства молекул
- Индивидуальные вещества и смеси
Представление структуры молекул
Молекулы состоят из электронов и атомных ядер, расположение последних в молекуле передаёт структурная формула (для передачи состава используется т. н. брутто-формула). Молекулы белков и некоторых искусственно синтезированных соединений могут содержать сотни тысяч атомов. Отдельно рассматриваются макромолекулы полимеров.
Молекулы являются объектом изучения теории строения молекул, квантовой химии, аппарат которых активно использует достижения квантовой физики, в том числе релятивистских её разделов. Также в настоящее время развивается такая область химии, как молекулярный дизайн. Для определения строения молекул конкретного вещества современная наука располагает колоссальным набором средств: электронная спектроскопия, колебательная спектроскопия, ядерный магнитный резонанс и электронный парамагнитный резонанс и многие другие, но единственными прямыми методами в настоящее время являются дифракционные методы, как то: рентгеноструктурный анализ и дифракция нейтронов.
Молекулы газов
Молекулы газов, распространенных и очень редких, равномерно перемешаны в воздухе (хотя большая часть озона находится в тонком слое атмосферы на высоте около 24 километров). Молекулы летают вокруг нас со скоростями от 1 100 до 4 800 километров в час. Траектории их полета так коротки, что их невозможно различить не вооруженным глазом. Пока вы это читаете, молекула криптона наверняка уже успела побывать у вас в носу.
Молекула озона
Представьте себе, что сантиметр поделен на миллиард равных частей. Одна из этих частей примерно равна диаметру молекулы воздуха. Молекулы — это связки атомов, лучше даже сказать, что это гроздья из атомов. Чем больше атомов соединены вместе, тем крупнее молекула. Молекула воды состоит из двух атомов водорода и одного атома кислорода. Но есть крупные молекулы, например молекулы ДНК, содержащиеся в животных и растительных клетках, которые состоят из десятков миллионов атомов.
Размер молекул газов атмосферы Земли
Размер молекул газов атмосферы Земли
Большинство молекул воздуха очень малы. Например, молекула кислорода состоит из двух атомов кислорода, молекула азота — из двух атомов азота. Каждая из этих молекул измеряется стомиллионными и миллиардными долями сантиметра. Очень трудно представить себе дюйм, поделенный на столь мелкие части. Но мы можем получить некоторое представление о размерах молекул воздуха, если сравним их с кристаллами поваренной соли, как это предложили сделать ученые Джеральд Файнберг и Роберт Шапиро в своей книге «Жизнь за пределами Земли».
Сравнение размеров молекул воздуха с кристаллами соли
Итак, насыпьте перед собой на стол немного соли. Выберите из кучки самый мелкий кристаллик. А теперь вообразите себя Алисой в стране чудес. Сейчас вы начнете стремительно расти вниз, уменьшаясь в размерах. При этом кристаллик соли заметно вырастает. Вот он уже с детскую кроватку. Вот он стал размером с дом. Вот кристалл уже упирается в небо.
Но вы все еще не настолько малы, чтобы почувствовать, что такое молекула воздуха. Вы все еще не можете сопоставить размеры молекулы и крупинки соли. Постепенно вершина кристалла соли исчезает из виду. Теперь он для вас имеет высоту 100 небоскребов, поставленных один на другой. И вдруг вы замечаете пушинку и пытаетесь ее поймать. Так что, то, что лежит у вас в ладони, и есть средняя молекула воздуха. Сравнив эту величину с крупинкой соли высотой в 100 небоскребов, вы наглядно представите себе, что такое молекула.
Связи с участием d-орбиталей.
В отличие от азота атом фосфора может образовывать пять ковалентных связей. В основном состоянии фосфор имеет конфигурацию (1s)2(2s)2(2p)6(3s)2(3px)(3py)(3pz) и является трехвалентным, образуя, как и азот, соединения типа PF3. Однако в этом случае возможно участие 3s-электронов в образовании связей, поскольку d-АО (3d) имеют такое же главное квантовое число. Действительно, известны и соединения пятивалентного фосфора типа PF5, где фосфор находится в валентном состоянии +5, согласующемся с электронной конфигурацией (1s)2(2s)2(2p)6(3s)(3px)(3py)(3pz)(3d); связи с этом случае образуются в результате sp3d-гибридизации (т.е. в результате смешивания одной s-, трех р- и одной d-АО). Оптимальной структурой с точки зрения уменьшения взаимного отталкивания пар валентных электронов является треугольная бипирамида (рис. 5,а). Сера может быть не только двухвалентной, но также четырех- (SF4) и шестивалентной (SF6), находясь в состояниях (1s)2(2s)2(2p)6(3s)2(3px)(3py)(3pz)(3d) и (1s)2(2s)2(2p)6(3s)(3px)(3py)(3pz)(3d1)(3d2) соответственно. В соединениях четырехвалентной серы взаимное отталкивание электронов 3-й оболочки оптимизируется при гибридизации орбиталей всех ее электронов. Структура соединений этого типа подобна структуре PF5, но одна из вершин треугольной бипирамиды занята парой неподеленных электронов 3-й оболочки (рис. 5,б). В соединениях шестивалентной серы взаимное отталкивание электронов минимизируется при sp3d 2-гибридизации, когда все орбитали эквивалентны и направлены к вершинам правильного октаэдра (рис. 5,в).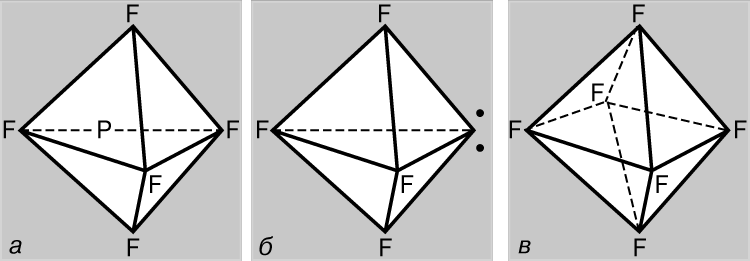
До сих пор мы рассматривали только те элементы периодической таблицы, у которых оболочки, имеющие d-орбитали, либо целиком заполнены, либо совсем свободны. Остановимся теперь на переходных элементах, у которых эти оболочки заполнены не до конца. Энергия электронов на разных орбиталях 3-й оболочки возрастает в следующем порядке: 3s p d; все орбитали расположены слишком далеко от орбиталей 2-й оболочки, чтобы могла произойти их гибридизация. В то же время 3d-орбитали и орбитали 4-й оболочки энергетически достаточно близки, так что возможно взаимодействие 3d-, 4s- и 4р-орбиталей, и переходные элементы от Sс до Cu могут образовывать ковалентные связи путем гибридизации этих орбиталей. Во всех случаях, когда имеются две 3d-орбитали, образование связей происходит через d 2sp3-гибридизацию, при этом гибридные орбитали по форме похожи на sp3d 2-орбитали. Элементы в соединениях этого типа шестивалентны, а молекулы самих соединений имеют форму октаэдра (рис. 5,в). Большинство из них содержат ионы, и можно считать, что они образовались в результате взаимодействия иона центрального атома с шестью молекулами, каждая из которых имеет пару неподеленных электронов. Ковалентные связи с центральным ионом называются донорно-акцепторными. Простой пример такого соединения – гексаммин-ион трехвалентного кобальта Co(NH3)63+. Ион Co3+ имеет электронную конфигурацию (1s)2(2s)2(2p)6(3s)2(3p)6(3d1)2(3d2)2(3d3)2, причем полностью заняты три из пяти его 3d-орбиталей, а две 3d-АО свободны. Эти орбитали могут гибридизоваться с 4s- и 4р-АО с образованием шести октаэдрических d 2sp3-орбиталей; все они свободны и могут участвовать в образовании акцепторных связей с шестью молекулами аммиака.
Другая картина наблюдается, когда центральный атом имеет только одну свободную d-орбиталь. В качестве примера можно привести двухзарядный ион никеля Ni2+, у которого оптимальная конфигурация возникает при образовании четырех связей с помощью dsp2-орбиталей. Эти орбитали лежат в одной плоскости под углом 90° друг к другу.
Спектры и строение молекул
Электрические, оптические, магнитные и другие свойства молекул связаны с волновыми функциями и энергиями различных состояний молекул. Информацию о состояниях молекул и вероятности перехода между ними дают молекулярные спектры.
Частоты колебаний в спектрах определяются массами атомов, их расположением и динамикой межатомных взаимодействий. Частоты в спектрах зависят от моментов инерции молекул, определение которых из спектроскопических данных позволяет получить точные значения межатомных расстояний в молекуле. Общее число линий и полос в колебательном спектре молекулы зависит от её симметрии.
Электронные переходы в молекулах характеризуют структуру их электронных оболочек и состояние химических связей. Спектры молекул, которые имеют большее количество связей, характеризуются длинноволновыми полосами поглощения, попадающими в видимую область. Вещества, которые построены из таких молекул, характеризуются окраской; к таким веществам относятся все органические красители.
Лучшие ответы
Никита Александрович:
Некоторые ответы меня просто убивают) «Атом это мельчайшая, химически неделимая частица вещ-ва. нет мельче» Люди просто знакомы с физикой только по школьной программе . Элементарных частиц неисчислимое множество. Кто-то даже однажды сказал в 1970-е: «В этом году Нобелевскую премию стоит жать физику, который не откроется ни одной новой элементарной частицы». Физика тогда потонула в них и не могла толком разобраться. Одна из самых знаменитых — бозон Хиггса, существование которой пока еще не доказано. Еще меньше элементарных частиц — кварки.
Кирино Косака:
wikipedia . org / элементарные частицы
:
Атом — это мельчайшая, химически неделимая частица вещ-ва. нет мельче)
Петр Иванов:
кажется, нейтрино.
Инженер-констриктор:
Ядро атома.
У элементарных частиц размера, в принципе, нет. Разве что у протонов с нейтронами.
partizanG:
Атом состоит из протонов, электронов и нейтронов. Есть еще кварки и куча разных абстрактных микрочастиц. Но их никто не видел, они из области чистой теории.
Серж 0:
элементарные частицы. еще меньше кварки. теоретически — далее субкварки, но о них науке пока мало что известно.
Krab Bark:
Сколько угодно. Называются элементарные частицы. Из трех их видов (нейтроны, протоны, электроны) состоят обычные атомы, но есть еще множество других. Да и сами нейтроны и протоны состоят из других частиц (а вот электроны, похоже, нет).
Сабижан Сумбеков:
Хе, чувак, тебе надобно книгу ‘поля, частицы, кванты’ двух французов почитать… а так их до лешего много
Мусин Рустам:
Пока атом считался неделимым, ученые спокойно изучали свойства молекул и создавали новые вещества на их основе. Однако постепенно научные познания расширились и оказалось, что есть то, что меньше атома.Среди самых известных мельчайших частиц можно упомянуть пи-мезон, мюон, нейтрино, глюон и прочие интересные вещи. Некоторые из них хорошо изучены. Люди научились получать их в лабораторных условиях. А есть и такие частицы, которые пока получить невозможно. Они содержатся в космических лучах.Особый интерес для ученых представляют исследования на ускорителях элементарных частиц. Здесь создаются высокоскоростные потоки элементарных частиц с большой энергией. На высокой скорости они сталкиваются и образуют другие так называемые субчастицы. В настоящее время их известно более четырех сотен и открытия продолжаются.Так микромир постепенно раскрывает свои тайны перед пытливым умом человека.
Надежда Маскина (Казакбаева):
меньше атома кварк а меньше кварка квант
Кот:
Это кварки, из них состоит ядро атома.
Поля Кустик:
мои мозги
kirik tiger:
по моему электрон он же крутится вокруг нейтронов и протонов (атома) или кварка
владимир азарян—-:
есть кварки и в супе шкварки
-=GOLD MAN=-:
Фотон. Квант. Спектр
Shout17:
Еще меньше — кварки. Атом состоит из протонов, электронов и нейтронов.
Color Dream:
Кроме макромира есть микромир, и всё что находится в микромире меньше атома.
Анжелика Агапкина:
про планковскую длину прочитай)
наталья пономаренко:
самое маленькое, квантовая частица!!! а самое большое это космос
Электрическая сила
Электрические заряды воздействуют друг на друга, что проявляется в виде электрической силы.
Если какое-то тело имеет избыток электронов, оно будет обладать суммарным отрицательным электрическим зарядом, и наоборот — при дефиците электронов, тело будет иметь суммарный положительный заряд.
По аналогии с магнитными силами, когда одноименно заряженные полюса отталкиваются, а разноименно — притягиваются, электрические заряды ведут себя аналогичным образом
Однако, в физике недостаточно говорить просто о полюсности электрического заряда, важно его числовое значение
сила всемирного тяготения
F = (Gm1m2)/R2
- m1, m2 — массы тел;
- R — расстояние между центрами тел;
- G = 6,67·10-11 Нм2/кг — универсальная гравитационная постоянная.
В результате проведенных лабораторных опытов, физики вывели аналогичную формулу для силы взаимодейтсвия электрических зарядов, которая получила название закон Кулона:
F = kq1q2/r2
- q1, q2 — взаимодействующие заряды, измеренные в Кл;
- r — расстояние между зарядами;
- k — коэффициент пропорциональности (СИ: k=8,99·109Нм2Кл2; СГСЭ: k=1).
Где:
- k=1/(4πε).
- ε≈8,85·10-12Кл2Н-1м-2 — электрическая постоянная.
Согласно закону Кулона, если два заряда имеют одинаковый знак, то действующая между ними сила F положительна (заряды отталкиваются друг от друга); если заряды имеют противоположные знаки, действующая сила отрицательна (заряды притягиваются друг к другу).
О том, насколько огромным по силе является заряд в 1 Кл можно судить, используя закон Кулона. Например, если предположить, что два заряда, каждый в 1Кл разнести на расстояние друг от друга в 10 метров, то они будут друг от друга отталкиваться с силой:
F = kq1q2/r2 F = (8,99·109)·1·1/(102) = -8,99·107Н
Это достаточно большая сила, примерно сопостовимая с массой в 5600 тонн.
Давайте теперь при помощи закона Кулона узнаем, с какой линейной скоростью вращается электрон в атоме водорода, считая, что он движется по круговой орбите.
Электростатическую силу, действующую на электрон, по закону Кулона можно приравнять к центростремительной силе:
F = kq1q2/r2 = mv2/r
Учитывая тот факт, что масса электрона равна 9,1·10-31кг, а радиус его орбиты = 5,29·10-11м, получаем значение 8,22·10-8Н.
Теперь можно найти линейную скорость электрона:
8,22·10-8 = (9,1·10-31)v2/(5,29·10-11) v = 2,19·106м/с
Таким образом, электрон атома водорода вращается вокруг его центра со скоростью, равной примерно 7,88 млн. км/ч.
Хаотическое движение частиц
Непрерывное хаотическое движение частиц подтверждается броуновским движением и диффузией. Хаотичность движения означает, что у молекул не существует каких-либо предпочтительных путей и их движения имеют случайные направления. Это означает, что все направления равновероятны.
Диффузия (от латинского diffusion – растекание, распространение) – явление, когда в результате теплового движения вещества происходит самопроизвольное проникновение одного вещества в другое (если эти вещества соприкасаются).
Взаимное перемешивание веществ происходит по причине непрерывного и беспорядочного движения атомов или молекул (или других частиц) вещества. С течением времени глубина проникновения молекул одного вещества в другое увеличивается. Глубина проникновения зависит от температуры: чем выше температура, тем больше скорость движения частиц вещества и тем быстрее протекает диффузия.
Диффузия наблюдается во всех состояниях вещества – в газах, жидкостях и твёрдых телах. Примером диффузии в газах служит распространение запахов в воздухе при отсутствии прямого перемешивания. Диффузия в твёрдых телах обеспечивает соединение металлов при сварке, пайке, хромировании и т.п. В газах и жидкостях диффузия происходит намного быстрее, чем в твёрдых телах.
Взаимодействие атомов при образовании молекулы
Природа химических связей в молекуле оставалась загадкой до создания квантовой механики — классическая физика не могла объяснить насыщаемость и направленность валентных связей. Основы теории химической связи были заложены в 1927 году Гайтлером и Лондоном на примере простейшей молекулы Н2. Позже теория и методы расчётов были значительно усовершенствованы.
Химические связи в молекулах подавляющего большинства органических соединений является ковалентными. Среди неорганических соединений существуют ионные и донорно-акцепторные связи, которые реализуются в результате обобществления пары электронов атома. Энергия образования молекулы из атомов во многих рядах подобных соединений приближённо аддитивна. То есть можно считать, что энергия молекулы — это сумма энергий её связей, имеющих постоянные значения в таких рядах.
Аддитивность энергии молекулы выполняется не всегда. Примером нарушения аддитивности являются плоские молекулы органических соединений с так называемыми сопряжёнными связями, то есть с кратными связями, которые чередуются с единичными. Сильная делокализация p-состояний электронов приводит к стабилизации молекулы. Выравнивание электронной плотности вследствие коллективизации p-состояний электронов по связям выражается в укорочении двойных связей и удлинении одинарных. В правильном шестиугольнике межуглеродных связей бензола все связи одинаковы и имеют длину, среднюю между длиной одинарной и двойной связи. Сопряжение связей ярко проявляется в молекулярных спектрах. Современная квантовомеханическая теория химических связей учитывает делокализации не только p-, но и s-состояний электронов, которая наблюдается в любых молекулах.
В подавляющем большинстве случаев суммарный спин валентных электронов в молекуле равен нулю. Молекулы, содержащие неспаренные электроны — свободные радикалы (например, атомарный водород Н, метил ·CH3), обычно неустойчивы, поскольку при их взаимодействии друг с другом происходит значительное снижение энергии вследствие образования ковалентных связей. Они могут устойчиво существовать при таких температурах, когда средняя кинетическая энергия молекулы превосходит или сравнима с энергией связи, но при этом ниже энергии разрушения (например ионизации) радикала.
Сравнение атома и молекулы
В чем же разница между атомом и молекулой?
Атом является элементарной частицей вещества. Он имеет свою массу и размер и отвечает за свойства этого вещества, как химического элемента. Атом состоит из ядра и электронов, которые движутся по своим орбитам вокруг ядра. Именно строением атома обуславливаются химические свойства вещества. Атомы не встречаются в свободном состоянии. Они связываются друг с другом и образуют молекулы, благодаря электрическим зарядам частиц, из которых они состоят.
Молекула – это то, из чего состоит вещество. В состав молекул могут входить два и более атомов, которые между собой связаны межатомными связями. Более точно можно сказать так, что молекула состоит из атомных ядер и внутренних электронов, которые движутся по своим орбитам, а также внешних валентных электронов. В разных молекулах находится разное количество атомов определенного вида и разного количества. Молекула имеет сложную архитектурную постройку, где у каждого атома свое место и свои вполне определенные соседи. Свойства молекулы определяется тем, сколько в ней атомов. На эти свойства влияет порядок и конфигурация соединения атомов. Атомная постройка, которая образует молекулу, может быть жесткой, но не во всех случаях. Каждый атом находится в непрерывном движении, он колеблется около своего положения равновесия. При этом свободная молекула в процессе ее теплового движения имеет различные конфигурации. Молекула электрически является нейтральной частицей. Она является наименьшей частицей вещества, которая обладает его химическими свойствами. В случае одноатомных молекул таких, как инертные газы, свойства молекулы и атома совпадают. Атомы в молекуле объединены химическими связями. Такая связь может создаваться одной или несколькими парами электронов, которыми сообща владеют два атома. Молекула может существовать самостоятельно.
Чем атом отличается от молекулы
Атомы образуют молекулу. В состав атома входят ядро и электроны, которые движутся по своим орбитам вокруг ядра.
Молекулы состоят из атомов.
Атом имеет электрический заряд, а молекула нейтральна.
Только молекула может существовать самостоятельно.
Чем отличаются атомы?
В переводе «атом» означает неделимый. Назван он так потому, что долгое время его считали наименьшей частью вещества. Но дальнейшее развитие науки показало, что это не так. Итак, давайте разберемся, из чего состоит атом и чем отличаются атомы различных элементов.
Молекулы в химии, физике и биологии
Понятие молекулы является основным для химии, и большей частью сведений о строении и функциональность молекул наука обязана химическим исследованиям. Химия определяет строение молекул на основе химических реакций и, наоборот, на основе строения молекулы определяет, каким будет ход реакций.
Строением и свойствами молекулы определяются физические явления, которые изучаются молекулярной физикой. В физике понятие молекулы используется для объяснения свойств газов, жидкостей и твёрдых тел. Подвижностью молекул определяется способность вещества к диффузии, её вязкость, теплопроводность и т. д. Первое прямое экспериментальное доказательство существования молекул было получено французским физиком Жаном Перреном в 1906 году при изучении броуновского движения.
Поскольку все живые организмы существуют на основе тонко сбалансированного химического и нехимического взаимодействия между молекулами, изучение строения и свойств молекул имеет фундаментальное значение для биологии и естествознания в целом.
Развитие биологии, химии и молекулярной физики привели к возникновению молекулярной биологии, которая исследует основные явления жизни, исходя из строения и свойств биологически функциональных молекул.
Атом и молекула: отличные свойства
Неделимость. Атом является мельчайшим элементом, из которого нельзя выделить еще меньшую частицу. (Получение иона влияет только на заряд, но не на вес). Молекулу, в свою очередь, можно разделить на более мелкие молекулы или можно разложить на атомы. Процесса распада легко добиться с использованием химических катализаторов. Иногда достаточно просто нагреть вещество.
Свободное существование. Молекула может свободно существовать в природе. Атом существует в вольной форме лишь в двух случаях:
- Как одноатомная ртуть или инертный газ.
- В условиях космоса — как отдельные атомы могут находиться любые химические элементы.
В остальных случаях атом всегда входит в состав молекулы.
Образование заряда. Взаимодействие между ядром и электроном в атоме можно легко преодолеть даже мельчайшим электрическим полем. Таким образом, — из атома легко получить положительный или отрицательный ион. Наличие химических связей между атомами внутри молекулы требует приложения гораздо большего электрического поля или взаимодействия с другим химически активным веществом.
https://youtube.com/watch?v=tbHvc7NsyYs
Строение вещества
Агрегатное состояние вещества (твердое, жидкое или газообразное) и особенности его строения определяются взаимодействием атомов и молекул, из которых состоят все вещества. Теория о молекулярном устройстве всех физических объектов подтвердилась многочисленными экспериментами. Современные приборы (электронные микроскопы) позволяют даже увидеть и сфотографировать отдельные молекулы и их расположение (структуру).
- Все физические тела состоят из молекул — мелких частиц, каждая из которых имеет все основные химические и физические свойства, присущие всему веществу;
- Молекулы состоят из атомов;
- Атомы состоят из отрицательно заряженных электронов и ядра, включающего в себя положительно заряженные протоны и нейтроны, не имеющие зарядов;
- Молекулы вещества находятся в непрерывном, хаотическом движении;
- Взаимодействие частиц имеет электромагнитную природу: при сближении происходит отталкивание, а при удалении друг от друга возобновляется притяжение. В равновесном состоянии силы притяжения и отталкивания уравновешивают друг другу.
Рис. 1. Молекулы одного и того же вещества в разных агрегатных состояниях.
Древнегреческий философ Демокрит, живший более 2000 лет назад считается первым мыслителем, создавшим учение (теорию) о том, что весь наш мир построен из мельчайших. невидимых частичек — атомов. Слово атом имеет греческое происхождение (“атомос” — неделимый, неразрезаемый). Эта замечательная идея позднее была надолго забыта. Более тысячи лет безраздельно господствовало учение другого философа — Аристотеля, который отрицал существование атомов. Аристотель утверждал, что все вещества могут взаимно превращаться друг в друга, и любое тело можно делить до бесконечности. И Демокрит, и Аристотель строили свои предположения на основе общих, теоретических рассуждений. Только в начале ХIХ века на основе многочисленных опытов и экспериментов ученые (Гассенди, Ломоносов, Бойль, Мариотт, Дальтон и др.) окончательно пришли к общему мнению о реальности существования атомов и молекул.
Рис. 2. Портрет М. В. Ломоносова:.
Электрические и оптические свойства молекул
Поведение вещества в электрическом поле определяется основными электрическими характеристиками молекул — постоянным дипольным моментом и поляризуемостью.
Дипольный момент означает несовпадение «центров тяжести» положительных и отрицательных зарядов в молекуле (электрическую асимметрию молекулы). То есть молекулы, имеющие центр симметрии, например H2, лишены постоянного дипольного момента, и наоборот.
Поляризуемость — это способность электронной оболочки любой молекулы перемещаться под действием электрического поля, в результате чего в молекуле образуется наведённый дипольный момент. Значение дипольного момента и поляризуемости находят экспериментально с помощью измерения диэлектрической проницаемости.
Оптические свойства вещества характеризуют его поведение в переменном электрическом поле световой волны и определяются поляризуемостью молекулы этого вещества. С поляризуемостью непосредственно связаны преломление и рассеяние света, оптическая активность и другие явления, изучаемые молекулярной оптикой.
Индивидуальные вещества и смеси
Дистиллированная вода — это молекулы Н2О без примесей. Такая жидкость не используется для питья и приготовления пищи. Вместе с водой в организм человека должны поступать ионы из состава растворимых веществ (электролиты). Природная, минеральная, водопроводная вода содержат, кроме молекул воды, ионы металлов, солей. Многие из них важны для здоровья.
Ионы макро- и микроэлементов в продуктах ошибочно называют минералами. Последние — это твердые природные тела, например, кварц, кремень, топаз. Лучше пользоваться названиями «неорганические питательные вещества», «минеральные добавки».
Интересный факт: при недостатке в продуктах питания химического элемента в виде иона или молекул человек не чувствует насыщения. Возникает подсознательное стремление восполнить существующий дефицит за счет других компонентов пищи, что нередко приводит к нарушению обмена, ожирению.
Вокруг нас преобладают смеси, которые содержат два и более простых либо сложных вещества. Атмосферный воздух — смесь газов. Жители промышленных районов, городов, дополнительно к газообразным кислороду, азоту и углекислому газу, вдыхают продукты горения всех видов топлива, микрочастицы свинца, ртути и других тяжелых металлов. Токсическое действие такого «коктейля» намного опаснее, чем вред отдельных компонентов.
Вещества вокруг и внутри живых организмов многообразны, состоят из атомов, молекул, ионов. Видов частиц немного, однако они создают великое разнообразие простых и сложных соединений. Представлять, хотя бы в общем, из чего состоят вода, воздух, лекарства, продукты питания необходимо. Такие знания дают преимущества в жизни, помогают лучше ориентироваться в окружающем мире, обеспечить свою безопасность, выживание.