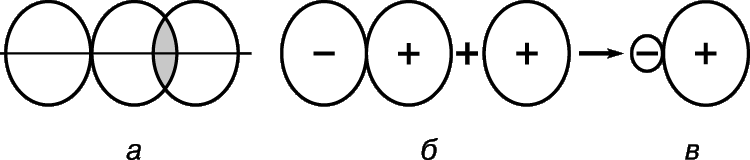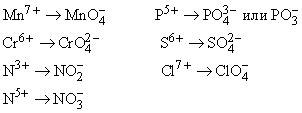Как наш организм использует кислород
Содержание:
Биологическая роль кислорода
Аварийный запас кислорода в бомбоубежище
Большинство живых существ (аэробы) дышат кислородом.
Широко используется кислород в медицине. При сердечно-сосудистых заболеваниях, для улучшения обменных процессов, в желудок вводят кислородную пену («кислородный коктейль»). Подкожное введение кислорода используют при трофических язвах, слоновости, гангрене и других серьёзных заболеваниях. Для обеззараживания и дезодорации воздуха и очистки питьевой воды применяют искусственное обогащение озоном. Радиоактивный изотоп кислорода 15O применяется для исследований скорости кровотока, .
Нахождение в природе
Накопление O2 в атмосфере Земли. Зелёный график — нижняя оценка уровня кислорода, красный — верхняя оценка. 1. (3,85—2,45 млрд лет назад) — O2 не производился2. (2,45—1,85 млрд лет назад) — O2 производился, но поглощался океаном и породами морского дна3. (1,85—0,85 млрд лет назад) — O2 выходит из океана, но расходуется при окислении горных пород на суше и при образовании озонового слоя4. (0,85—0,54 млрд лет назад) — все горные породы на суше окислены, начинается накопление O2 в атмосфере5. (0,54 млрд лет назад — по настоящее время) — современный период, содержание O2 в атмосфере стабилизировалось
Кислород — самый распространённый в земной коре элемент, на его долю (в составе различных соединений, главным образом силикатов) приходится около 47 % массы твёрдой земной коры. Морские и пресные воды содержат огромное количество связанного кислорода — 85,82 % (по массе). Более 1500 соединений земной коры в своём составе содержат кислород.
В атмосфере содержание свободного кислорода составляет 20,95 % по объёму и 23,10 % по массе (около 1015 тонн). Однако до появления первых фотосинтезирующих микробов в архее 3,5 млрд лет назад в атмосфере его практически не было. Свободный кислород в больших количествах начал появляться в палеопротерозое (3—2,3 млрд лет назад) в результате глобального изменения состава атмосферы (кислородной катастрофы). Первый миллиард лет практически весь кислород поглощался растворённым в океанах железом и формировал залежи джеспилита. 3—2,7 млрд лет назад кислород начал выделяться в атмосферу и 1,7 млрд лет назад достиг 10 % от нынешнего уровня.
Наличие большого количества растворённого и свободного кислорода в океанах и атмосфере привело к вымиранию большинства анаэробных организмов. Тем не менее, клеточное дыхание с помощью кислорода позволило аэробным организмам производить гораздо больше АТФ, чем анаэробным, сделав их доминирующими.
С начала кембрия 540 млн лет назад содержание кислорода колебалось от 15 % до 30 % по объёму. К концу каменноугольного периода (около 300 миллионов лет назад) его уровень достиг максимума в 35 % по объёму, который, возможно, способствовал большому размеру насекомых и земноводных в это время.
Основная часть кислорода на Земле выделяется фитопланктоном Мирового океана. Около 60 % кислорода от используемого живыми существами расходуется на процессы гниения и разложения, 80 % кислорода, производимого лесами, уходит на гниение и разложение растительности лесов.
Деятельность человека очень мало влияет на количество свободного кислорода в атмосфере[нет в источнике]. При нынешних темпах фотосинтеза понадобится около 2000 лет, чтобы восстановить весь кислород в атмосфере.
Кислород входит в состав многих органических веществ и присутствует во всех живых клетках. По числу атомов в живых клетках он составляет около 25 %, по массовой доле — около 65 %.
В 2016 году датские учёные доказали, что свободный кислород входил в состав атмосферы уже 3,8 млрд лет назад.
Применение
Широкое промышленное применение кислорода началось в середине XX века, после изобретения турбодетандеров — устройств для сжижения и разделения жидкого воздуха.
В металлургии
Конвертерный способ производства стали или переработки штейнов связан с применением кислорода. Во многих металлургических агрегатах для более эффективного сжигания топлива вместо воздуха в горелках используют кислородно-воздушную смесь.
Компонент ракетного топлива
В качестве окислителя для ракетного топлива применяется жидкий кислород, пероксид водорода, азотная кислота и другие богатые кислородом соединения.
Смесь жидкого кислорода и жидкого озона — один из самых мощных окислителей ракетного топлива (удельный импульс смеси водород — озон превышает удельный импульс для пары водород-фтор и водород-фторид кислорода).
В медицине
Основная статья: Кислородная терапия
Медицинский кислород хранится в металлических газовых баллонах высокого давления голубого цвета различной ёмкости от 1,2 до 10,0 литров под давлением до 15 МПа (150 атм) и используется для обогащения дыхательных газовых смесей в наркозной аппаратуре, при нарушении дыхания, для купирования приступа бронхиальной астмы, устранения гипоксии любого генеза, при декомпрессионной болезни, для лечения патологии желудочно-кишечного тракта в виде кислородных коктейлей. Крупные медицинские учреждения могут использовать не сжатый кислород в баллонах, а сжиженный в сосуде Дьюара большой ёмкости. Для индивидуального применения медицинским кислородом из баллонов заполняют специальные прорезиненные ёмкости — кислородные подушки. Для подачи кислорода или кислородо-воздушной смеси одновременно одному или двум пострадавшим в полевых условиях или в условиях стационара применяются кислородные ингаляторы различных моделей и модификаций. Достоинством кислородного ингалятора является наличие конденсатора-увлажнителя газовой смеси, использующего влагу выдыхаемого воздуха. Для расчёта оставшегося в баллоне количества кислорода в литрах обычно величину давления в баллоне в атмосферах (по манометру редуктора) умножают на величину ёмкости баллона в литрах. Например, в баллоне вместимостью 2 литра манометр показывает давление кислорода 100 атм. Объём кислорода в этом случае равен 100 × 2 = 200 литров.
В пищевой промышленности
В пищевой промышленности кислород зарегистрирован в качестве пищевой добавки E948, как пропеллент и упаковочный газ.
В химической промышленности
В химической промышленности кислород используют как реактив-окислитель в многочисленных синтезах, например, — окисления углеводородов в кислородсодержащие соединения (спирты, альдегиды, кислоты), диоксид серы в триоксид серы, аммиака в оксиды азота в производстве азотной кислоты. Вследствие высоких температур, развивающихся при окислении, последние часто проводят в режиме горения.
В сельском хозяйстве
В тепличном хозяйстве, для изготовления кислородных коктейлей, для прибавки в весе у животных, для обогащения кислородом водной среды в рыбоводстве.
Значение кислорода в природе
Очень важно, сколько кислорода содержится в природе. Ведь известно, что на некоторых спутниках больших планет (Юпитер, Сатурн) были обнаружены следовые количества этого газа, однако очевидной жизни там нет
Наша Земля имеет достаточное его количество, которое в сочетании с водой дает возможность существовать всем живым организмам.
Помимо того, что он является активным участником дыхания, кислород еще проводит бесчисленное количество реакций окисления, в результате которых высвобождается энергия для жизни.
Основными поставщиками этого уникального газа в природе являются зеленые растения и некоторые виды бактерий. Благодаря им поддерживается постоянный баланс кислорода и углекислого газа. Кроме того, озон выстраивает защитный экран над всей Землей, который не позволяет проникать большому количеству уничтожающего ультрафиолетового излучения.
Лишь некоторые виды анаэробных организмов (бактерии, грибки) способны жить вне атмосферы кислорода. Однако их гораздо меньше, чем тех, кто очень в нем нуждается.
Физические свойства
В мировом океане концентрация растворённого O2 больше в холодных водах, меньше — в тёплых
Жидкий кислород
При нормальных условиях кислород — это газ без цвета, вкуса и запаха.
1 л его при нормальных условиях имеет массу 1,429 г., то есть немного тяжелее воздуха. Слабо растворяется в воде (4,9 мл/100 г при 0 °C, 2,09 мл/100 г при +50 °C) и спирте (2,78 мл/100 г при +25 °C). Хорошо растворяется в расплавленном серебре (22 объёма O2 в 1 объёме Ag при +961 °C). Хорошо растворяется в перфторированных углеводородах (20—40 об %).
Межатомное расстояние — 0,12074 нм. Является парамагнетиком. В жидком виде притягивается магнитом.
При нагревании газообразного кислорода происходит его обратимая диссоциация на атомы, концентрация диссоциированных атомов в смеси при +2000 °C — 0,03 %, при +2600 °C — 1 %, +4000 °C — 59 %, +6000 °C — 99,5 %.
Жидкий кислород кипит под давлением 101,325 кПа при температуре −182,98 °C и представляет собой бледно-голубую жидкость.
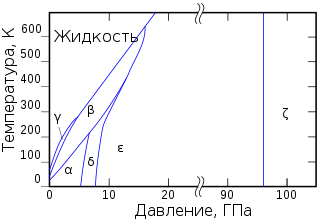
Фазовая диаграмма O2
Твёрдый кислород (температура плавления −218,35 °C) — синие кристаллы.
Известны 6 кристаллических фаз, из которых три существуют при давлении в 1 атм.:
- α-О2 — существует при температуре ниже 23,65 K; ярко-синие кристаллы относятся к моноклинной сингонии, параметры ячейки a=5,403 Å, b=3,429 Å, c=5,086 Å; β=132,53°.
- β-O2 — существует в интервале температур от 23,65 до 43,65 K; бледно-синие кристаллы (при повышении давления цвет переходит в розовый) имеют ромбоэдрическую решётку, параметры ячейки a=4,21 Å, α=46,25°.
- γ-O2 — существует при температурах от 43,65 до 54,21 K; бледно-синие кристаллы имеют кубическую симметрию, период решётки a=6,83 Å.
Ещё три фазы существуют при высоких давлениях:
- δ-O2 — интервал температур 20—240 K и давление 6—8 ГПа, оранжевые кристаллы;
- ε-фаза, содержит молекулы O4 или O8, существует при давлении от 10 и до 96 ГПа, цвет кристаллов от тёмно-красного до чёрного, моноклинная сингония;
- ζ-On — давление более 96 ГПа, металлическое состояние с характерным металлическим блеском, при низких температурах переходит в сверхпроводящее состояние.
Кислород: химические свойства
Ключевые слова конспекта: химические свойства простых веществ-неметаллов, характеристика элемента? простое вещество — кислород O2, получение кислорода.
Характеристика элемента кислорода
Кислород О – элемент № 8, 2-й период, VIA группа. Электронная конфигурация атома кислорода 1s22s22p4.
Валентные возможности кислорода – II и III (с учётом возможности образования связи по донорно–акцепторному механизму, например в ионе гидроксония Н3О+). Возможные степени окисления кислорода:
+2 – в соединении со фтором OF2;+1 – в соединении со фтором О2F2; – в простых веществах O2 (кислород), O3 (озон);–1 – в пероксидах (Н2O2, Na2O2);–2 – во всех остальных соединениях кислорода (кроме супероксидов).
Кислород – самый распространённый элемент в земной коре. Кислороду присуща аллотропия, элемент кислород образует два простых вещества – киcлород O2 и озон O3.
Кислород – простое вещество O2
Кислород является молекулярным веществом, молекула двухатомна. В молекуле кислорода связь ковалентная неполярная.
При обычных условиях кислoрoд – газ без цвета и запаха, тяжелее воздуха, плохо растворим в воде (несколько лучше, чем азот). В жидком состоянии кислород светло-голубого, в твёрдом – синего цвета.
Кислород является хорошим окислителем. Реагирует практически со всеми простыми веществами (кроме инертных газов, галогенов, благородных металлов). Так, например, киcлород окисляет металлы:
O2 + 2Zn = 2ZnO3O2 + 4Al = 2Al2O3O2 + 2Cu = 2CuO2O2 + 3Fe = Fe3O4
Кислорoд является также окислителем многих неметаллов. В некоторых случаях, для того чтобы началась реакция, требуется нагревание:
O2 + C = CO2O2 + S = SO25O2 + 4Р = 2Р2O5O2 + 2Н2 = 2Н2O
Кислoрод реагирует с азотом в электрической дуге (реакция обратима, идёт с небольшим выходом NO):
В кислороде сгорают многие горючие вещества, практически все органические вещества:
2O2 + СН4 = СO2 + 2Н202Н2S + 3O2 = 2SO2 + 2Н20
Кислoрoд окисляет многие сложные вещества – как неорганические, так и органические:
O2 + 4Fe(OH)2 + 2Н20 = 4Fe(OH)3O2 + 2СН3СНО = СН3СООН.
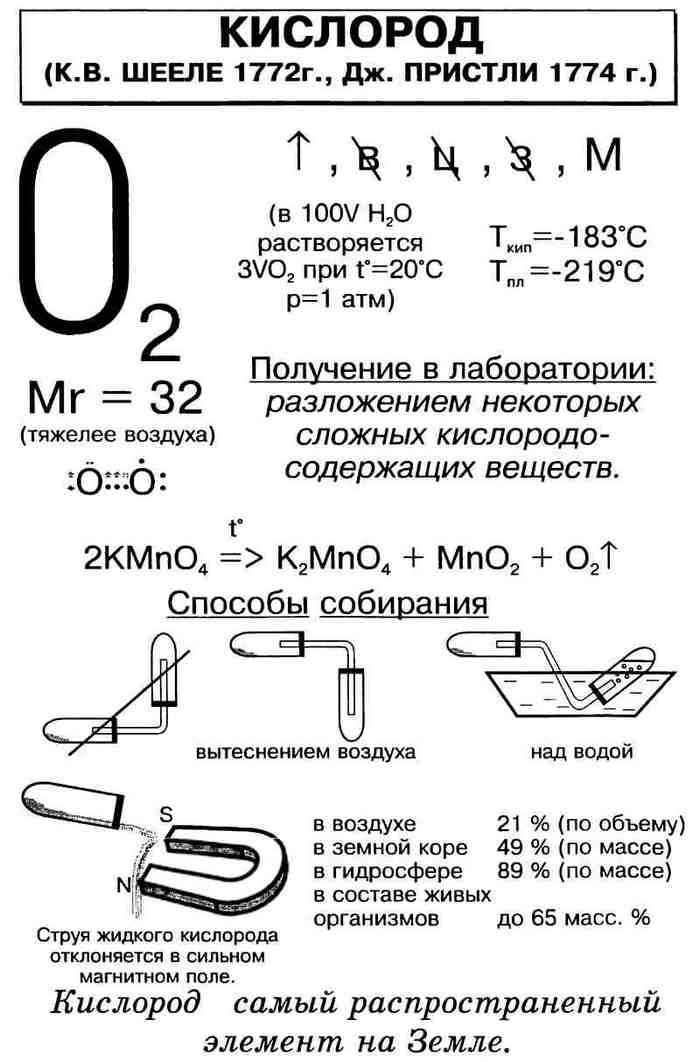
В промышленности кислород получают перегонкой воздуха. Способ основан на том, что у азота и кислорода разные температуры кипения. В лаборатории киcлорoд получают:
а) электролизом воды:
б) разложением пероксида водорода под действием катализатора:
в) разложением перманганата калия при нагревании: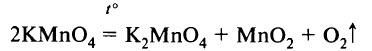
г) разложением хлората калия (бертолетовой соли) при нагревании:
д) разложением нитратов щелочных металлов при нагревании:

1.2. Масса и размеры молекул
Основной характеристикой атомов и молекул служит относительная атомная масса элемента
(сокращенно – атомная масса) и относительная молекулярная масса вещества
(сокращенно – молекулярная масса). За единицу атомной массы
выбрана часть массы атома углерода.
Атомной массой Аr химического элемента называется отношение массы атома этого элемента к массы атома углерода.
Молекулярной массой Mr вещества называется отношение массы молекулы этого вещества к массы атома углерода. Ясно, что атомная и молекулярная масса – величины безразмерные.
Как только что было определено, единица массы, равная массы атома углерода, называется атомной единицей массы. Обозначим эту единицу, выраженную в килограммах, через mед. Тогда масса атома, выраженная в килограммах, будет равна Аrmед, а масса молекулы – Mrmед.
Количество вещества, в котором содержится число молекул, равное числу атомов в 0,012 кг углерода С, называется молем.
Число молекул, содержащихся в одном моле, называется числом Авогадро. Экспериментально определено, что число Авогадро
| . |
Лоренцо Романо Амедео Карло АВОГАДРО (1776-1856)
Итальянский физик и химик. Родился в Турине в дворянской семье, получил ученую степень доктора церковного права. В 1800 г. начал самостоятельно заниматься математикой и физикой, а спустя шесть лет получил должность профессора в колледже города Верчелли. Затем стал профессором кафедры математической физики Туринского университета. Авогадро был чрезвычайно скромным человеком, работал в одиночестве, и большую часть его жизни достижения Авогадро были неизвестны в научном мире.
Таким образом, в моле любого вещества содержится число Авогадро молекул.
Массу моля, выраженную в килограммах, называют молярной массой и обозначают греческой буквой μ.
Масса моля равна произведению NA на массу одной молекулы:
| . |
В случае углерода , а масса атома
равна 12mед. Подставляя эти значения в написанное выше соотношение, получим:
| . |
| . |
| . |
| . |
| . |
| . |
| . |
Следовательно, масса моля, выраженная в граммах, численно равна его молекулярной массе.
Следует отметить, что Мr – величина безразмерная,
а μ имеет размерность в или в .
Если вещество состоит из молекул, образованных из атомов различных химических элементов, то молекулярная масса данного вещества равна сумме атомных масс элементов, входящих в состав данного вещества. Так молекулярная масса воды Н2О, состоящая из двух атомов водорода и одного атома кислорода, будет равна
| . |
Значение числа Авогадро дает представление о масштабах микромира, позволяет подсчитать размеры молекул и их абсолютные массы.
Возьмем 1 см3 Н2О. Его масса 1 г. Один моль воды содержит 18 г.
Таким образом, 1 см3 воды содержит
моля. Следовательно, 1 см3 содержит молекул воды.
Таким образом, в жидкой воде на долю одной молекулы приходится объем
| . |
Считая, что в жидкости молекулы расположены плотно друг к другу, получаем, что линейные размеры молекул воды представляют собой величину порядка
| . |
Линейные размеры других атомов и молекул представляют собою величины порядка 10-8 см, или, что то же самое, 10-10 м. Массу m одной молекулы любого вещества можно найти из соотношения
| . |
2
| . |
Это очень маленькая величина, однако, масса электрона в тысячи раз меньше.
Чтобы нагляднее представить себе размеры атомов молекул и их количество в определенном объеме вещества, вот два интересных примера:
1) наименьшие размеры частиц, доступные рассмотрению в оптический микроскоп, содержат примерно 10 миллиардов атомов;
2) если все атомы, находящиеся в 1 см3 меди, расположить в одну линию плотно друг к другу, то длина такой цепочки будет примерно 14 миллиардов километров. Это примерно в 90 раз больше, чем расстояние от Земли до Солнца.
Получение
Перегонка жидкого воздуха
В настоящее время в промышленности кислород получают из воздуха.
Основным промышленным способом получения кислорода является криогенная ректификация.
Также хорошо известны и успешно применяются в промышленности кислородные установки, работающие на основе мембранной технологии.
В лабораториях пользуются кислородом промышленного производства, поставляемым в стальных баллонах под давлением около 15 МПа.
Разложение кислородсодержащих веществ
Небольшие количества кислорода можно получать нагреванием перманганата калия KMnO4:
-
- 2KMnO4→K2MnO4+MnO2+O2↑{\displaystyle {\mathsf {2KMnO_{4}\rightarrow K_{2}MnO_{4}+MnO_{2}+O_{2}\uparrow }}}
Используют также реакцию каталитического разложения пероксида водорода H2O2 в присутствии оксида марганца(IV):
-
- 2H2O2 →MnO2 2H2O+O2↑{\displaystyle {\mathsf {2H_{2}O_{2}\ {\xrightarrow {MnO_{2}}}\ 2H_{2}O+O_{2}\uparrow }}}
Кислород можно получить каталитическим разложением хлората калия (бертолетовой соли) KClO3:
-
- 2KClO3→2KCl+3O2↑{\displaystyle {\mathsf {2KClO_{3}\rightarrow 2KCl+3O_{2}\uparrow }}}
Разложение оксида ртути(II) (при t = 100 °C) было первым методом синтеза кислорода:
-
- 2HgO→100oC 2Hg+O2↑{\displaystyle {\mathsf {2HgO{\xrightarrow {100^{o}C}}\ 2Hg+O_{2}\uparrow }}}
Электролиз водных растворов
К лабораторным способам получения кислорода относится метод электролиза разбавленных водных растворов щелочей, кислот и некоторых солей (сульфатов, нитратов щелочных металлов):
-
- 2H2O→e− 2H2+O2↑{\displaystyle {\mathsf {2H_{2}O{\xrightarrow {e-}}\ 2H_{2}+O_{2}\uparrow }}}
Реакция перекисных соединений с углекислым газом
На подводных лодках и орбитальных станциях обычно получается реакцией пероксида натрия и углекислого газа, выдыхаемого человеком:
-
- 2Na2O2+2CO2→2Na2CO3+O2↑{\displaystyle {\mathsf {2Na_{2}O_{2}+2CO_{2}\rightarrow 2Na_{2}CO_{3}+O_{2}\uparrow }}}
Для соблюдения баланса объемов поглощенного углекислого газа и выделившегося кислорода, к нему добавляют надпероксид калия. В космических кораблях для уменьшения веса иногда используется пероксид лития.
Химические свойства кислорода
Кислород поддерживает горение. Горение — быстрый процесс окисления вещества, сопровождающийся выделением большого количества теплоты и света. Чтобы доказать, что в склянке находится кислород, а не какой-то другой газ, надо в склянку опустить тлеющую лучинку. В кислороде тлеющая лучинка ярко вспыхивает. Горение различных веществ на воздухе – это окислительно-восстановительный процесс, в котором окислителем является кислород. Окислители – это вещества, «отбирающие» электроны у веществ-восстановителей. Хорошие окислительные свойства кислорода можно легко объяснить строением его внешней электронной оболочки.
Валентная оболочка кислорода расположена на 2-м уровне – относительно близко к ядру. Поэтому ядро сильно притягивает к себе электроны. На валентной оболочке кислорода 2s2 2p4 находится 6 электронов. Следовательно, до октета недостает двух электронов, которые кислород стремится принять с электронных оболочек других элементов, вступая с ними в реакции в качестве окислителя.
Кислород имеет вторую (после фтора) электроотрицательность в шкале Полинга. Поэтому в подавляющем большинстве своих соединений с другими элементами кислород имеет отрицательную степень окисления. Более сильным окислителем, чем кислород, является только его сосед по периоду – фтор. Поэтому соединения кислорода с фтором – единственные, где кислород имеет положительную степень окисления.
Итак, кислород – второй по силе окислитель среди всех элементов Периодической системы. С этим связано большинство его важнейших химических свойств.
С кислородом реагируют все элементы, кроме Au, Pt, He, Ne и Ar, во всех реакциях (кроме взаимодействия со фтором) кислород — окислитель.
Кислород легко реагирует с щелочными и щелочноземельными металлами:
4Li + O2 → 2Li2O,
2K + O2 → K2O2,
2Ca + O2 → 2CaO,
2Na + O2 → Na2O2,
2K + 2O2 → K2O4
Мелкий порошок железа ( так называемого пирофорного железа) самовоспламеняется на воздухе, образуя Fe2O3, а стальная проволока горит в кислороде, если ее заранее раскалить:
3 Fe + 2O2 → Fe3O4
2Mg + O2 → 2MgO
2Cu + O2 → 2CuO
С неметаллами (серой, графитом, водородом, фосфором и др.) кислород реагирует при нагревании:
S + O2 → SO2,
C + O2 → CO2,
2H2 + O2 → H2O,
4P + 5O2 → 2P2O5,
Si + O2 → SiO2, и т.д
Почти все реакции с участием кислорода O2 экзотермичны, за редким исключением, например:
N2 + O2 → 2NO – Q
Эта реакция протекает при температуре выше 1200 oC или в электрическом разряде.
Кислород способен окислить сложные вещества, например:
2H2S + 3O2 → 2SO2 + 2H2O (избыток кислорода),
2H2S + O2 → 2S + 2H2O (недостаток кислорода),
4NH3 + 3O2 → 2N2 + 6H2O (без катализатора),
4NH3 + 5O2 → 4NO + 6H2O (в присутствии катализатора Pt ),
CH4 (метан) + 2O2 → CO2 + 2H2O,
4FeS2 (пирит) + 11O2 → 2Fe2O3 + 8SO2.
Известны соединения, содержащие катион диоксигенила O2+, например, O2+ [PtF6]— (успешный синтез этого соединения побудил Н. Бартлетта попытаться получить соединения инертных газов).
Озон
Озон химически более активен, чем кислород O2. Так, озон окисляет иодид — ионы I— в растворе Kl:
O3 + 2Kl + H2O = I2 + O2 + 2KOH
Озон сильно ядовит, его ядовитые свойства сильнее, чем, например, у сероводорода. Однако в природе озон, содержащийся в высоких слоях атмосферы, выполняет роль защитника всего живого на Земле от губительного ультрафиолетового излучения солнца. Тонкий озоновый слой поглощает это излучение, и оно не достигает поверхности Земли. Наблюдаются значительные колебания в толщине и протяженности этого слоя с течением времени (так называемые озоновые дыры) причины таких колебаний пока не выяснены.
Применение кислорода O2: для интенсификации процессов получения чугуна и стали, при выплавке цветных металлов, как окислитель в различных химических производствах, для жизнеобеспечения на подводных кораблях, как окислитель ракетного топлива (жидкий кислород), в медицине, при сварке и резке металлов.
Применение озона О3: для обеззараживания питьевой воды, сточных вод, воздуха, для отбеливания тканей.