Разложение воды на кислород и водород
Содержание:
- Банк идей cегодня идей в Базе — 751
- Об этой статье
- Разложение воды электричеством
- Получение водорода в промышленности
- Вода
- Водородное отопление: миф или реальность?
- Реакция — разложение — вода
- Справка
- Инструкция: как сделать водородный генератор своими руками
- Как изготовить генератор
- Прямое термическое разложение
- Каким образом можно воду расщепить на водород и кислород?
Банк идей cегодня идей в Базе — 751
Расщепить воду на водород и кислород
Водород как источник энергии привлекает своей экологической безопасностью. Ведь при его сжигании образуются только водяной пар. На Земле, запасы водорода в связанном состоянии в виде воды неисчерпаемы. Добыть водород из воды можно при помощи хорошо известного химического эффекта, называемого электролиз. Электрический ток разлагает воду на водород и кислород. Однако чтобы получать водород таким способом в промышленных масштабах, необходимо затратить огромное количество электроэнергии. А как можно в промышленных масштабах расщеплять воду на водород и кислород без использования электрического тока?
. Вспомним о хорошо известном биологическом эффекте биосинтеза, когда растения, без ничего , используя бесплатные ресурсы (солнечный свет, воду и углекислый газ) выделяют в окружающую среду кислород. Причём, этот кислород получается в результате расщепления воды. Может, можно подыскать подходящий биологический эффект, позволяющий расщеплять воду на водород и кислород, используя в качестве источника энергии солнечный свет?
Оказывается, что для расщепления молекул воды на водород и кислород можно использовать фотоэлектрохимический эффект. Фотоэлектрохимическая ячейка включает в себя погруженный в воду электрод, созданный на основе наночастиц природного материала гематита (разновидность оксида железа), покрытых сетью из зелёного белкового пигмента фикоцианина, содержащегося в сине-зелёных водораслях (рис.1).
Рис.1. Фрагмент фотоэлектрохимического электрода под электронным микроскопом. Красный фон — наночастицы гематита, зелёные нити — фикоцианин.
При облучении погруженного в воду поверхности этого электрода солнечным светом, электрод вырабатывает электрический ток, а электрический ток разлагает молекулы воды на водород и кислород. Полученный белковый комплекс на поверхности пластины оказался довольно стойким и не разрушался при контакте с оксидом железа в щелочной среде, на ярком свете.
Эта разработка представляет несомненный интерес в качестве возможного способа производства водородного топлива. Осталось выяснить, как наладить массовое производство этих электродов и как они будут работать в реальных условиях эксплуатации.
Об этой статье
Соавтор(ы):
Магистр экологии и менеджмента, Калифорнийский университет в Санта-Барбаре
Соавтор(ы): . Бесс Руфф — аспирантка Университета штата Флорида, работает над получением степени PhD по географии. Получила степень магистра экологии и менеджмента в Калифорнийском университете в Санта-Барбаре в 2016 году. Проводила исследования для проектов по морскому пространственному планированию в Карибском море и обеспечивала научную поддержке в качестве дипломированного участника Группы устойчивого рыболовства. Количество просмотров этой статьи: 57 376.
Категории: Химия
English:Make Oxygen and Hydrogen from Water Using Electrolysis
Español:crear oxígeno e hidrógeno a partir de agua usando electrólisis
Deutsch:Durch Elektrolyse aus Wasser Sauerstoff und Wasserstoff erhalten
Italiano:Produrre Idrogeno e Ossigeno dall’Acqua con l’Elettrolisi
Português:Criar Oxigênio e Hidrogênio a Partir da Água por Meio da Eletrólise
中文:用电解法制备氧气和氢气
Français:fabriquer de l’oxygène et de l’hydrogène à partir de molécules d’eau par électrolyse
Nederlands:Waterstof en zuurstof maken door elektrolyse
Разложение воды электричеством
Прибор для разложения воды состоит из трёх колб, две из которых – закрытые, а одна – открытая. Все три колбы заполнены водой и сообщаются между собой в нижней части.
В закрытых колбах размещены электроды. Один из них соединён с отрицательной клеммой внешнего источника электрического тока и называется катодом, а другой соединён с положительной клеммой и называется анодом.
Внешний электрический источник нагнетает электроны на катод и создаёт на нём избыточное электрическое давление. С анода источник электроны отбирает, и там – пониженное электронное давление.
Постепенно повышенное давление электронов катода распространяется на всю катодную колбу, а пониженное распространяется на всю анодную колбу.
И только в направлении от катода в сторону анода электронное давление будет плавно уменьшаться от катодного до анодного. В этом направлении в воде образуется, своего рода, канал с таким плавно изменяющимся электронным давлением.
Сразу скажем, что в процессе разложения воды в катодной колбе собирается водород, а в анодной – кислород.
Прежде чем рассматривать физику разложения, ещё раз представим себе молекулу воды. Она состоит из атома кислорода и примкнувшей к нему молекулы водорода: O(Hm. У атома кислорода контурного жёлоба нет, и поэтому он сам и молекула воды, которую он образует, электрический ток не проводят. Контурный жёлоб есть только у молекулы водорода, но эта молекула располагается с одной стороны атома кислорода и охватывается его стволом.
Разложение молекул воды начинается на катоде.
Под напором избыточного давления электроны переходят с катода на те молекулы воды, которые примыкают к нему своей водородной стороной. При достижении порогового значения избыточного давления электроны, как клин, отделяют в каждой такой молекуле воды молекулу водорода от атома кислорода.
Отрыв происходит так резко, что атом кислорода разворачивается и своим теперь уже открытым жёлобом оказывается направленным в противоположную сторону от катода.
На его открытом жёлобе будет уже повышенное давление электронов.
Среди примыкавших к оторванным атомам кислорода молекул воды окажутся и те, которые будут повёрнуты к ним своими водородными сторонами.
С ними произойдёт то же самое, что и с теми, которые примыкали к катоду, тоесть при пороговом избыточном давлении электроны, как клин, отделят в них молекулы водорода от атомов кислорода.
При этом часть электронов с предыдущего атома кислорода переместится на вновь разорванную молекулу воды.
В этот момент каждая оторванная молекула водорода оказывается между двух атомов кислорода и прилипает к тому из них, в сторону которого она получила толчок во время отрыва.
Таким образом молекула водорода перескакивает с одного атома кислорода на другой в сторону катода.
Если мы начнём рассматривать процесс дальше, то заметим, что и все другие оторванные молекулы водорода будут перескакивать с атома на атом кислорода в сторону катода. Такой процесс будет продолжаться на всём протяжении канала от катода до анода.
Это произойдёт и с теми молекулами воды, которые примыкают к аноду. Электронные клинья оторвут от них молекулы водорода, и те, сорвавшись, уйдут в направлении к катоду.
С освободившихся атомов кислорода избыточные электроны перейдут на анод.
Как видим, на всём протяжении канала от катода до анода молекулы водорода перепрыгивают с одной молекулы воды на другую в сторону катода.
В результате на катоде появляются свободные молекулы водорода, а на аноде – свободные атомы кислорода.
Собираясь в пузырьки, они поднимаются вверх и скапливаются над водой. Атомы кислорода при этом объединяются в молекулярные пары O2.
Так как электроны перескакивают только на те молекулы воды, которые повёрнуты к ним своими водородными сторонами, можно подумать, что прочие молекулы воды распадаться не будут. Но учитывая то, что в процессе разложения происходят интенсивные движения частиц, затрагиваемые ими молекулы воды будут случайным образом разворачиваться и принимать подходящие положения.
Итак, в процессе электрического разложения воды происходят два вида перескоков с молекулы на молекулу:
- электроны перескакивают в направлении от катода к аноду;
- молекулы водорода перескакивают в направлении от анода к катоду.
Получение водорода в промышленности
Одним из промышленных способов получения водорода является реакция разложения воды под действием электрического тока:
Данный метод позволяет получить чистый водород и кислород. Процесс превращения химических веществ в другие вещества под действием электричества называется электролизом.
Электролиз – химическая реакция, протекающая под действием электрического тока Проведем электролиз воды. В стакан наполненный водой, опустим металлические электроды. Поверх электродов опустим в стакан пробирки, заполненные водой. Подсоединим электроды к источнику тока – батарейке. В пробирках наблюдается выделение газов – водорода и кислорода, которые вытесняют воду. Наблюдая за процессом электролиза, можно заметить, что в одной из пробирок газа собирается в два раза больше, чем в другой. Проанализировав уравнение реакции электролиза воды, можно сделать вывод, в какой пробирке выделяется водород, а в какой – кислород. Попробуйте это сделать самостоятельно.
Существуют и другие способы получения водорода. Железо-паровой метод долгое время широко применялся в промышленности. Через электрическую трубчатую печь проходит трубка из нержавеющей стали, заполненная железными стружками. Через трубку с железными стружками пропускают водяной пар. При температуре около 800°С пары воды взаимодействуют с железом, образуя оксид Fe3O4 (железную окалину) и газообразный водород:
Можно получить Н2, пропуская Н2О через слой раскаленного угля. При этом образуется смесь двух газов – СО и Н2 (водяной газ):
В настоящее время водород получают взаимодействием углеводородов (в основном метана, СН4) с водяным паром или неполным окислением метана кислородом:
Итог статьи:
- В лаборатории водород получают в аппарате Киппа
- Исходными веществами для получения водорода в лаборатории являются некоторые металлы и кислоты
- Собирать водород нужно методом вытеснения воды, или методом вытеснения воздуха, расположив пробирку вверх дном по отношению к газоотводной трубке
- Кислота – сложное вещество, в состав которого входят атомы водорода и кислотный остаток
- Обнаружить водород можно по характерному хлопку при поднесении пробирки с водородом к пламени
- Одним из промышленных способов получения водорода является электролиз воды
- Электролиз – химическая реакция, протекающая под действием электрического тока
Вода
Воду нельзя ничем заменить — этим она отличается практически от всех других веществ, которые встречаются на нашей планете. Воду может заменить только сама вода. Без воды нет жизни: ведь жизнь на Земле возникла тогда, когда на ней появилась вода. Жизнь зародилась в воде, поскольку она является естественным универсальным растворителем. Она растворяет, а значит, измельчает все необходимые питательные вещества и обеспечивает ими клетки живых организмов. А в результате измельчения резко возрастает скорость химических и биохимических реакций. Более того, без предварительного растворения невозможно протекание 99,5 % (199 из каждых 200) реакций! (См. также урок 5.1.)
Известно, что взрослый человек в сутки должен получать 2,5–3 л воды, столько же выводится из организма: т. е. в организме человека существует водный баланс. Если он нарушается, человек может просто погибнуть. Например, потеря человеком всего 1–2 % воды вызывает жажду, а 5 % — повышает температуру тела вследствие нарушения терморегуляции: возникает сердцебиение, возникают галлюцинации. При потере 10 % и более воды в организме возникают такие изменения, которые уже могут быть необратимы. Человек погибнет от обезвоживания.
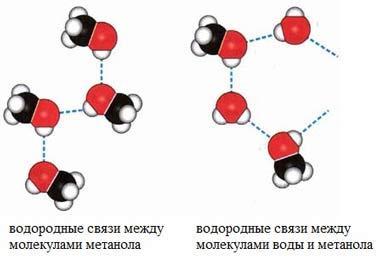
Вода — уникальное вещество. Её температура кипения должна составлять –80 °C (!), однако равна +100 °C. Почему? Потому что между полярными молекулами воды образуются водородные связи:
Поэтому и лёд, и снег — рыхлые, занимают больший объём, чем жидкая вода. В результате лёд поднимается на поверхность воды и предохраняет обитателей водоёмов от вымерзания. Свежевыпавший снег содержит много воздуха и является прекрасным теплоизолятором. Если снег покрыл землю толстым слоем, то и животные и растения спасены от самых суровых морозов.
Кроме того, вода имеет высокую теплоёмкость и является своеобразным аккумулятором тепла. Поэтому на побережьях морей и океанов климат мягкий, а хорошо политые растения меньше страдают от заморозков, чем сухие.
Без воды в принципе невозможен гидролиз, химическая реакция, которая обязательно сопровождает усвоение белков, жиров и углеводов, которые являются обязательными компонентами нашей пищи. В результате гидролиза эти сложные органические вещества распадаются до низкомолекулярных веществ, которые, собственно, и усваиваются живым организмом (подробнее см. уроки 25–27). Процессы гидролиза были нами рассмотрены в уроке 6. Вода реагирует со многими металлами и неметаллами, оксидами, солями.
Задание 12.6. Составьте уравнения реакций:
- натрий + вода →
- хлор + вода →
- оксид кальция + вода →
- оксид серы (IV) + вода →
- хлорид цинка + вода →
- силикат натрия + вода →
Изменяется ли при этом реакция среды (рН)?
Вода является продуктом многих реакций. Например, в реакции нейтрализации и во многих ОВР обязательно образуется вода.
Задание 12.7. Составьте уравнения таких реакций.
Водородное отопление: миф или реальность?
Генератор для сварочных работ – это на данный момент единственное практическое применение электролитическому расщеплению воды. Использовать его для отопления дома нецелесообразно и вот почему. Затраты энергоносителей при газопламенных работах не так важны, главное, что сварщику не нужно таскать тяжеленные баллоны и возиться со шлангами. Другое дело – отопление жилища, где каждая копейка на счету. И тут водород проигрывает всем существующим ныне видам топлива.
Серийные сварочные генераторы стоят немалых денег, поскольку в них используются катализаторы процесса электролиза, в состав которых входит платина. Можно сделать водородный генератор своими руками, но его эффективность будет еще ниже, чем у заводского. Получить горючий газ вам точно удастся, но вряд ли его хватит на обогрев хотя бы одной большой комнаты, не то что целого дома. А если и хватит, то придется оплачивать баснословные счета за электричество.
Чем тратить время и усилия на получение бесплатного топлива, которого не существует априори, проще смастерить своими руками простой электродный котел. Можете быть уверены, что так вы израсходуете гораздо меньше энергии с большей пользой. Впрочем, домашние мастера – энтузиасты всегда могут попробовать свои силы и собрать дома электролизер, с целью провести эксперименты и убедиться во всем самолично. Один из подобных экспериментов показан на видео:
Реакция — разложение — вода
Реакция разложения воды является наиболее характерной для щелочных металлов.
|
Сопоставление потенциалов разных электродов в растворах редокс-системы Се4 3. |
Реакция разложения воды: 2Се Н2О — — 2Се3 1 / 2О2 2Н, которая должна протекать активно, учитывая значения формальных потенциалов системы.
При изучении реакции электрохимического разложения воды в присутствии окислительно-восстановительных ферментов — гидрогеназ — было установлено, что их эффективность значительно возрастает, если фермент включен в полимерные матрицы, обладающие электронной проводимостью.
Химически активные материалы являются катализаторами реакции разложения воды.
Рассмотрение химического равновесия при наличии нескольких реакций разложения воды приводит к алгебраическим уравнениям высокой степени. Как известно, число корней уравнения равно его степени.
Имея в виду, что теоретический предел энергозатрат реакции разложения воды составляет 3 эВ / моль, КПД описанного процесса составит 90 — 97 / о в зависимости от параметров системы. Учитывая расход тепла на процесс испарения воды и на потери тепла в системе, авторы исследования считают, что на получение 1 м3 Н2 таким методом энергетические затраты составят 3 5 кВт — ч, против 6 кВт — ч при обычном электролизе. Кроме того, авторы отмечают более простое технологическое оформление процесса.
Данные по теплотам хемосорбции были получены путем измерения равновесий реакции разложения воды на палладии и сплавах палладия с серебром. Для палладиевой черни была получена величина теплоты адсорбции, равная — 24 ккал / моль.
Примером такой задачи является поиск химических рабочих тел для осуществления реакций разложения воды на водород и кислород в замкнутом цикле при наличии ограничений на температуру.
Потеря некоторого количества электричества обусловливается побочными реакциями, из которых главное значение имеет реакция разложения воды во время заряда аккумулятора. Известное значение здесь имеет также отделение активной массы от электродов.
|
Зависимость. — рН для платиновых ( X, золотых ( и стеклянных ( Д, ЭО-01, ( О, ЭО-021 электродов. |
Из этого следует, что хотя система СlOj 1 обладает ярко выраженными окислительными свойствами, но от кислых до нейтральных растворов реакцию разложения воды можно не учитывать.
Расход энергии в балансе электролизера состоит из теплового эффекта реакции разложения хлорида натрия и воды на хлор, водород и гидроокись натрия и реакции разложения воды на водород и кислород, а также физического тепла, уносимого из электролизера катодными щелоками, хлором и водородом, энтальпии паров воды, уносимых из электролизера газообразными продуктами электролиза, и потерь тепла через стенки аппарата в окружающую среду.
Расход энергии в балансе электролизера будет включать тепловой эффект реакции разложения хлорида натрия и воды на хлор, водород и гидроокись натрия, а также реакции разложения воды на водород и кислород, физическое тепло, уносимое из электролизера с катодными щелоками, хлором и водородом, энтальпию паров воды, уносимых из электролизера с газообразными продуктами электролиза, и потери тепла стенками аппарата в окружающую среду.
|
Изменение потенциала во времени после включения тока для замедленной электрохимической стадии при л 25 мВ. / — С 50 мкФ / см2. / КГ2 А / см2, т, 0 24 В, 1 / 1, 100. 2 — С 50 мкФ / см1. / 10 2А / см2, Т 0 36 В, J / t, 1000. |
Справка
Кислород — химический элемент с атомным номером 8, обозначающийся символом О, а также вещество (газ при нормальных условиях),
молекула которого состоит из двух атомов кислорода (O2). Кислород является самым лёгким элементом из группы халькогенидов (6 группа периодической системы).
История открытия
Официально считается, что кислород был открыт английским химиком Джозефом Пристли 1 августа 1774 путём разложения оксида ртути в герметично закрытом
сосуде (Пристли направлял на это соединение солнечные лучи с помощью мощной линзы).
Однако Пристли первоначально не понял, что открыл новое простое вещество, он считал, что выделил одну из составных частей воздуха
(и назвал этот газ «дефлогистированным воздухом»). О своём открытии Пристли сообщил выдающемуся французскому химику Антуану Лавуазье.
Несколькими годами ранее (возможно, в 1770-м) кислород получил шведский химик Карл Шееле. Он прокаливал селитру с серной кислотой и
затем разлагал получившийся оксид азота. Шееле назвал этот газ «огненным воздухом» и описал своё открытие в изданной в 1777 году книге
(именно потому, что книга опубликована позже, чем сообщил о своём открытии Пристли, последний и считается первооткрывателем кислорода).
Шееле также сообщил о своём опыте Лавуазье.
Важным этапом, который способствовал открытию кислорода, были работы французского химика Петра Байена, который опубликовал работы
по окислению ртути и последующему разложению её оксида.
Наконец, окончательно разобрался в природе полученного газа А. Лавуазье, воспользовавшийся информацией от Пристли и Шееле. Его работа имела
громадное значение, потому что благодаря ей была ниспровергнута господствовавшая в то время и тормозившая развитие химии флогистонная теория.
Таким образом, заслугу открытия кислорода фактически делят между собой Пристли, Шееле и Лавуазье.
Происхождение названия
Название oxygenium («кислород») происходит от греческих слов, обозначающих «рождающий кислоту»; это связано с первоначальным значением термина «кислота».
Ранее этим термином называли оксиды.
Нахождение в природе
Кислород — самый распространенный на Земле элемент, на его долю (в составе различных соединений, главным образом силикатов), приходится около 47,4 % массы
твердой земной коры. Морские и пресные воды содержат огромное количество связанного кислорода — 88,8 % (по массе), в атмосфере содержание свободного кислорода
составляет 20,95 % (по объёму) в воздухе массовая доля кислорода состовляет 23,12 % . Элемент кислород входит в состав более 1500 соединений земной коры.
Получение
В настоящее время в промышленности жидкий кислород получают из воздуха. В лабораториях пользуются кислородом промышленного производства,
поставляемым в стальных баллонах под давлением около 15 МПа. Важнейшим лабораторным способом его получения служит электролиз водных растворов
щелочей. Небольшие количества кислорода можно также получать взаимодействием раствора перманганата калия с подкисленным раствором пероксида
водорода.
Физические свойства
Газ без цвета, вкуса и запаха. Растворим в воде, причем растворяется тем лучше, чем ниже ее температура.
Поэтому плотность живых организмов в холодных приполярных водах может быть значительно выше, чем в теплых экваториальных.
Химические свойства
- Сильный окислитель, но не окисляет Au и Pt
- Взаимодействует со всеми HeMe, кроме галогенов, за исключением F
- Поддерживает процессы дыхания, горения, гниения
Биологическая роль кислорода
Кислород участвует в окислительно-восстановительных реакциях. Живые существа дышат кислородом воздуха.
Широко используется кислород в медицине. При сердечнососудистых заболеваниях, для улучшения обменных процессов,
в желудок вводят кислородную пену («кислородный коктейль»). Подкожное введение кислорода используют при трофических язвах,
слоновости, гангрене. Для обеззараживания и дезодорации воздуха и очистки питьевой воды применяют искусственное обогащение озоном.
Радиоактивный изотоп кислорода 15O применяется для исследований скорости кровотока, лёгочной вентиляции.
Токсические производные кислорода
Некоторые производные кислорода (т. н. реактивные формы кислорода), такие как синглетный кислород, перекись водорода, супероксид, озон и гидроксильный радикал,
являются высокотоксичными продуктами. Они образуются в процессе активирования или частичного восстановления кислорода. Супероксид (супероксидный радикал),
перекись водорода и гидроксильный радикал могут образовываться в клетках и тканях организма человека и животных и вызывают оксидативный стресс.
Инструкция: как сделать водородный генератор своими руками
Для изготовления топливной ячейки возьмём наиболее совершенную «сухую» схему электролизёра с использованием электродов в виде пластин из нержавеющей стали. Представленная ниже инструкция демонстрирует процесс создания водородного генератора от «А» до «Я», поэтому лучше придерживаться очерёдности действий.
Схема топливной ячейки «сухого» типа
Изготовление корпуса топливной ячейки. В качестве боковых стенок каркаса выступают пластины оргалита или оргстекла, нарезанные по размеру будущего генератора. Надо понимать, что размер аппарата напрямую влияет на его производительность, однако, и затраты на получение HHO будут выше. Для изготовления топливной ячейки оптимальными будут габариты устройства от 150х150 мм до 250х250 мм.
В каждой из пластин просверливают отверстие под входной (выходной) штуцер для воды. Кроме того, потребуется сверление в боковой стенке для выхода газа и четыре отверстия по углам для соединения элементов реактора между собой.
Воспользовавшись угловой шлифовальной машиной, из листа нержавеющей стали марки 316L вырезают пластины электродов. Их размеры должны быть меньше габаритов боковых стенок на 10 – 20 мм. Кроме того, изготавливая каждую деталь, необходимо оставлять небольшую контактную площадку в одном из углов. Это понадобится для соединения отрицательных и положительных электродов в группы перед их подключением к питающему напряжению.
Для того чтобы получать достаточное количество HHO, нержавейку надо обработать мелкой наждачной бумагой с обеих сторон.
В каждой из пластин сверлят два отверстия: сверлом диаметром 6 — 7 мм — для подачи воды в пространство между электродами и толщиной 8 — 10 мм — для отвода газа Брауна. Точки сверлений рассчитывают с учётом мест установки соответствующих подводящих и выходного патрубков.
Начинают сборку генератора. Для этого в оргалитовые стенки устанавливают штуцеры подачи воды и отбора газа. Места их присоединений тщательно герметизируют при помощи автомобильного или сантехнического герметика.
После этого в одну из прозрачных корпусных деталей устанавливают шпильки, после чего начинают укладку электродов.
Пластины нержавеющей стали отделяют от боковых поверхностей реактора при помощи уплотнительных колец, которые можно сделать из силикона, паронита или другого материала
Важно только, чтобы его толщина не превышала 1 мм. Такие же детали используют в качестве дистанционных прокладок между пластинами
В процессе укладки следят, чтобы контактные площадки отрицательных и положительных электродов были сгруппированы в разных сторонах генератора.
После укладки последней пластины устанавливают уплотнительное кольцо, после чего генератор закрывают второй оргалитовой стенкой, а саму конструкцию скрепляют при помощи шайб и гаек. Выполняя эту работу, обязательно следят за равномерностью затяжки и отсутствием перекосов между пластинами.
При помощи полиэтиленовых шлангов генератор подключают к ёмкости с водой и бабблеру.
Контактные площадки электродов соединяют между собой любым способом, после чего к ним подключают провода питания.
На топливную ячейку подают напряжение от ШИМ-генератора, после чего производят настройку и регулировку аппарата по максимальному выходу газа HHO.
Для получения газа Брауна в количестве, достаточном для отопления или приготовления пищи, устанавливают несколько генераторов водорода, работающих параллельно.
Как изготовить генератор
Масса интернет-ресурсов публикуют самые разные схемы и чертежи генератора для получения водорода, но все они действуют по одному принципу. Мы предложим вашему вниманию чертеж простого устройства, взятый из научно-популярной литературы:
Здесь электролизер представляет собой группу металлических пластин, стянутых между собой болтами. Между ними установлены изоляционные прокладки, крайние толстые обкладки тоже изготовлены из диэлектрика. От штуцера, вмонтированного в одну из обкладок, идет трубка для подачи газа в сосуд с водой, а из него – во второй. Задача емкостей – отделять паровую составляющую и накапливать смесь водорода с кислородом, чтобы подавать его под давлением.
Пластины, что служат электродами, могут быть произвольного размера. Но надо понимать, что производительность аппарата зависит от их площади поверхности. Чем большее число электродов удастся задействовать в процессе, тем лучше. Но при этом и потребляемый ток будет выше, это следует учитывать. К концам пластин припаиваются провода, ведущие к источнику электричества. Здесь тоже есть поле для экспериментов: можно подавать на электролизер разное напряжение с помощью регулируемого блока питания.
В качестве электролизера можно применить пластиковый контейнер от водяного фильтра, поместив в него электроды из нержавеющих трубок. Изделие удобно тем, что его легко герметизировать от окружающей среды, выводя трубку и провода через отверстия в крышке. Другое дело, что этот самодельный водородный генератор обладает невысокой производительностью из-за малой площади электродов.
Прямое термическое разложение
Прямое термическое разложение ( диссоциация) сульфата кальция происходит при температуре около 1450 и требует большой затраты тепла.
В противоположность прямому термическому разложению водяного пара при температуре примерно 3000 К разложение воды в низкотемпературной плазме протекает за счет термически неравновесного взаимодействия электронов плазмы с молекулами воды или при разложении диоксида углерода на оксид углерода и кислород с молекулами диоксида углерода. Получение водорода в плазме ( в СВЧ — и ВЧ-разрядах) представляет интерес в первую очередь по той причине, что удельная производительность химических процессов в разряде чрезвычайно велика.
|
Характеристики процесса диссоциации воды. |
Описана система получения водорода прямым термическим разложением водяного пара при 3000 К. Системой зеркал гелиостата ( с усилением плотности излучения в 1000 раз) пучок солнечных лучей направляют в реак-тор-диссоциатор водяного пара, расположенный в фокусе вогнутого зеркала. Водород немедленно удаляется из зоны реакции в результате диффузии через селективную полупроницаемую мембрану. Этим обеспечивается повышенная степень его разложения и извлечения.
Из приведеных данных следует, что прямое термическое разложение сероводорода сказывается лишь при температурах выше 1200 — 1300 С.
Летом 1974 г. была пущена лабораторная установка для прямого термического разложения воды с целью получения водорода.
Из предварительной оценки термического метода сделано заключение, что производство водорода прямым термическим разложением воды будет технически возможно, если будет найден эффективный метод разделения водорода и кислорода. Стоимость производства водорода может быть сравнима со стоимостью электроэнергии при наличии дешевой высокотемпературной тепловой энергии Солнца. Температура процесса ( 3000 К) достижима для современной техники, хотя необходимы усовершенствования для снижения энергозатрат. Термическое разложение воды с использованием солнечной энергии принципиально можно проводить по двум схемам: в виде непрерывного и периодического процессов.
|
Зависимость равновесной степени превращения сероводорода от содержания в газовой смеси водяного пара при различных температурах. |
При организации процессов высокотемпературной очистки газов от сероводорода необходимо учитывать возможность протекания в определенных условиях также реакции его прямого термического разложения.
Эту задачу, как показано выше, практически можно решить различными технологическими методами: газификацией углей; паровой каталитической конверсией углеводородов; паро-кислородной каталитической конверсией углеводородов; высокотемпературной конверсией углеводородов; металлопаровым процессом разложения воды; электроли ом воды; термохимическими и фотокаталитическими методами разложения воды; радиолизом и прямым термическим разложением воды; фотолизом воды в ультрафиолетовой области спектра при энергии фотона в диапазоне 5 — 12 59 эВ; биоконверсией воды и другими методами.
Исследовалось восстановление тетрахлорнда циркония водородом при высоких температурах, однако металл получался в мелкодисперсном состоянии, его было трудно собирать и, наконец, требовался большой расход чистого водорода. Восстановление тстраиодида циркония водородом не дает никаких преимуществ по сравнению с прямым термическим разложением, так как образование иодистоводородноп кислоты сопровождается поглощением тепла.
Однако в связи с возможностью протекания побочных реакций с образованием окиси углерода ( СО, С2СО), серы ( 3CaS CaSO. Следует отметить также, что не все количество углерода вступает в реакцию с сульфатом кальция в связи с прямым термическим разложением фосфоангидрита; при 1100 разлагается около 5 % фосфоангид-рита, а в присутствии SiO2, A13O2, Fe2O3 процент разложения должен быть еще выше.
Каким образом можно воду расщепить на водород и кислород?
kudec Гуру (4476) 6 лет назад
А в чем проблема, в малых количествах можно и два любых электрода (проводок, пластинка) вставить в воду и дать постоянное напряжение порядка 10-20 вольт.
Marat Просветленный (25772) 6 лет назад
Это просто.
1) Нетрудно показать, что равновесие 2H2O = 2H2 + O2 сместится в прямом направлении при температуре порядка +2000С. Недостатком термического способа является большая энергоёмкость и наличие других равновесий (с участием, например пероксида водорода).
2) Химический способ. Вода может быть как окислителем, так и восстановителем. Из воды можно выделить кислород, окислив её свободным фтором: F2 + H2O = O2 + HF. С другой строны, активный щелочной металл запросто вытеснит из воды водород: Na + H2O = H2 + NaOH (данные реакции идут при нормальных условиях).
3) Облучение паров воды лазером с использованием фемтохимических методов. Существует множество различных путей реакции с участием взаимодействующих молекул H2O. Задавая последовательность лазерных импульсов в определённой последовательности и в определённом частотном диапазоне, можно заставить систему дать в конечном итоге именно H2 и O2. Здесь положение усугубляется спиновым запретом процессов элементарного акта, но и его можно снять.
4) Электролиз жидкой воды: пропускание тока через ячейку, заполненную водой (водным раствором). Тогда на аноде будет выделяться кислород, а на катоде — водород. Легко показать, что минимальное напряжение, необходимое для этого, составляет порядка 2.2 вольт (в реальности, разумеется, больше — из-за омических потерь в водном растворе). Этот способ разложения воды на простые вещества является, пожалуй, наиболее доступным.