Синтез-газ из углекислого газа и воды
Содержание:
- Способы насыщения воды углекислым газом
- Зачем со2 в аквариуме
- Взаимодействие с землей
- ОКСИД УГЛЕРОДА (2)
- Необходимость выработки углекислоты
- Как контролировать?
- Подача углекислоты при помощи газированной воды
- Хрупкая девушка из политеха изобрела уникальную газотурбинную установку по получению электричества и тепла с помощью углекислого газа. Эту штуку можно установить на мусоросжигательном заводе и вообще везде, откуда идёт загрязнение воздуха.
- Каково значение выделения углекислого газа у растений?
- Получение, собирание и хранение газов
Способы насыщения воды углекислым газом
Существует несколько вариантов подачи углекислоты:
- Баллонная установка;
- Брага;
- Химические реакции с кислотами;
- Углеродсодержащие препараты;
- Использование газированной воды.
Баллонная установка
Это самый удобный и правильный способ подачи газа в воду. Оптимален для применения в общем аквариуме большого объема.
Система включает баллон и редуктор, состоящий из:
- Клапана тонкой регулировки скорости подачи газа;
- Соленоидного клапана с катушкой;
- Предохранительного клапана сброса давления;
- Манометров, позволяющих контролировать давление;
- Счетчика пузырьков.
Приобрести установку можно в магазине зоотоваров. Сколько стоит прибор, зависит от производителя и возможности заправки: цена одноразового баллона – примерно 15 тысяч рублей, а за пополняемый придется выложить 20-50 тысяч рублей.
Преимущество генератора – четкий контроль концентрации выхода CO2. Недостаток – сложная сборка.
Баллон находится под давлением. Как правильно им пользоваться:
- Не ронять;
- Хранить в вентилируемом помещении вдали от источников тепла и огня;
- Не оставлять под прямым солнечным светом, а также в месте, где температура превышает +50°C;
- Эксплуатировать в вертикальном положении;
- Заправлять на специально предназначенных для этого станциях;
- Не вдыхать газ.
Брага
Такой источник CO2 представляет собой герметично закупоренную емкость, от которой отходит трубка. Внутри находится брага.
Инструкция, как использовать средство: на 1 л воды, находящейся в 2-литровой емкости, берут 300 г сахара и 0,3 г сухих дрожжей. Иногда подсоединяют вторую емкость, чтобы предупредить попадание вспенившейся браги в аквариумную воду. Чтобы продлить брожение, используют соду, желатин или крахмал. Но все равно приспособление не работает дольше 2 недель: дрожжи, переработав сахар, гибнут от образовавшегося спирта. Приходится разбирать конструкцию, чистить, заправлять заново.
Достоинства устройства – легкая сборка, безопасное использование. Недостатки – нестабильный и неконтролируемый выход углекислого газа.
Химические реакции
Менее применяемый в домашних условиях способ, как насытить воду CO2, – проведение химической реакции между продуктами карбонатной природы (содой, мелом, скорлупой яйца, доломитом) и кислотой (лимонной, уксусной). Чтобы контролировать количество выделяемого углекислого газа, процесс осуществляют в лабораторном аппарате Киппа.
Достоинство метода – экономичность. Недостатки, как и у браги: проблематичное регулирование уровня образования газа, необходимость обновления реагентов. Обязательна установка защитного приспособления, поскольку образующаяся углекислота забирает с собой частицы кислоты, возникает опасность отравления обитателей резервуара.
Углеродсодержащие препараты
Бывают жидкими (например, Tetra CO2 Plus) или в виде растворимых таблеток (Hobby Sanoplant CO2), содержащих карбонат кальция и органическую кислоту. Принцип работы средства простой: таблетка при опускании в аквариумную воду медленно растворяется с выделением углекислоты. Но минус в том, что определять дозировку препарата приходится на глаз, и она не всегда верна.
Газированная вода
Для обогащения углекислым газом небольшого аквариума (до 20 л) можно ежедневно добавлять обычную газированную воду без содержания минералов. На 10-литровый резервуар достаточно 20 мл жидкости.
Зачем со2 в аквариуме
Система СО2 включает в состав необходимый для этого газ, который обогащает аквариумные растения здоровьем и красотой. Уровень углекислого газа в резервуаре практически приравнен к нулю. Количество газа не увеличивается и в процессе естественной выработки за счёт жизнедеятельности аквариумных жителей. В аквариумной воде происходит процесс фотосинтеза и наилучшее усвоение удобрений растениями, благодаря своевременной и правильной подаче углекислоты. Фотосинтез начинается только после того, как флора в аквариуме впитывает в себя воду и углекислый газ, состоящий из молекул углерода. Вот почему он так нужен растениям.
Взаимодействие с землей
Углекислый газ воздуха на генетическом уровне взаимосвязан с землей. Постоянно протекающие почвенные движения увеличивают резервы СО2 в воздухе, где он используется растениями на образование органических элементов. Углекислота выполняет важную функцию в формировании и проветривании почвы. Он принимает участие в разрушении основных минералов, увеличении растворяемости, перемещении карбонатов и фосфатов.
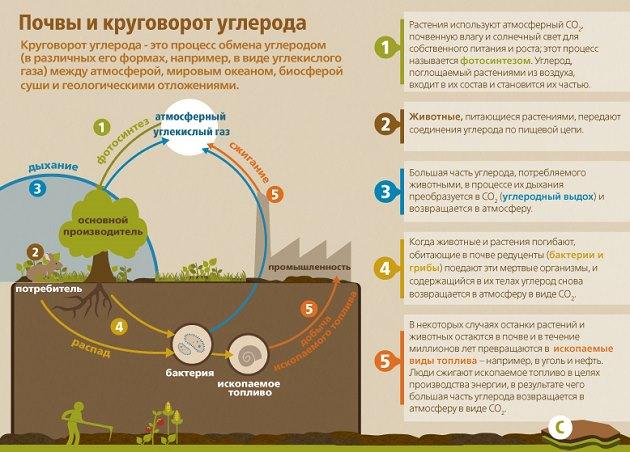
Значительная доля диоксида углерода грунтового воздуха появляется в результате деятельности почвенных организмов, во время распада и окисления органического элемента. До 1/3 части СО2 вырабатывается корнями высоких растений. Также происходит поступление углекислого газа с газами ювенильного и вадозного происхождения из глубочайших шаров земли. В почвах, сформированных на известковых породах, СО2 способен выступать продуктом разрушения углекислого кальция почвенными кислотами.
В почвах с большим содержанием органического вещества концентрация СО2 летом и весной увеличивается до 3-9 %. Черноземные грунты вырабатывают от 2 до 6 кг углекислого газа на протяжении 24 часов. В почвенном воздухе на глубине 75-150 см в два раза больше содержание СО2 нежели в верхних слоях. В теплые времена содержание СО2 в почвенном воздухе в два раз больше чем в зимний период. Объяснить это можно увеличением активности организмов в грунте.
Необходимо понимать, что многочисленные способы земледелия приводят к повышению концентрации углекислоты в грунте. Среди них можно выделить:
- органические удобрения;
- травосеяние;
- сжатие катками.
Безусловно, не стоит говорить, что плодородность и качество земли зависит исключительно от углекислоты, есть и другие факторы, влияющие на это.
Чтобы регулировать динамику СО2 в почве и увеличивать его содержание до требуемого количества для извлечения хорошего урожая необходимо:
- активировать жизненные процессы в грунте при помощи аэрации;
- осуществлять правильное травосеяние для того чтобы поддерживался и обновлялся резерв органического вещества;
- делать сидерацию и вносить органические удобрения.
ОКСИД УГЛЕРОДА (2)
В молекуле СО атом углерода находится состоянии
sp-гибридизации, связь С-О тройная. Две связи возникают за счет
неспаренных электронов атомов углерода и кислорода, третья — по
донорно-акцепторному механизму за счет электронной пары
кислорода и свободной орбитали атома углерода:
С
О
Энергия связи в
молекуле СО составляет 1076 кДж/моль.
СО — бесцветный газ без запаха и вкуса,
температура плавления -205oС, кипения
-192oС, очень ядовит, так как связывается с
гемоглобином прочнее, чем кислород, в результате чего СО
блокирует перенос кислорода в организме. В воде СО растворим
плохо.
СО — несолеобразующий оксид. В обычных условиях
не взаимодействует с водой и щелочами, в жестких условиях — под
давлением 6-8 ат (0,6-0,8 МПа) и 120-130oС
взаимодействует с гидроксидом натрия:
HCOONa
однако вода в этой
реакции не образуется даже при избытке щелочи, поэтому эта
реакция не позволяет причислить СО к кислотным оксидам.
Оксид углерода (2) взаимодействует:
а) с переходными металлами, образуя карбонилы,
например:
Fe(CO)5
Ni(CO)4
Карбонилы
железа и никеля — летучие ядовитые жидкости, атом металла в
карбониле находится в нулевой степени окисления.
б) с водородом при 250-300oС и 60 ат
(6 МПа) в присутствии катализаторов CuO и
Cr2O3:
CH3OH
в) с хлором в
присутствии активированного угля в качестве
катализатора:
COCl2
при этом
образуется фосген.
г) горит с выделением
большого количества тепла:
CO + O2 =
2CO2
Н =
-283 кДж/моль
д) восстанавливает
при нагревании оксиды металлов (стоящих в ряду напряжений правее
алюминия), например:
3CO = 2Fe + 3CO2
СО
В промышленности СО
получают:
а) сжиганием углерода при
температуре выше 1000oС и недостатке
кислорода:
б) взаимодействием углекислого газа с
раскаленным коксом:
2CO
в) взаимодействием водяного
пара с раскаленным коксом:
+ H2
при этом
образуется смесь СО и водорода, которая называется “водяной
газ”.
В лаборатории СО можно
получить обезвоживанием муравьиной кислоты концентрированной
серной кислотой при нагревании:
H2O
Оксид углерода (2) применяют:
а) в качестве топлива
б) в
синтезе метанола, спиртов, альдегидов, кислот
в) для получения карбонилов металлов
г) в качестве восстановителя
Необходимость выработки углекислоты
Достаточно часто собираются такие системы, которые способны доставлять углекислый газ в аквариумную воду. Часто они имеют множество применений, которые не ограничиваются этим. Они участвуют во многих процессах, например:
- Выработка кислорода. Кроме питательных веществ, растения в процессе фотосинтеза могут снабжать воду этим веществом. Таким образом, рыбки, которые живут в аквариуме, будут нормально дышать и не умрут от нехватки кислорода.
- Контроль уровня pH. Кислотность немного повышается, снижая тем самым его показатель. Это создаёт гораздо более приемлемые условия для нормального функционирования всех живых существ внутри.
Стоит отметить, что полностью перекладывать на растения работу по насыщению воды кислородом нельзя. Ночью, при отсутствии солнечного света, который нужен для образования глюкозы из углекислоты, процесс не запустится. Поэтому обязательно нужен аэратор — механизм, который сможет автоматически подавать воздух в воду, после чего какое-то количество кислорода будет в ней растворяться и не давать погибнуть живности внутри.
Как контролировать?
Концентрация в воде углекислого газа – жизненно важный аспект, нуждающийся в постоянном контроле.
Дропчекер-тесты
Внешне устройство походит на каплю, которая наполнена индикаторной жидкостью. Индикатор реагирует на изменения концентрации диоксида углерода, что проявляется в изменении цвета жидкости: желтый – избыток СО2, зеленый – оптимальное количество, синий – недостаточный уровень углекислоты. Дропчекер прост и удобен в использовании, но он является тестом медленного действия.
Специальными жидкостями-индикаторами
 Этот способ позволяет в течение 5 минут определить уровень двуокися углерода в воде. Принцип действия – жидкость – индикатор показывает значения рН и КН (карбонатная жесткость).
Этот способ позволяет в течение 5 минут определить уровень двуокися углерода в воде. Принцип действия – жидкость – индикатор показывает значения рН и КН (карбонатная жесткость).
Путем сравнения цвет индикатора сопоставляется со специальной цветовой шкалой, благодаря чему можно оценить концентрацию СО2 в аквариуме. Из недостатков следует отметить постепенное обесцвечивание жидкости, что потребует ее замены. В целом метод прост и эффективен.
Наблюдение
Самый неточный способ отслеживания уровня СО2 в воде, основанный на субъективном мнении: аквариумист наблюдает за поведением рыб и состоянием растений, отмечая нетипичные реакции живых организмов и побледнение растительности.
Подача углекислоты при помощи газированной воды
Многие аквариумисты, задумываясь над таким вопросом, как система подачи CO2 в аквариум своими руками, даже не догадываются, что проблема может быть решена весьма простым путем – газированной минеральной водой. В бутылках минералки с газом содержится значительное количество углекислоты – до 10000 мг/л. Даже учитывая, что после открытия емкости большая часть газа моментально выветривается, в газированной воде все равно остается приличная часть CO2 – 1500 мг/л.
Следует сразу отметить, что способ подачи CO2 своими руками при помощи газированной воды подходит только для тех резервуаров, чья вместимость не превышает 50 л. Для введения углекислоты нужно всего лишь каждое утро наливать в водоем газированную водичку из расчета 20 мм/10 л жидкости. Этого количества будет достаточно для представителей флоры, и уже скоро зеленые жители скажут владельцу «спасибо», демонстрируя цветущий и здоровый вид.
Хрупкая девушка из политеха изобрела уникальную газотурбинную установку по получению электричества и тепла с помощью углекислого газа. Эту штуку можно установить на мусоросжигательном заводе и вообще везде, откуда идёт загрязнение воздуха.
class=»_1AbX1″>
Автор изобретения Анна Просвирнова. Фото предоставлено ПНИПУ
Это Анна Просвирнова, 22-летняя магистрантка Пермского политехнического университета. И вот её дипломная работа — результат двух лет кропотливого труда. То есть это, конечно, не сам проект, но схематичное описание изобретения.
Принцип работы примерно такой: углекислый газ прогоняется по замкнутому кругу между компрессором, теплообменником, турбиной и охладителем — и в процессе вырабатывает тепло или электричество. Или и то и другое.
Это замкнутая газотурбинная установка, то есть всё идёт по циклу, по кругу, и вырабатывается в итоге энергия
Анна Просвирнова
Автор изобретения, студентка Пермского национального исследовательского политехнического университета
По словам Анны, поработать над концепцией такого агрегата ей предложил научный руководитель — доцент кафедры ракетно-космической техники и энергетических систем Николай Леонидович Бачев.
Всё началось с того, что на третьем курсе я подошла к нему, говорю: «Будете ли вы моим научным руководителем?» Он сказал, мол, буду — и вот смотри, есть такая теоретическая часть. Все основы как бы он заложил мне, сказал, что можно, в принципе, это сделать. Меня это очень заинтересовало, и мы начали работать. Я искала материал, мы считали, многое не получалось, потом вроде всё получилось, КПД увеличивается, ура
Анна Просвирнова
Автор изобретения, студентка Пермского национального исследовательского политехнического университета
Сам научный руководитель в свою очередь попытался внести полную ясность: изначально идея замкнутой газотурбинной установки принадлежала Бауманскому университету, задумали там это устройство для несколько других целей.
Они планировали применять их на космических энергоустановках, а мы предложили их использовать здесь, на земле, прицепить их к мусоросжигающим установкам для утилизации
Николай Бачев
Доцент кафедры ракетно-космической техники и энергетических систем ПНИПУ
Одна печаль — система, по сути, не очищает атмосферу от выбросов. Вредные газы лишь подпитывают систему энергией, а потом всё равно попадают в воздух — просто в охлаждённом виде. Вся польза — в энергии. По сути, получается электро- или теплостанция на углекислом газе. В случае установки, скажем, на мусоросжигательном заводе — ТЭЦ, работающая на отходах.
Тепловую энергию можно использовать, чтобы нагревать воду для отопления, а можно получать электрическую энергию с помощью электрогенератора. То есть тут даже возможна комбинированная выработка электричества и тепла
Николай Бачев
Доцент кафедры ракетно-космической техники и энергетических систем ПНИПУ
Надо сказать, такой подход уже давно активно используется за рубежом. К примеру, в Германии 30 электростанций работают на отходах. Во Франции 12 мусоросжигательных заводов заняты электроснабжением Парижа. В Финляндии только один крупнейший завод вырабатывает треть всего необходимого электричества.
В России ежегодно выбрасывают 70 миллионов тонн мусора — и почти всё это по-прежнему хоронят на полигонах, по разным данным, лишь от трёх до семи процентов отходов хоть как-то перерабатывают. К 2024 году, правда, планируют построить целых пять мусорных электростанций, а в мае 2020-го договорились о возведении ещё 25 за ближайшие десять лет.
Меж тем новая газотурбинная установка, по словам изобретателей, позволяет превратить в завод waste-to-energy («отходы в энергию») практически любое дымящее предприятие.
Кроме мусоросжигательных заводов можно их использовать в газовой промышленности, там у них огромные трубы, выхлоп идёт, вот этот выхлопной газ опять же можно использовать для подпитки этой газотурбинной установки
Николай Бачев
Доцент кафедры ракетно-космической техники и энергетических систем ПНИПУ
В теории это подходит для любого предприятия, которое портит атмосферу
Анна Просвирнова
Автор изобретения, студентка Пермского национального исследовательского политехнического университета
По словам Анны, сейчас она пытается доработать механизм отвода тепла, а в остальном схема полностью готова к своему физическому воплощению. Николай Бачев заверил, что собрать такой агрегат на самом деле не так уж сложно и дорого: можно использовать компрессоры, теплообменники и прочие составные части уже существующих аппаратов и просто соединить их вместе, как конструктор. Он добавил, что в принципе систему можно снабдить и системой очистки — и тогда выбросы не только принесут пользу, но и станут менее вредными.
Самое интересное из мира науки и технологий — в телеграм-канале автора.
Каково значение выделения углекислого газа у растений?
С помощью солнечного света всевозможная флора потребляет диоксид углерода и воду, после чего происходит процесс фотосинтеза, в ходе которого она перерабатывает их в кислород, органические вещества, вновь получая воду. В дикой среде им полностью хватает того, что предоставляет природа. При выращивании людьми с увеличением объёма фотосинтеза из-за избытка света возрастает объём потребляемого CO2. К примеру, в тепличном воздухе на площади в один гектар находится двадцать килограмм вещества. Если вы предприниматель и выращиваете на продажу огурцы, этого объёма им будет явно недостаточно. Типичная сельскохозяйственная культура летом потребляет до пятидесяти килограмм, причём за час своего существования
А где нехватка, там и меньше урожайность, что крайне важно для хозяев теплиц. Обеспечение теплиц углекислым газом для профессионалов тепличного бизнеса является проблемой на порядок серьёзнее, чем нехватка питательных веществ в почве – вторая проблема устраняется легко
При критической отметке содержания углекислого газа в 0,01 процента растения прекращают фотосинтез.
От низкого содержания углекислоты не спасёт даже постоянное проветривание теплиц. Не говоря уже о том, что нарушение температурного режима чревато гибелью потенциального урожая. Что ещё можно сделать? Всё верно: внести дефицитное вещество в землю.
Получение, собирание и хранение газов
Газы имеют важное значение в жизни и деятельности человека. Поэтому необходимо уметь их получать, собирать и хранить
В химической лаборатории небольшие объемы газов можно получать различными способами. Например, газы выделяются при нагревании некоторых твердых веществ (рис. 66).

Газообразные вещества могут образовываться при действии некоторых жидких веществ на твердые. Так, при действии уксуса на мрамор или мел выделяется углекислый газ (рис. 67).

В промышленности используют значительно большие, чем в химических лабораториях, количества различных газов. Большие объемы кислорода и азота получают из воздуха. Позднее вы узнаете, как это делается.
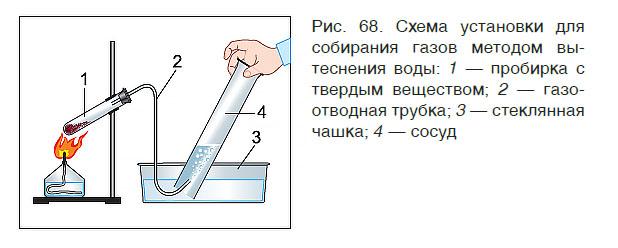
В лабораторных условиях собрать газ в сосуд можно двумя способами: вытеснением воды (рис. 68) и вытеснением воздуха. Первый способ применяют для собирания только нерастворимых в воде газов (кислород, азот, водород). Вто- рой — для собирания как растворимых (аммиак, углекислый газ), так и нерастворимых в воде газов.
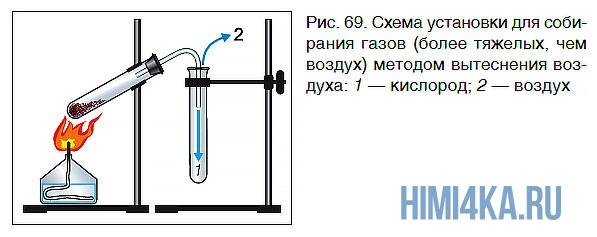
Для собирания газов, которые легче воздуха, сосуд для сбора газа следует закрепить дном вверх, а для газов, которые тяжелее воздуха, — дном вниз (рис. 69)
Для хранения газов следует использовать сосуды, не сообщающиеся с окружающей средой. Такие сосуды называют герметичными (т. е. не имеющими отверстий для выхода газа из сосуда наружу). В быту примером герметичного сосуда является бутылка с плотной пробкой, завязанный воздушный шарик или накачанная камера от велосипедного колеса, в химической лаборатории — пробирка, плотно закрытая пробкой, газометр.
Из курса физики вы знаете, что при нагревании газы расширяются. Это свойство можно использовать для проверки прибора для получения газов на герметичность (рис. 70). Для этого после сборки прибора следует погрузить конец газоотводной трубки в воду, а пробирку на несколько секунд зажать в ладони. Нагреваясь от тепла руки, воздух в пробирке расширяется и выходит из газоотводной трубки в виде пузырьков. Если пузырьки не наблюдаются, то это свидетельствует о том, что прибор собран негерметично и для газа имеется другой выход, кроме газоотводной трубки.

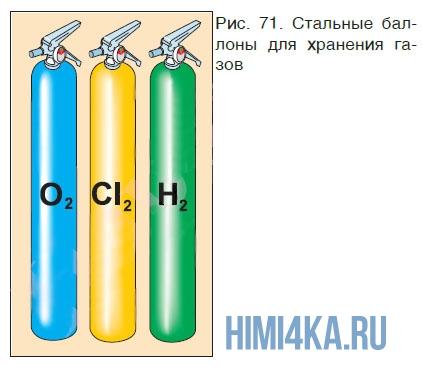
В промышленности для хранения газов чаще всего используют более прочные сосуды — баллоны (рис. 71), в которых сжатые газы находятся под большим давлением; для предупреждения разрушения баллона сжатым газом его стенки делают из толстой стали. Узнать, какой газ содержится в баллоне, можно по окраске баллона, цвету надписи на нем и цвету полосы. Например, баллон с кислородом должен быть окрашен в голубой цвет и иметь черную надпись «Кислород», баллон с азотом должен быть окрашен в черный цвет, иметь желтую надпись «Азот» и коричневую полосу, баллон с очень чистым аргоном должен быть окрашен в серый цвет, иметь зеленую надпись «Аргон» и зеленую полосу.
Краткие выводы урока:
- Вещества могут находиться в газообразном, жидком или твердом агрегатном состоянии.
- Воздух представляет собой смесь газов. Основными компонентами воздуха являются азот и кислород.
- При нормальных условиях в воздухе объемом 100 дм3 содержится азот объемом около 78 дм3 и кислород объемом около 21 дм3.
- Воздух можно условно рассматривать как газ, молярная масса которого равна 29 г/моль.
Надеюсь урок 15 «Воздух как смесь газов» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.















