Происхождение и открытие углекислого газа, круговорот его в природе и промышленности
Содержание:
- Углекислый газ и мы: чем опасен CO2
- Углекислый газ и его физические свойства
- Оксиды углерода в природе
- Сколько подавать углекислоты
- Примечания
- Создание генератора CO2 своими руками
- Применение в промышленности
- CO2 при ферментации сахара
- ученицей группы 1.3
- Получение в промышленности
- Похожие:
- Получение
- Химическая формула и способ получения углекислого газа
- Взаимодействие с другими веществами:
- Применение
Углекислый газ и мы: чем опасен CO2
Углекислый газ — один из продуктов обмена веществ в организме человека. Он играет большую роль в управлении дыханием и снабжением кровью органов. Рост содержания CO2 в крови вызывает расширение сосудов, способных таким образом транспортировать больше кислорода к тканям и органам. Аналогично и система дыхания понуждается к большей активности, если концентрация углекислоты в организме растет. Это свойство используют в аппаратах искусственной вентиляции легких, чтобы подстегнуть собственные органы дыхания пациента к большей активности.
https://youtube.com/watch?v=DqbvEhn5uJc
Кроме упомянутой пользы, превышение концентрации СO2 может принести организму и вред. Повышенное содержание во вдыхаемом воздухе приводит к тошноте, головной боли, удушью и даже к потере сознания. Организм протестует против углекислого газа и подает человеку сигналы. При дальнейшем увеличении концентрации развивается кислородное голодание, или гипоксия. Co2 мешает кислороду присоединяться к молекулам гемоглобина, которые и осуществляют перемещение связанных газов по кровеносной системе. Кислородное голодание ведет к снижению работоспособности, ослаблению реакции и способностей к анализу ситуации и принятию решений, апатии и может привести к смерти.
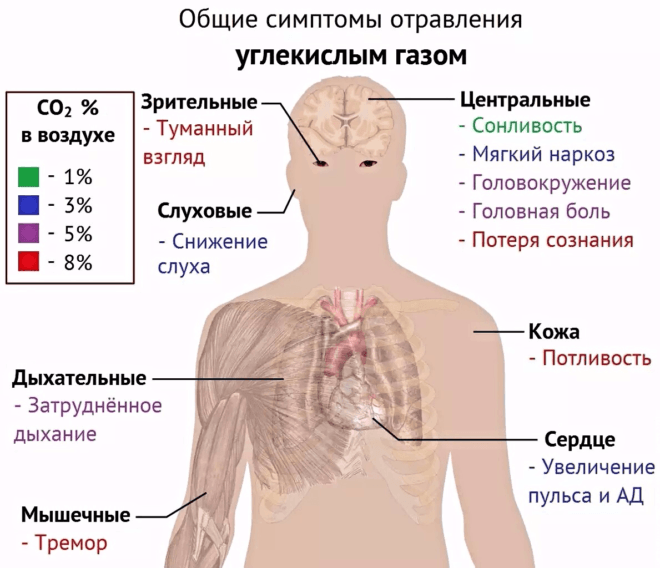
Общие симптомы отравления углекислым газом
Такие концентрации углекислого газа, к сожалению, достижимы не только в тесных шахтах, но и в плохо проветриваемых школьных классах, концертных залах, офисных помещениях и транспортных средствах — везде, где в замкнутом пространстве без достаточного воздухообмена с окружающей средой скапливается большое количество людей.
Углекислый газ и его физические свойства
Углекислый газ состоит из углерода и кислорода. Формула углекислого газа выглядит так – CO₂. В природе он образуется при сжигании или гниении органических веществ. В воздухе и минеральных источниках содержание газа также достаточно велико. кроме того люди и животные также выделяют диоксид углерода при выдыхании.
Рис. 1. Молекула углекислого газа.
Диоксид углерода является абсолютно бесцветным газом, его невозможно увидеть. Также он не имеет и запаха. Однако при его большой концентрации у человека может развиться гиперкапния, то есть удушье. Недостаток углекислого газа также может причинить проблемы со здоровьем. В результате недостатка это газа может развиться обратное состояние к удушью – гипокапния.
Если поместить углекислый газ в условия низкой температуры, то при -72 градусах он кристаллизуется и становится похож на снег. Поэтому углекислый газ в твердом состоянии называют «сухой снег».
Рис. 2. Сухой снег – углекислый газ.
Углекислый газ плотнее воздуха в 1,5 раза. Его плотность составляет 1,98 кг/м³ Химическая связь в молекуле углекислого газа ковалентная полярная. Полярной она является из-за того, что у кислорода больше значение электроотрицательности.
Важным понятием при изучении веществ является молекулярная и молярная масса. Молярная масса углекислого газа равна 44. Это число формируется из суммы относительных атомных масс атомов, входящих в состав молекулы. Значения относительных атомных масс берутся из таблицы Д.И. Менделеева и округляются до целых чисел. Соответственно, молярная масса CO₂ = 12+2*16.
w = n * Ar / Mr
n – число атомов или молекул.
Ar – относительная атомная масса химического элемента.Mr – относительная молекулярная масса вещества.
Рассчитаем относительную молекулярную массу углекислого газа.
Mr(CO₂) = 14 + 16 * 2 = 44 w(C) = 1 * 12 / 44 = 0,27 или 27 % Так как в формулу углекислого газа входит два атома кислорода, то n = 2 w(O) = 2 * 16 / 44 = 0,73 или 73 %
Ответ: w(C) = 0,27 или 27 %; w(O) = 0,73 или 73 %
Оксиды углерода в природе
Оба вида рассматриваемых здесь оксидов углерода так или иначе присутствуют в природном мире. Так, угарный газ может быть продуктом сгорания лесов или результатом жизнедеятельности человека (выхлопные газы и вредные отходы промышленных предприятий).
Уже известный нам диоксид углерода также является частью сложного состава воздуха. Его содержание в нем составляет около 0,03 % от всего объема. При увеличении этого показателя возникает так называемый «парниковый эффект», которого так опасаются современные ученые.

Видимо, многие власть держащие забыли пройденный в детстве материал учебника «Общая химия
8 класс», иначе вопросу вырубки лесов во многих частях света уделялось бы более серьезное внимание. Это, кстати, касается и проблемы наличия угарного газа в окружающей среде
Количество отходов человеческой жизнедеятельности и процент выбросов этого необычайно токсичного материала в окружающую среду растет изо дня в день. И не факт, что не повторится судьба мира, описанная в прекрасном мультфильме «Волли», когда человечеству пришлось покинуть загаженную до основания Землю и отправиться в другие миры на поиски лучшей жизни.
Сколько подавать углекислоты
То, сколько подавать углекислого газа в аквариум, зависит от вместимости резервуара и количества представителей флоры и фауны, поэтому расчеты совершаются индивидуально. Подсказать, что уровень углекислоты повышен или понижен, аквариумисту помогут следующие признаки:
- Если уровень выделяемой углекислоты находится в норме, то спустя неделю можно заметить, что листики растений покрылись пузырьками кислорода.
- При правильном уровне CO2 питомцы будут вести себя подвижно, выглядеть здоровыми и бойкими. Если самочувствие рыбок ухудшилось, то нужно отселить фенотипы на время в отдельную емкость, а подачу углекислоты прекратить. Вернуть питомцев в старый водоем можно через два часа, а подачу возобновить спустя пару дней.
- О превышении уровня углекислого газа сигнализирует избыток водорослей, которые покроют налетом стенки и декорации резервуара.
- О понижении уровня углекислоты в искусственном водоеме подскажет значительно уменьшение кислотности воды. В этом случае опытные аквариумисты рекомендуют добавить в воду 1 чайную ложку соды на 50 л.
Точно определить количество выделяемого углекислого газа в аквариум могут специальные тесты с индикаторами, которые можно приобрести в зоомагазинах.
Примечания
- (англ.). Earth System Research Laboratory. Дата обращения 16 мая 2018.
- ↑ (англ.) Petty, G. W.: A First Course in Atmospheric Radiation, pages 229—251, Sundog Publishing, 2004
- ↑ (англ.)
- ↑
- Подрезов А. О., Аламанов С. К.; Лелевкин В. М., Подрезов О. А., Балбакова Ф. (недоступная ссылка) 18. Дата обращения 16 июня 2012.
- . scied.ucar.edu. Дата обращения 29 июня 2019.
- . The World Only. Дата обращения 10 февраля 2020.
- ↑
- ↑ (англ.) Gerlach, T. M., 1992, Present-day CO2 emissions from volcanoes: Eos, Transactions, American Geophysical Union, Vol. 72, No. 23, June 4, 1991, pp. 249, and 254–255
- ↑ Keeling et al., 1995
- ↑
- (англ.)
- ↑
- (англ.) V.L. Koshkarova and A.D. Koshkarov. Regional signatures of changing landscape and climate of northern central Siberia in the Holocene (англ.) // Russian Geology and Geophysics : journal. — 2004. — Vol. 45, no. 6. — P. 672—685.
- ↑
- (англ.) Tans, Pieter. . NOAA/ESRL. Дата обращения 19 февраля 2014.
- (англ.) (недоступная ссылка). Дата обращения 21 июня 2019.
- (недоступная ссылка). Дата обращения 30 октября 2017.
- (англ.). TechCrunch. Дата обращения 1 августа 2019.
- (англ.). The Keeling Curve (4 June 2019). Дата обращения 1 августа 2019.
- (англ.) (недоступная ссылка). Дата обращения 12 июня 2007.
- (англ.)
- (англ.)
- (англ.)
- (англ.) Archer, D. (2005). Fate of fossil fuel CO2 in geologic time. J. Geophys. Res., 110.
Создание генератора CO2 своими руками
Чтобы обеспечить растениям подачу углекислоты, можно приобрести реактор CO2 в специализированных магазинах, однако подобная установка отличается огромными размерами и стоит недешево. Опытные аквариумисты предпочитают использовать самоделки – генератор CO2, изготовленный самостоятельно из подручных материалов.
По результативности самодельный агрегат не уступает магазинным аналогам, а сборка и установка прибора CO2 в аквариуме не займет много времени, денежных средств и сил владельца.

Материалы для изготовления
Для сооружения генератора CO2 своими руками понадобится:
- Прозрачная пластиковая бутыль вместимостью 2 л – 1 шт.
- Пластиковая пустая бутылка с широким горлышком – 1 шт.
- Медицинский шприц – 1 шт.
- Трубочка от капельницы – 1 шт.
- Силикон.
- Клапан обратного давления – 1 шт.
- Шланг – 1 шт.
- Присоски для фиксации.
- Распылитель.
Сборка
Подготовив необходимые материалы, система CO2 для аквариума собирается следующим образом:
Из медицинского шприца убирают поршень и отрезают нижнюю часть, помещая в шприц клапан обратного давления.
Из крышечки от бутылки удаляют перегородки и лишние выступы, используя острый нож
Во время действия соблюдают осторожность, чтобы не пораниться.
Подготовленный шприц с клапаном соединяют с крышечкой при помощи аквариумного силикона. В получившуюся конструкцию наливают немного водички – устройство будет играть роль счетчика пузырьков CO2 своими руками.
Сделанный счетчик соединяют с большой пластиковой бутылкой.
В крышке второй бутылочки проделывают дырочки для переходника при помощи толстой иглы
Переходник от капельницы вставляют в крышку и подсоединяют шланг. Стыки промазывают силиконом.
Получившийся генератор CO2 наполняют жидкостью. Конструкции соединяют шлангами: от бутыли вместимостью 2 л кончик трубки прикрепляют к крышке клапана, от иголки – к искусственному водоему.

Составы для генератора
Собрав самодельный генератор для подачи CO2 в аквариум, следует заняться приготовлением раствора, который будет выделять углекислоту путем брожения. Существуют множество рецептов для выделения углекислого газа, однако самыми популярными и простыми считаются:
- С содой и кормом – для приготовления понадобится 200 г сахарного песка, щепоть соды, ½ чайной ложки корма для рыбок, дрожжи и кусочек хлеба. Ингредиенты засыпают в брагобутыль, и заливают смесь теплой водичкой, оставив пять см от крышки. После этого распылитель самодельного генератора опускают в резервуар и спустя 10 часов проверяют подачу углекислоты. Если CO2 не выделяется, то в конструкции остались негерметичные места. Смесь, изготовленная по этому рецепту, будет выделять CO2 в течение двух недель, после чего нужно приготовить свежий раствор.
- С крахмалом – аквариумисту понадобится 400 г сахарного песка, 140 г пищевой соды, 160 г крахмала и 1 л воды. Ингредиенты помещают в кастрюлю и варят до густой консистенции, после чего оставляют остывать. Остывшую смесь переливают в бутыль для брожения и помещают распылитель в водоем. Углекислый газ с использованием этой смеси будет выделяться 3 месяца.
- С содой и мукой – для приготовления нужны дрожжи (на кончике ножа), 100 г сахарного песка, 25 г муки и соды. Компоненты заливаются 500 мл воды, тщательно перемешиваются и наливаются в бутылочку для брожения. Срок действия – 14 дней.
- С желатином – состав будет действовать 30 дней. Для приготовления необходимо залить 30 г желатина 500 мл воды и оставить разбухать на полчаса. После истечения указанного времени в смесь добавляют еще столько же воды и 1 ст. ложку соды. Массу ставят на медленный огонь до полного растворения веществ. После этого смесь переливают в бутыль для брожения, добавляют сухие дрожи и закрывают крышкой.
- С лимонной кислотой – самый популярный рецепт состава. Подачу CO2 в аквариум лимонная кислота и сода подает на протяжении светового дня, и готовится очень просто: нужно смещать 10 г лимонной кислоты и столько же соды, перемешать и засыпать в увлажненную предварительно тару. Подача CO2 в аквариум лимонной кислотой и содой готова.

Применение в промышленности
Применение углекислого газа в различных областях промышленности связано с химическими и физическими свойствами вещества. Он не горит, не опасен в минимальных концентрациях для человека и животных и является основным компонентом для жизнедеятельности растений.

Химическая промышленность:
- Участвует в синтезе искусственных химикатов;
- Регулирует температуру в реакциях;
- Нейтрализует щелочи;
- Очищает ткани животных и растений;
- Может восстанавливаться до метана.
Металлургия:
- Осаждение отходящего дыма;
- Регулирует направления течения воды при отводе шахт;
- Некоторые лазеры используют CO2 в качестве источника энергии (неон).
Производство бумаги:
- Регулирует водородный показатель в древесной массе или целлюлозе;
- Усиливает в мощности производственные машины.
Особую роль в промышленной и смежных индустриях играет сухой лед. Он применяется как:
- Источник охлаждения в морозильных камерах при перевозках;
- Охлаждение при затвердевании сплавов;
- Очистка сухим льдом оборудования (криобластинг).
CO2 при ферментации сахара
В производстве алкогольных напитков и хлебобулочных изделий из дрожжевого теста, используется процесс ферментации сахаров — глюкозы, фруктозы, сахарозы и др., с образованием этилового спирта C2H5OH и диоксида углерода CO2. Например, реакция ферментации глюкозы C6H12O6 такова:
C6H12O6 → 2C2H5OH + 2CO2
А ферментации фруктозы C12H22O11 — выглядит вот так:
C12H22O11 + H2O → 4C2H5OH + 4CO2
 Оборудование для производства CO2 пр-ва компании Wittemann
Оборудование для производства CO2 пр-ва компании Wittemann
В производстве алкогольных напитков, получаемый алкоголь является желательным и даже, можно сказать, необходимым продуктом реакции брожения. Углекислый газ же иногда выпускается в атмосферу, а иногда оставляется в напитке для его газирования. В выпечке хлеба все происходит наоборот: CO2 нужен для образования пузырьков, вызывающих поднятие теста, а этиловый спирт почти полностью испаряется при выпечке.
Многие предприятия, прежде всего спиртозаводы, для которых CO2 является совсем уж ненужным побочным продуктом, наладили его сбор и продажу. Газ из бродильных чанов через спиртовые ловушки подается в углекислотный цех, где CO2 очищают, сжижают и разливают в баллоны. Собственно, именно спиртовые заводы являются во многих регионах основными поставщиками углекислоты — и для многих из них, продажа углекислоты является отнюдь не последним источником доходов.
Существует целая отрасль производства оборудования для выделения чистого углекислого газа на пивоваренных и спиртовых заводах (Huppmann/GEA Brewery, Wittemann и др.), а также его прямого производства из углеводородного топлива. Поставщики газов, такие как Air Products и Air Liquide, также осуществляют установку станций по выделению CO2 и его последующей очистке, сжижению у заправке в баллоны.
ученицей группы 1.3
ПОХОРУКОВОЙ ЮЛИЕЙ
ВВЕДЕНИЕ
2Цель работы2
- по информационным источникам изучено нахождение в природе углекислого газа, его физические и химические свойства;
- собран материал по влиянию углекислого газа на организм человека;
- изучены способы определения углекислого газа в воздухе;
- изготовлен анализатор углекислого газа;
- проверена достоверность результатов, получаемых при помощи изготовленного анализатора;
- предложены способы снижения концентрации углекислого газа в воздухе.
- НАХОЖДЕНИЕ УГЛЕКИСЛОГО ГАЗА В ПРИРОДЕ.
2углекислый газсухим льдом2 232223ангидридом23223 (осадок)2гидрокарбонатамикарбонатами
| Температура,C | 30 | 35 | 40 | 50 | 60 | 70 |
| Растворимость, см3/мл… | 0,664 | 0,595 | 0,533 | 0,438 | 0,365 | 0.319 |
- Горящая лучинка, помещенная в сосуд с углекислым газом, гаснет.
- Известковая вода мутнеет при пропускании через нее углекислого газа.
- ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ УГЛЕКИСЛОГО ГАЗА.
Получение. 323223222 жжёной известью, 32 Применение. карбогеном3432243 4333432322232322323232
- ВЛИЯНИЕ УГЛЕКИСЛОГО ГАЗА НА ОРГАНИЗМ ЧЕЛОВЕКА.
- СПОСОБЫ ОПРЕДЕЛЕНИЯ УГЛЕКИСЛОГО ГАЗА В ВОЗДУХЕ.
22223
- ИЗГОТОВЛЕНИЕ АНАЛИЗАТОРА УГЛЕКИСЛОГО ГАЗА
6.1 Принцип действия анализатора223 (осадок)23 (осадок)2326.2 Конструирование анализатораОпределение производительности компрессора.
Установка для определения производительности насоса приведена на рис.2
Таблица 1
| Номер опыта | Объем вытесненной воды, мл | Время вытеснения, мин | Средняя величина времени вытеснения, мин | Производительность насоса, л/мин |
| 1 | 400 | 0.29 | 0.30 | 1.3 |
| 2 | 400 | 0.31 |
Определение объемной доли углекислого газа (%)2 * m22 mmооо ,ооо2 2322
Для одного определения брали 50 мл насыщенного раствора гидроксида бария. Произведение растворимости Вa(OH)2 при температуре 20 С равно 0.005 г/л. По этой величине была определена растворимость гидроксида бария в условиях опыта, количество вещества Вa(OH)2 и количество углекислого газа в соответствии с уравнением, приведенным выше.
Определение времени, за которое происходит обесцвечивание фенолфталеина.2
| Объект исследования | Время, обесцвечивания фенолфталеина, мин. | |||
| 1–ый замер | 2-ой замер | 3-ий замер | Среднее | |
| Атмосферный воздух | 5.3 | 6.4 | 4.5 | 5.4 |
| Выдыхаемый воздух | 0.08 | 0.09 | 0.1 | 0.09 |
Определение концентрации углекислого газа в выдыхаемом воздухе.
- Был приготовлен сухой и чистый полиэтиленовый пакет;
- В пакет был сделан выдох, при этом он наполнился выдыхаемым газом;
- Пакет «герметизировался» рукой;
- Медицинским шприцом был отобран воздух из пакета и запущен в хроматограф;
- По окончании хроматографического процесса был рассчитан состав выдыхаемого воздуха.
| Кислород, % об. | Азот, % об. | Углекислый газ, % об. |
| 18.73 | 75.6 | 5.67 |
Расчет результатов анализа.
| Объемная доля углекислого газа, % об. | Время обесцвечивания, мин | Объемная доля углекислого газа, % об. | Время обесцвечивания, мин |
| 0.03 | 5.4 | 0.20 | 0.8 |
| 0.05 | 3.0 | 0.3 | 0.6 |
| 0.1 | 1.7 | 5.7 | 0.09 |
6.3 ОПРЕДЕЛЕНИЕ УГЛЕКИСЛОГО ГАЗА В ВОЗДУХЕ.
| Место отбора пробы | Время, обесцвечивания фенолфталеина, мин | Объемная доля углекислого газа, % об. |
| Кабинет 7 во время занятий | 0.20 | 1.6 |
| Кабинет 5 сразу после занятий | 0.70 | 0.22 |
| Коридор во время занятий | 1.0 | 0.14 |
| Место отбора пробы | Объемная доля углекислого газа, % об. | Объемная доля кислорода, % об. | Объемная доля азота, % об. |
| Кабинет 7 во время занятий | 2.2 | 20.15 | 77.65 |
| Кабинет 5 сразу после занятий | 0.28 | 20.51 | 79.21 |
| Коридор во время занятий | 0.21 | 19.82 | 79.97 |
- погрешность определения углекислого газа в воздухе двумя методами находится в допустимых пределах ( не превышает 50%);
- анализатор позволяет определять концентрации углекислого газа в довольно широких диапазонах;
- анализатор может использоваться для экспрессной оценки сордержания углекислого газа в воздухе.
РЕФЕРАТ
Цель работы:2задачи.2 2
Определение производительностимикрокомпрессора Рис.2.
КРУГОВОРОТ УГЛЕРОДА В ПРИРОДЕ
CУглекислый газ промышл.предприятий, машин сжига-ющих топливо, выделяемый животными и людьми. Воды озёр, рек, морей и океанов.Подземные воды Ca(HCO3) CaCO3Торф, бурый уголь, Каменный уголь.Извержение вулкановРастение.Животные(навоз).O2ЗАКЛЮЧЕНИЕВа(ОН)222СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
Получение в промышленности
Получение диоксида углерода в промышленности методологически разнообразно. Он находится в дымовых отходах, выпускаемых в атмосферу ТЭЦ и электростанциями, получается при брожении спирта и выступает как продукт реакции с природными карбонатами.

Индустрия получения двуокиси углерода широка. Газ можно абсорбировать несколькими способами из одного источника. Во всех случаях это поэтапный процесс очистки от примесей (для достижения требований ГОСТа) и достижения нужной консистенции, агрегатного состояния.
Получение газообразной двуокиси углерода
Газообразный CO2 извлекают из промышленных (нефтяных) дымов путем адсорбции моноэтаноламина (коммерчески выгодно) и карбонатом калия (редко). Принцип сбора частиц углерода одинаков для обоих веществ. Они направляются по трубопроводу к отходам и собирают в себя углекислый газ. После сбора, насыщенные углекислотой газы направляются на очистку.
В специальных емкостях происходит реакция в при повышенной температуре или заниженном давлении. В процессе высвобождается чистая углекислота и продукты распада (аммиак и другие).
 Установка добычи углекислоты
Установка добычи углекислоты
Схематически процесс выглядит так:
- Отходящий дым смешивается с адсорбентами (газообразным карбонатом калия или моноэтаноламином);
- Накопившие в себе двуокись углерода газы поступают в специальный газгольдер для очистки;
- В реакции с высокой температурой или низким давлением происходит отделение углекислого газа от адсорбента.
В лаборатории извлечь много CO2 не получается. Но это возможно в реакции с гидрокарбонатами и кислотами. В отдельности CO2 можно выделить на промышленных станках для получения кислорода, аргона или азота. Углекислый газ здесь выступает как побочный продукт. Хранится он в специальных баллонах, поставляемых потребителю.
Получение жидкой углекислоты
Добыча жидкой углекислоты поэтапно связана с получением ее из газа. Из летучего газообразного состояния, при обработке водородом, раствором перманганата калия и углем, образуется жидкая двуокись.
Сжижение происходит из-за низкого давления, сопровождающего реакцию. После многоступенчатой очистки, жидкий диоксид углерода попадает в компрессор. Там он сжимается и подается для сушки в 2 адсорбера, поочередно перенимающие работу для восстановления. Параллельно сжатая жидкость очищается от запахов и переводится в конденсатор, а оттуда – на хранение.
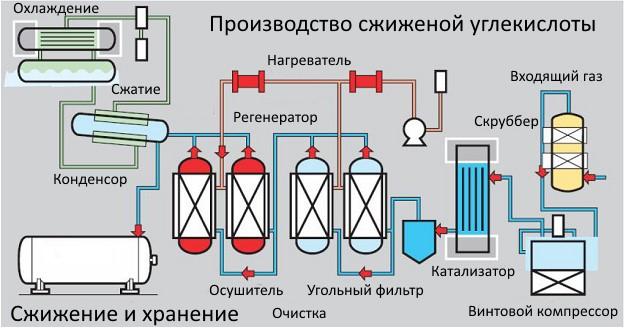
Этот метод сжижения применяется для газов спиртового брожения. Он актуален для пропана, бутана и т.д. Его используют на крупных пивоварнях, а получаемая очищенная углекислота имеет высокие показатели качества.
Получение твердого диоксида углерода
Твердый диоксид образуют из жидкого путем обработки низкой температурой (-56°). В промышленных условиях только 20% переходят в твердое состояние, а остальные – испаряются.
 Сухой лед
Сухой лед
Порядок извлечения углекислотных кристаллов (сухого льда):
- Из емкости брожения газ переходит в емкость для промывки;
- В газгольдере после мытья он сжимается и сжижается;
- Многократно сжимаясь и нагреваясь, газообразный углерод охлаждается в специальных холодильниках;
- Жидкость очищается активированным углем;
- Поступает в холодильник, где охлаждается и дополнительно очищается от примесей;
- Охлажденный CO2 направляется на испарение и пресс, где комплектуется сухой лед.
Похожие:
| Экологического состояния озер островаРабота выполнена мною, ученицей 4 класса школы №3 поселка Умба Мурманской области Юлией Хреновой на острове Лодейном. Этот остров… | Уроку «Планеты гиганты»На Земле 78% азота и 21% кислорода. На Венере 96,5% углекислого газа. На Марсе 95% углекислого газа | ||
| Работа по дисциплине теплотехника… | Исследовательская работа Выполнена ученицей 9 «а» классаМежрегиональная учебно-исследовательская конференция старшеклассников «Ломоносовские чтения» | ||
| Колебания крыла в сверхзвуковом потоке газа 01. 02. 05 Механика жидкости, газа и плазмы… | Курсовая работа Определение эйлерова пути на Прологе Халипский Сергей Николаевич Специальность: 230105Ваша курсовая работа обладает недостатком, что не позволяет считать ее выполненной | ||
| Исследовательская работа Работа выполнена ученицей 9 «а» класса моу «сош №2 с углубленным изучением математики» г. КаргополяЯ выбрала тему «Яблони Каргопольского района», так как меня заинтересовало, что и у нас на севере растут эти удивительные деревья…. | Краткое содержание работы… | ||
| Курсовая работа студента 345 группы | Курсовая работа студентки 245 группы |
ru.convdocs.org
Получение
В промышленных количествах углекислота выделяется из дымовых газов, или как побочный продукт химических процессов, например, при разложении природных карбонатов (известняк, доломит) или при производстве алкоголя (спиртовое брожение). Смесь полученных газов промывают раствором карбоната калия, которые поглощают углекислый газ, переходя в гидрокарбонат. Раствор гидрокарбоната при нагревании или при пониженном давлении разлагается, высвобождая углекислоту. В современных установках получения углекислого газа вместо гидрокарбоната чаще применяется водный раствор моноэтаноламина, который при определённых условиях способен абсорбировать CO2{\displaystyle {\ce {CO2}}}, содержащийся в дымовом газе, а при нагреве отдавать его; таким образом отделяется готовый продукт от других веществ.
Также углекислый газ получают на установках разделения воздуха как побочный продукт получения чистого кислорода, азота и аргона.

Аппарат Киппа
В лабораторных условиях небольшие количества получают взаимодействием карбонатов и гидрокарбонатов с кислотами, например мрамора, мела или соды с соляной кислотой, используя, например, аппарат Киппа:
- CaCO3+2HCl⟶CaCl2+H2O+CO2↑{\displaystyle {\ce {CaCO3 + 2HCl -> CaCl2 + H2O + CO2 ^}}}.
Использование реакции серной кислоты с мелом или мрамором приводит к образованию малорастворимого сульфата кальция, который замедляет реакцию, и который удаляется значительным избытком кислоты с образованием кислого сульфата кальция.
Для приготовления сухих напитков может быть использована реакция пищевой соды с лимонной кислотой или с кислым лимонным соком. Именно в таком виде появились первые газированные напитки. Их изготовлением и продажей занимались аптекари.
Также для получения углекислого газа применяется зкзотермическая реакция горения углерода в кислороде:
- C+O2⟶CO2↑+394kJ{\displaystyle {\ce {C + O2 -> CO2 ^ + 394 kJ}}}.
Химическая формула и способ получения углекислого газа
Углекислый газ, или двуокись углерода, имеет химическую формулу CO2. Структура молекулы несколько отличается от структуры CO. В данном образовании углерод имеет степень окисления, равную +4. Структура молекулы линейная, а значит, неполярная. Молекула CO2 не обладает такой сильной прочностью, как CO. В земной атмосфере содержится около 0,03% углекислоты по общему объему. Увеличение этого показателя разрушает озоновый слой Земли. В науке это явление называется парниковым эффектом.
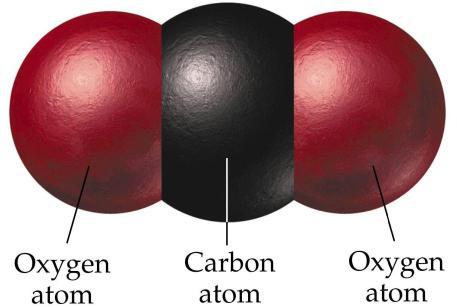
Получить углекислый газ можно различными путями. В промышленности он образуется в результате горения дымовых газов. Может быть побочным продуктом в процессе изготовления алкоголя. Его можно получить в процессе разложения воздуха на основные составляющие, такие как азот, кислород, аргон и другие. В лабораторных условиях оксид углерода (4) можно получить в процессе обжига известняка, а в домашних условиях добыть углекислый газ можно при помощи реакции лимонной кислоты и пищевой соды. Кстати, именно таким образом изготавливались газированные напитки в самом начале их производства.
Взаимодействие с другими веществами:
1) Углекислота относится к кислотным оксидам, то есть в сочетании с водой образуется кислота. Однако угольная кислота неустойчива и распадается сразу. Эта реакция имеет обратимый характер:
Диоксид углерода + вода угольная кислота
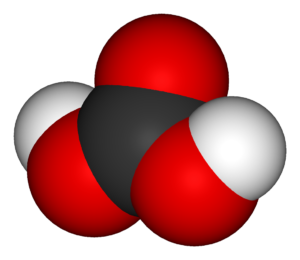 Молекула угольной кислоты
Молекула угольной кислоты
2) При взаимодействии углекислого газа и соединений азота с водородом (аммиаком) в водном растворе происходит разложение до углеаммонийной соли.
Аммиак + углекислота = гидрокарбонат аммония
 Углеаммонийная соль
Углеаммонийная соль
Полученное вещество часто используется в приготовлении хлеба и различных кондитерских изделий.
3) Ход некоторых реакций должен поддерживаться высокими температурами. Примером является производство мочевины при 130 °C и давлении 200 атм., схематически изображаемое так:
Аммиак + диоксид углерода → карбамид + вода
Также под воздействием температуры около 800 градусов протекает реакция образования оксида цинка:
 Оксид цинка
Оксид цинка
Цинк + двуокись углерода → оксид цинка + оксид углерода
4) Возможно уравнение с гидроксидом бария, при котором выделяется средняя соль.
Гидроксид бария + углекислота = карбонат бария + оксид водорода.
Применяется для регулировки калориметров по теплоемкости. Также вещество используют в промышленности для производства красных кирпичей, синтетических тканей, фейерверков, гончарных изделий, плитки для ванн и туалетов.
5) Углекислый газ выделяется при реакциях горения.
Горение метана.
 Горение газа на плите
Горение газа на плите
Метан + кислород = углекислота + вода (в газообразном состоянии) + энергия
Горение этилена
Этилен + кислород = диоксид углерода + оксид водорода + энергия
Горение этана
Этан + кислород = двуокись углерода + вода + энергия
Горение этанола
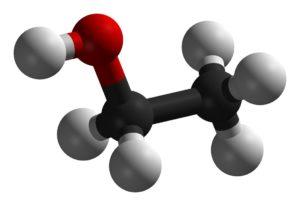 Молекула этанола
Молекула этанола
Этанол + кислород = вода + углекислота + энергия
6) Газ не поддерживает горения, этот процесс возможен только с некоторыми активными металлами, например, магнием.
Магний + углекислота = углерод + оксид магния.
MgO активно применяется при производстве косметических средств. Вещество используют в пищевой промышленности как пищевую добавку.
7) Двуокись углерода реагирует с гидроксидами с получением солей, которые существуют в двух формах, как карбонаты и бикарбонаты. Например, углекислый газ и гидроксид натрия, согласно формуле, образуют гидрокарбонат Na:
диоксид углерода + гидроксид натрия → гидрокарбонат натрия.
Или же при большем количестве NaOH образуется карбонат Na с образованием воды:
Диоксид углерода + гидроксид натрия → карбонат натрия + вода
Кислотно-щелочные реакции углекислоты используются на протяжении веков для затвердевания известкового раствора, что может быть выражено простым уравнением:
Гидроксид кальция + двуокись углерода → карбонат кальция + оксид водорода
8) В зелёных растениях играет важную роль в процессе фотосинтеза:
Образование глюкозы
Диоксид углерода + вода → глюкоза + кислород.
9) Химические свойства углекислоты используются в промышленности при производстве соды, суть этого процесса можно выразить суммарным уравнением:
Хлорид натрия + Диоксид углерода + аммиак + вода → гидрокарбонат натрия + хлорид аммония
10) Фенолят Na разлагается при взаимодействии с углекислым газом, при этом малорастворимый фенол выпадает в осадок:
Фенолят натрия + двуокись углерода + оксид водорода = фенол + гидрокарбонат натрия
11) Пероксид натрия и углекислый газ, взаимодействуя, образуют среднюю соль карбоната Na с выделением кислорода.
Пероксид натрия + углекислота → карбонат натрия + кислород
Колба с пероксидом натрия
Образование углекислоты происходит при растворении в воде кальцинированной соды (стиральной соды).
Гидрокарбонат натрия + вода → углекислота + вода + гидроксид натрия
При этой реакции (гидролиз по катиону) образуется сильнощелочная среда.
12) CO2 вступает в реакцию с гидроксидом калия, последний образуется путем электролиза хлористого калия.
Гидроксид калия + углекислота → карбонат калия + вода
13) Газ в силу своего строения не реагирует с благородными газами, то есть гелием, неоном, аргоном, криптоном, ксеноном, радоном, оганесоном.
Применение
В пищевой промышленности углекислота используется как консервант и разрыхлитель, обозначается на упаковке кодом Е290.
В криохирургии используется как одно из основных веществ для криоабляции новообразований.
Жидкая углекислота широко применяется в системах пожаротушения и в огнетушителях. Автоматические углекислотные установки для пожаротушения различаются по системам пуска, которые бывают пневматическими, механическими или электрическими.
Устройство для подачи углекислого газа в аквариум может включать в себя резервуар с газом. Простейший и наиболее распространённый метод получения углекислого газа основан на конструкции для изготовления алкогольного напитка браги. При брожении выделяемый углекислый газ вполне может обеспечить подкормку аквариумных растений.
Углекислый газ используется для газирования лимонада, газированной воды и других напитков. Углекислый газ используется также в качестве защитной среды при сварке проволокой, но при высоких температурах происходит его распад с выделением кислорода. Выделяющийся кислород окисляет металл. В связи с этим приходится в сварочную проволоку вводить раскислители, такие как марганец и кремний. Другим следствием влияния кислорода, также связанного с окислением, является резкое снижение поверхностного натяжения, что приводит, среди прочего, к более интенсивному разбрызгиванию металла, чем при сварке в инертной среде.
Углекислота в баллончиках применяется в пневматическом оружии (в газобаллонной пневматике) и в качестве источника энергии для двигателей в авиамоделировании.
Хранение углекислоты в стальном баллоне в сжиженном состоянии выгоднее, чем в виде газа. Углекислота имеет сравнительно низкую критическую температуру +31 °С. В стандартный 40-литровый баллон заливают около 20 кг сжиженного углекислого газа, и при комнатной температуре в баллоне будет находиться жидкая фаза, а давление составит примерно 6 МПа (60 кгс/см²). Если температура будет выше +31 °С, то углекислота перейдёт в сверхкритическое состояние с давлением выше 7,36 МПа. Стандартное рабочее давление для обычного 40-литрового баллона составляет 15 МПа (150 кгс/см²), однако он должен безопасно выдерживать давление в 1,5 раза выше, то есть 22,5 МПа, — таким образом, работа с подобными баллонами может считаться вполне безопасной.
Твёрдая углекислота — «сухой лёд» — используется в качестве хладагента в лабораторных исследованиях, в розничной торговле, при ремонте оборудования (например: охлаждение одной из сопрягаемых деталей при их посадке внатяжку) и так далее. Для сжижения углекислого газа и получения сухого льда применяются углекислотные установки.