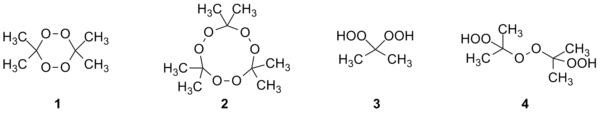Перекись водорода н2о2
Содержание:
Способы получения и собирания кислорода в лаборатории
Лабораторные способы получения кислорода весьма разнообразны. Существует много веществ, из которых можно получить кислород. Рассмотрим наиболее распространенные способы.
1) Разложение оксида ртути (II)
Одним из способов получения кислорода в лаборатории, является его получение по описанной выше реакции разложения оксида ртути (II). Ввиду высокой токсичности соединений ртути и паров самой ртути, данный способ используется крайне редко.
2) Разложение перманганата калия
Перманганат калия (в быту мы называем его марганцовкой) – кристаллическое вещество темно-фиолетового цвета. При нагревании перманганата калия выделяется кислород. В пробирку насыплем немного порошка перманганата калия и закрепим ее горизонтально в лапке штатива. Недалеко от отверстия пробирки поместим кусочек ваты. Закроем пробирку пробкой, в которую вставлена газоотводная трубка, конец которой опустим в сосуд- приемник. Газоотводная трубка должна доходить до дна сосуда-приемника. Ватка, находящаяся около отверстия пробирки нужна, чтобы предотвратить попадание частиц перманганата калия в сосуд-приемник (при разложении выделяющийся кислород увлекает за собой частички перманганата). Когда прибор собран, начинаем нагревание пробирки. Начинается выделение кислорода.
Уравнение реакции разложения перманганата калия:
Как обнаружить присутствие кислорода? Воспользуемся способом Пристли. Подожжем деревянную лучину, дадим ей немного погореть, затем погасим, так, чтобы она едва тлела. Опустим тлеющую лучину в сосуд с кислородом. Лучина ярко вспыхивает! Газоотводная трубка была не случайно опущена до дна сосуда-приемника. Кислород тяжелее воздуха, следовательно, он будет собираться в нижней части приемника, вытесняя из него воздух. Кислород можно собрать и методом вытеснения воды. Для этого газоотводную трубку необходимо опустить в пробирку, заполненную водой, и опущенную в кристаллизатор с водой вниз отверстием. При поступлении кислорода газ вытесняет воду из пробирки.
Разложение пероксида водорода
Пероксид водорода – вещество всем известное. В аптеке оно продается под названием «перекись водорода». Данное название является устаревшим, более правильно использовать термин «пероксид». Химическая формула пероксида водорода Н2О2 Пероксид водорода при хранении медленно разлагается на воду и кислород. Чтобы ускорить процесс разложения можно произвести нагрев или применить катализатор.
Катализатор – вещество, ускоряющее скорость протекания химической реакции
Нальем в колбу пероксид водорода, внесем в жидкость катализатор. Катализатором может служить порошок черного цвета – оксид марганца MnO2. Тотчас смесь начнет вспениваться вследствие выделения большого количества кислорода. Внесем в колбу тлеющую лучину – она ярко вспыхивает. Уравнение реакции разложения пероксида водорода:
Обратите внимание: катализатор, ускоряющий протекание реакции, записывается над стрелкой, или знаком «=», потому что он не расходуется в ходе реакции, а только ускоряет ее
Разложение хлората калия
Хлорат калия – кристаллическое вещество белого цвета. Используется в производстве фейерверков и других различных пиротехнических изделий. Встречается тривиальное название этого вещества – «бертолетова соль». Такое название вещество получило в честь французского химика, впервые синтезировавшего его, – Клода Луи Бертолле. Химическая формула хлората калия KСlO3. При нагревании хлората калия в присутствии катализатора – оксида марганца MnO2, бертолетова соль разлагается по следующей схеме:
Разложение нитратов
Нитраты – вещества, содержащие в своем составе ионы NO3⎺. Соединения данного класса используются в качестве минеральных удобрений, входят в состав пиротехнических изделий.
Нитраты – соединения термически нестойкие, и при нагревании разлагаются с выделением кислорода:
Обратите внимание, что все рассмотренные способы получения кислорода схожи. Во всех случаях кислород выделяется при разложении более сложных веществ
Реакция разложения – реакция, в результате которой сложные вещества разлагаются на более простые В общем виде реакцию разложения можно описать буквенной схемой:
Реакции разложения могут протекать при действии различных факторов. Это может быть нагревание, действие электрического тока, применение катализатора. Существуют реакции, в которых вещества разлагаются самопроизвольно.
Свойства
Пероксиды легко выделяют кислород. Для неорганических веществ рекомендуется использовать термин пероксид, для органических веществ и сегодня в русском языке часто используют термин перекись. Пероксиды многих органических веществ взрывоопасны (пероксид ацетона), в частности, они легко образуются фотохимически при длительном освещении эфиров в присутствии кислорода. Поэтому перед перегонкой многие эфиры (диэтиловый эфир, тетрагидрофуран) требуют проверки на отсутствие пероксидов.
Пероксиды замедляют синтез белка в клетке.
В зависимости от структуры различают собственно пероксиды, надпероксиды, неорганические озониды.
Пероксиды (перекиси)
Пероксиды — вещества, содержащие пероксогруппу —О—О— (например, пероксид водорода Н2О2, пероксид натрия Na2O2). В пероксидах кислород имеет степень окисления −1. Существуют неорганические и органические пероксиды.
Неорганические пероксиды в виде бинарных или комплексных соединений известны почти для всех элементов. Пероксиды щелочных и щелочноземельных металлов реагируют с водой, образуя соответствующий гидроксид и пероксид водорода.
Органические пероксиды подразделяются на диалкилпероксиды, алкилгидропероксиды, диацилпероксиды, ацилгидропероксиды (пероксокарбоновые кислоты), циклические пероксиды. Органические пероксиды термически неустойчивы и часто взрывоопасны. Используются как источники свободных радикалов в органическом синтезе и промышленности (ди-трет-бутилпероксид, диацетилпероксид), окисляющие антисептики (пероксид бензоила).
Химические свойства
Оба атома кислорода находятся в промежуточной степени окисления −1, что и обусловливает способность пероксидов выступать как в роли окислителей, так и восстановителей. Наиболее характерны для них окислительные свойства:
-
- Na2SO3+H2O2→Na2SO4+H2O{\displaystyle {\mathsf {Na_{2}SO_{3}+H_{2}O_{2}\rightarrow Na_{2}SO_{4}+H_{2}O}}}
- Mn(OH)2+H2O2→MnO(OH)2+H2O{\displaystyle {\mathsf {Mn(OH)_{2}+H_{2}O_{2}\rightarrow MnO(OH)_{2}+H_{2}O}}}
При взаимодействии с сильными окислителями пероксид водорода выступает в роли восстановителя, окисляясь до атомарного кислорода:
-
- 2AgNO3+H2O2→2Ag+2O+2HNO3{\displaystyle {\mathsf {2AgNO_{3}+H_{2}O_{2}\rightarrow 2Ag+2O+2HNO_{3}}}}
Молекула пероксида водорода сильно полярна, что приводит к возникновению водородных связей между молекулами. Связь O—O непрочна, поэтому H2O2 — неустойчивое соединение, легко разлагается. Также этому может поспособствовать присутствие ионов переходных металлов. В разбавленных растворах пероксид водорода тоже неустойчив и самопроизвольно диспропорционирует на H2O и O. Реакция диспропорционирования катализируется ионами переходных металлов, некоторыми белками:
-
- 2H2O2→2H2O+O2{\displaystyle {\mathsf {2H_{2}O_{2}\rightarrow 2H_{2}O+O_{2}}}}
Однако очень чистый пероксид водорода вполне устойчив.
Пероксид водорода проявляет слабые кислотные свойства (К = 1,4·10−12), и поэтому диссоциирует по двум ступеням:
-
- H2O2⇄H++HO2−; HO2−⇄H++O22−{\displaystyle {\mathsf {H_{2}O_{2}\rightleftarrows H^{+}+HO_{2}^{-};~~~~~~HO_{2}^{-}\rightleftarrows H^{+}+O_{2}^{2-}}}}
При действии концентрированного раствора Н2O2 на некоторые гидроксиды в ряде случаев можно выделить пероксиды металлов, которые можно рассматривать как соли пероксида водорода (Li2O2, MgO2 и др.):
-
- H2O2+2NaOH→Na2O2+2H2O{\displaystyle {\mathsf {H_{2}O_{2}+2NaOH\rightarrow Na_{2}O_{2}+2H_{2}O}}}
- H2O2+Ba(OH)2→BaO2↓+2H2O{\displaystyle {\mathsf {H_{2}O_{2}+Ba(OH)_{2}\rightarrow BaO_{2}\downarrow +2H_{2}O}}}
Пероксид водорода может проявлять как окислительные, так и восстановительные свойства. Например, при взаимодействии с оксидом серебра он является восстановителем:
- H2O−12+Ag2O⟶2Ag+O2+H2O{\displaystyle {\mathsf {H_{2}{\stackrel {-1}{O}}_{2}+Ag_{2}O\longrightarrow 2Ag+{\stackrel {0}{O}}_{2}+H_{2}O}}}
В реакции с нитритом калия соединение служит окислителем:
- KNO2+H2O−12⟶KNO−23+H2O{\displaystyle {\mathsf {KNO_{2}+H_{2}{\stackrel {-1}{O}}_{2}\longrightarrow KN{\stackrel {-2}{O}}_{3}+H_{2}O}}}
Пероксидная группа входит в состав многих веществ. Такие вещества называют пероксидами, или пероксидными соединениями. К ним относятся пероксиды металлов (Na2O2, BaO2 и др.). Кислоты, содержащие пероксидную группу, называют пероксокислотами, например, пероксомонофосфорная H3PO5, пероксодисерная H2S2O8 и пероксоазотная HNO4 кислоты.
История
Первые эксперименты по получению пероксидов ацетона были проведены Вольфенштейном в 1895 году, когда он изучал действие пероксида водорода на кониин в ацетоновом растворе, полагая, что ацетон и пероксид водорода не взаимодействуют. Вольфенштейн обнаружил, что из смеси равных объёмов ацетона и 10%-го пероксида водорода выпадают кристаллы, которые он охарактеризовал как тримерный пероксид ацетона (триперекись ацетона 2). Также он заметил, что реакция происходит быстрее при добавлении малых количеств фосфорной кислоты.
В 1899 году Адольф Байер и Виктор Виллигер синтезировали также димерный пероксид ацетона (диперекись ацетона 1). В 1933 году Лекок наблюдал процесс деполимеризации трипероксида ацетона при определении его молекулярной массы методом криоскопии, а также при плавлении. В 1947 году изучалось влияние кислот на образование пероксидов ацетона, в частности, было замечено, что серная, соляная, фосфорная и азотная кислоты значительно ускоряют окисление ацетона пероксидом водорода, а в присутствии органических кислот (уксусной, бензойной) образования продукта не происходит.
К настоящему времени получены пероксиды ацетона четырёх структур.
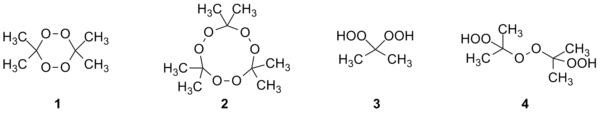
Применение перекиси водорода

Сегодня Н202 — перекись водорода — пользуется большим успехом. В медицинской практике используют различные препараты Н202, и все их без труда можно купить в аптеке.
Механизм действия связан с тем, что при контакте с тканями под влиянием содержащегося в них фермента каталазы перекись водорода быстро разлагается с выделением молекулярного кислорода, окисляющего органические компоненты различных клеток. За счет пенообразования растворы перекиси водорода оказывают местное кровоостанавливающее действие при капиллярных кровотечениях.
Энергичное выделение кислорода при разложении Н202 сопровождается вспениванием ее растворов. Надо заметить, что именно пена способствует механическому очищению поврежденных поверхностей, так как из ран с пеной удаляются микроорганизмы, частицы некротизированных (омертвевших) тканей, гнойные выделения и т. п.
Широко известны книги ученого и практикующего врача доктор медицины Уильяма Дугласа «Целительные свойства перекиси водорода» и «Новое о перекиси водорода», где он утверждает, что при правильном использовании средство насыщает организм человека кислородом, регулирует обменные процессы, оказывает терапевтический эффект, может излечивать от вирусных, бактериальных и грибковых инфекций изнутри, в том числе и от:
- Онкологии.
- Сахарного диабета.
- Гипертонии.
- СПИДА.
- Гангрены.
- Атеросклероза.
- Эмфиземы.
- Рассеянного склероза.
Список болезней, при которых помогает перекись, можно продолжать долго: в нем есть практически все сегодня существующие заболевания, в том числе такие «простые» патологии, как вирусные простуды, грипп, депрессии.
Научно доказано, что перекись обладает сильными окислительными, а также восстановительными свойствами, окисляет нитраты и нитриты, выделяет йод, расщепляет ненасыщенные соединения.
Эта жидкость может запускать процесс повреждения инородной для организма клетки от окисления, а при вступлении в окислительно-восстановительные реакции с некоторыми ферментами играет защитную роль, выступая как бактерицидный агент.
Получение перекись водорода
Чистая H2O2 — вязкая бесцветная жидкость с плотностью 1440 кг/ м³ и температурой плавления и кипения — 0,46 и 151,4°C .
В отличие от воды , перекись водорода — непрочное соединение . Она разлагается даже при комнатной температуре и очень легко при освещении или соприкосновении с некоторыми катализаторами ( MnO2 , PbO2 и другие ) Происходит следующая реакция :
H2O2 = H2O + O
В разбавленном водном растворе перекись водорода значительно устойчивее . Малая устойчивость молекул H2O2 обусловливается непрочностью связи O — O . Перекись водорода смешивается с водой в любых соотношениях . Хранят её в посуде из тёмного стекла и прохладном месте . При действии на кожу концентрированных растворов перекиси водорода образуются ожоги , причем обожженное место белеет .
Окислительная способность перекиси также обусловливается непрочность связи O — O . Например , йод — крахмальная бумага , содержащая KI и крахмал , при смачивании H2O2 синеет в присутствии выделяемого йода :
2KI + H2O2 = I2 + 2KOH
Таким образом перекись водорода является окислителем по отношению к I . Перекись может выступать и как восстановитель , но только при взаимодействии с сильными окислителями :
Cl2 + H2O2 = 2HCl + O2
Перекись обладает слабыми кислотными свойствами . Это подтверждается её взаимодействием со щелочью :
Ba( OH ) + H2O2 = 2H2O + BaO2
перекись бария
Соединение BaO2 — соль перекиси водорода , а не окись бария ( IV ) .
Сопоставим аналогичное по составу кислородные соединения SnO2 и Bao2 , они различаются своим отношением к кислотам , которые из солей перекиси водорода вытесняют перекись водорода :
BaO2 + H2SO4 = BaSO4 + H2O2
SnO2 + 2H2SO4 = Sn( SO4 )2 + 2H2O
Перекись водорода получают электролизом растворов серной кислоты . Концентрированный водный раствор H2O2 фракционированной перегонкой под вакуумом ( вод испаряется легче чем H2O2 ) , так же перекись можно получить из перекиси бария BaO2 действием на неё разбавленной серной кислоты или углекислым газом под давлением :
BaO2 + CO2 + H2O = BaCO3 + H2O2
Перекись водорода широко используют в качестве окислителя , например , для отбеливания тканей и других материалов . Разрушая красящие вещества , она почти не затрагивает отбеливаемый материал .
Концентрированная 85 — 95% H2O2 в смеси с некоторыми горючими материалами используют для получения взрывчатых соединений .
Как окислитель чистая перекись применяют в ракетной и реактивной технике , 3 % раствор используют в медицине как дезинфицирующее средство для промывания ран , полоскания горла и так далее .
Вы читаете, статья на тему перекись водорода
Виды перекиси водорода
Раствор перекиси водорода разведенный
Solutio Hydrogenii peroxydi diluta — официнальный раствор, содержащий в каждых 100 мл 10 г пергидроля, 0,05 г стабилизатора, до 100 мл воды. Содержание перекиси водорода в растворе — около 3%. Это бесцветная, прозрачная жидкость без запаха или со слабым своеобразным запахом, слабокислой реакцией.

Быстро разлагается с выделением кислорода на свету, при нагревании, соприкосновении с окисляющими и восстанавливающими веществами, щелочами, некоторыми металлами (железом, марганцем и др.).
Традиционно Н202 назначают наружно, в основном для промывания ран, а также при гинекологических заболеваниях; эффективна перекись водорода для полосканий при ангине, стоматите; как местное кровоостанавливающее средство рекомендуют для остановки капиллярных кровотечений, например, носовых.
Согласно инструкциям и указаниям, если в рецепте врача написано Solutio Hydrogenii peroxydi и не указана концентрация, то в аптеке отпускают раствор перекиси водорода в концентрации 3%. Если же в рецепте прописан не 3%-ный раствор перекиси, а другой концентрации, то его изготовляют разведением пергидроля или официального раствора перекиси водорода водой, исходя при этом из фактического содержания перекиси водорода в исходном препарате.
Раствор перекиси водорода концентрированный

Solutio Hydrogenii peroxydi concetrata— раствор, содержащий 27,5 — 31% перекиси водорода, имеет и другие названия: пергидроль, Нурегоl, Lapyrol, Регhydrolum. Это прозрачная бесцветная жидкость без запаха или со слабым своеобразным запахом, слабокислой реакции. Медленно разлагается при взаимодействии со щелочами и органическими веществами.
В чистом виде, а также в составе мазей используется традиционно в качестве де-пигментирующего средства, в смеси с моющими средствами — для дезинфекции и обеззараживания помещений, для получения растворов, применяемых в качестве антисептических средств.
Гидроперит
Hydroperytum — комплексное соединение перекиси водорода с мочевиной, содержит около 35% Н202. Этот препарат имеет и другое название — Perhydrit, но оно встречается редко. Выпускается гидроперит в виде таблеток белого цвета, легко растворимых в воде; водные растворы имеют солоновато-горький вкус.

Традиционно этот препарат используется как антисептическое средство вместо растворов Н202. Перед употреблением таблетки растворяют в воде из расчета 1 таблетка массой 1,5 г на 15 мл воды (приблизительно 1 столовая ложка).
Это соответствует 3%-му раствору перекиси водорода. Для полоскания рта и горла обычно врачи рекомендуют 1 таблетку растворить в стакане теплой воды, что соответствует 0,25%-му раствору Н202. Надо уточнить, что противомикробное действие Н202 непродолжительно по времени, так как выделение кислорода из ее растворов происходит очень быстро.
Разложение — перекись — водород
Разложение перекиси водорода легко протекает на многочисленных твердых поверхностях в водных растворах при температурах, близких к комнатной. Поэтому она особенно удобна для проверки представлений о роли примесной проводимости и уровня Ферми в подборе катализаторов. В работе Клоппа и Парравано , наоборот, дырочные образцы InSb, GaSb и Bi имели меньшую энергию активации, чем электронные. Поэтому выводы о связи скорости реакции с положением уровня Ферми, сделанные авторами, кажутся мало убедительными.
Разложение перекиси водорода в присутствии РЬа, по-видимому, идет путем переноса электронов от двухвалентного свинца к перекиси с образованием ионов четырехвалентного свинца и сопровождается разрывом кислородного мостика.
Разложение перекиси водорода в присутствии ионов меди и производных пролина.
Разложение перекиси водорода может иногда носить характер взрыва. Поэтому отгонку воды при получении препарата высокой концентрации необходимо вести в приборах на шлифах в условиях совершенной чистоты и при точной нейтрализации исходных реагентов. Работу следует проводить в защитных очках и перчатках.
|
Состав и температура парогаза, получаемого при разложении перекиси водорода различной концентрации. |
Разложение перекиси водорода под действием различных катализаторов протекает достаточно мягко и с большой скоростью.
|
Свойства 100 % — иой перекиси водорода. |
Разложение перекиси водорода происходит в присутствии катализаторов с большой скоростью.
Разложение перекиси водорода в паровой фазе впервые исследовано в 1923 г. Хаузером 11 ], который наблюдал это разложение на ряде поверхностей различного типа, а также Хиншелвудом и Причардом 12 ], сообщившими на основании краткого исследования, что разложение в стеклянных сосудах при 76 представляет собой поверхностную реакцию первого порядка. В 1927 г. Элдер и Ридл 13 ] сообщили, что в кварцевом сосуде реакция прекращается после разложения примерно 20 % всех паров перекиси водорода; если же этот сосуд нагревать примерно до 300 — 400, происходит полное разложение. Однако Кистяковский и Розенберг в 1937 г. констатировали полное разложение пара перекиси водорода на кварце, после чего не появлялось никаких сообщений о наблюдениях, подтверждающих внезапное прекращение реакции до полного ее окончания. Жигер высказал правдоподобное объяснение, что Элдер и Ридл в действительности измеряли разложение пара в соединительных трубках, ведущих к сосуду, тогда как фактическая скорость реакции в самом кварцевом сосуде была ничтожно малой.
Разложение перекиси водорода в присутствии гетерогенных железных ката лизаторов еще не настолько изучено, чтобы можно было в достаточной мере выяснить его механизм. Гидрат окиси железа является активным катализатором ; на стр.
Разложение перекиси водорода при обыкновенной температуре происходит медленно.
Разложение перекиси водорода
Разложение перекиси водорода ускоряется катализаторами. Если, например, в раствор перекиси водорода бросить немного диоксида марганца МпО2, то происходит бурная реакция и выделяется кислород. К катализаторам, способствующим разложению перекиси водорода, принадлежат медь, железо, марганец, а также ионы этих металлов.
Разложение перекиси водорода , которое можно рассматривать как самоокисление, наиболее быстро происходит в щелочном растворе, следовательно, в случае необходимости избыток Н2О2 лучше всего разрушать нагреванием в щелочном растворе.
Разложение перекиси водорода ускоряется катализаторами. Если, например, в раствор перекиси водорода бросить немного диоксида марганца МпОа, то происходит бурная реакция и выделяется кислород. К катализаторам, способствующим разложению перекиси водорода, принадлежат медь, железо, марганец, а также ионы этих металлов.
Получение
Исторически первым промышленным методом синтеза пероксида водорода был электролиз серной кислоты или раствора сульфата аммония в серной кислоте, в ходе которого образуется пероксодисерная кислота, с последующим гидролизом последней до пероксида и серной кислоты:
- H2S2O8+2H2O→H2O2+2H2SO4.{\displaystyle {\mathsf {H_{2}S_{2}O_{8}+2H_{2}O\rightarrow H_{2}O_{2}+2H_{2}SO_{4}}}.}
С середины XX века персульфатный процесс синтеза пероксида водорода был вытеснен антрахиноновым процессом, разработанным компанией BASF в 1930-х. В этом процессе формально идет окисление водорода кислородом воздуха с катализом алкилпроизводными антрахинона:
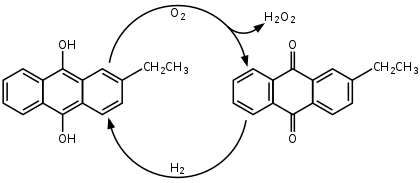
Процесс основан на автоокислении алкилантрагидрохинонов (обычно 2-этил-, 2-трет-бутил- и 2-пентилантрагидрохинонов) кислородом воздуха с образованием антрахинонов и пероксида водорода. Реакция проводится в растворе алкилантрагидрохинонов в бензоле с добавлением вторичных спиртов, по завершении процесса пероксид водорода экстрагируют из органической фазы водой. Для регенерации исходных антрагидрохинонов бензольный раствор антрахинонов восстанавливают водородом в присутствии каталитических количеств палладия.
Пероксид водорода также может быть получен каталитическим окислением изопропилового спирта
:
- (CH3)2CHOH+O2→(CH3)2CO+H2O2,{\displaystyle {\mathsf {(CH_{3})_{2}CHOH+O_{2}\rightarrow (CH_{3})_{2}CO+H_{2}O_{2}}},}
при этом ценным побочным продуктом этой реакции является ацетон, однако в широких масштабах в промышленности этот метод в настоящее время не используется.
В лабораторных условиях для получения пероксида водорода используют реакцию:
- BaO2+H2SO4→BaSO4↓+H2O2.{\displaystyle {\mathsf {BaO_{2}+H_{2}SO_{4}\rightarrow BaSO_{4}\downarrow +H_{2}O_{2}}}.}
Концентрирование и очистку пероксида водорода проводят осторожной перегонкой.
В последнее время (кон. XX в.) удалось синтезировать H2O3 и H2O4. Эти соединения весьма неустойчивы. При обычных температурах (н.у.) они разлагаются за доли секунды, однако при низких температурах порядка −70 °C существуют часами. Спектро-химическое исследование показывает, что их молекулы имеют зигзагообразную цепную структуру (подобную сульфанам): H—O—O—O—H, H—O—O—O—O—H.