Водород — это что такое? свойства и значение
Содержание:
- Изотопы
- Водород во Вселенной
- Космос
- Особенности водорода как топлива для двигателя
- Полезные свойства водорода
- Водородный баланс планеты
- Химические свойства
- Получение и применение
- 7. Химические свойства
- Подводные аппараты на перекиси водорода
- 4.3. Физические свойства
- Глобальные перспективы
- 6. Свойства изотопов
- Применение
- Примечания
- Реакции водорода со сложными веществами
Изотопы
Термодинамическое состояние насыщенного пара водорода с различным изотопным составом
Водород в природе встречается в виде трёх изотопов, которые имеют индивидуальные названия и химические символы: 1H — протий (Н), 2Н — дейтерий (D), 3Н — тритий (T; радиоактивный).
Протий и дейтерий являются стабильными изотопами с массовыми числами 1 и 2. Содержание их в природе соответственно составляет 99,9885 ± 0,0070 % и 0,0115 ± 0,0070 %. Это соотношение может незначительно меняться в зависимости от источника и способа получения водорода.
Изотоп водорода 3Н (тритий) нестабилен. Его период полураспада составляет 12,32 года. Тритий содержится в природе в очень малых количествах, образуясь главным образом при взаимодействии космических лучей со стабильными ядрами, при захвате дейтерием тепловых нейтронов и при взаимодействии природного изотопа лития-6 с нейтронами, порождёнными космическими лучами. Тритий претерпевает бета-распад, превращаясь в редкий стабильный изотоп гелия 3He.
Искусственно получены также тяжёлые радиоактивные изотопы водорода с массовыми числами 4—7 и периодами полураспада 10−21—10−23 с.
Природный молекулярный водород состоит из молекул H2 и HD (дейтероводород) в соотношении 3200:1. Содержание в смеси молекул из чистого дейтерия D2 ещё меньше. Отношение концентраций молекул HD и D2 составляет примерно 6400:1.
Из всех изотопов химических элементов физические свойства изотопов водорода отличаются друг от друга наиболее сильно. Это связано с наибольшим относительным изменением масс атомов.
-
Температура плавления,K Температура кипения,K Тройная точка Критическая точка Плотность,кг/м³ T, K P, кПа T, K P, кПа жидкий газ H2 13,96 20,39 13,96 7,3 32,98 1,31 70,811 1,316 HD 16,65 22,13 16,6 12,8 35,91 1,48 114,0 1,802 HT 22,92 17,63 17,7 37,13 1,57 158,62 2,31 D2 18,65 23,67 18,73 17,1 38,35 1,67 162,50 2,23 DT 24.38 19,71 19,4 39,42 1,77 211,54 2,694 T2 20,63 25,04 20,62 21,6 40,44 1,85 260,17 3,136
Дейтерий и тритий также имеют орто- и парамодификации: p-D2, o-D2, p-T2,
o-T2. Гетероизотопные молекулы водорода (HD, HT, DT) не имеют орто- и парамодификаций.
Водород во Вселенной
Вселенная на 92% по количеству атомов и на 75% по массе состоит из водорода — самого первого химического элемента во многих смыслах. Поскольку атом водорода состоит всего из одного протона и электрона (если в расчет не брать изотопы — дейтерий и тритий, где в состав атомного ядра водорода входят еще один или два нейтрона), то проще водорода в мире веществ ничего нет и быть не может. Поэтому в Периодической системе Д.И. Менделеева водород поставлен на первое место. Не случайно среди всех химических элементов он первым появился во Вселенной, и случилось это вскоре после Большого взрыва. Даже спустя почти 14 млрд. лет водород остается основным строительным материалом, первокирпичиком в видимой части Вселенной. Межзвездный газ почти на 100% состоит из водорода.
Наше Солнце также пока преимущественно состоит из водорода (на 75%). «Пока», потому что выгорание водорода с превращением его в гелий — суть термоядерной реакции, происходящей в недрах ближайшей к нам звезды. В момент образования Солнца содержание водорода в нем было близко к 100%. Со временем соотношение водорода и гелия в Солнце меняется в пользу последнего со всеми вытекающими из этого последствиями. Но дальше мы об этом говорить не будем.
На нашей планете свободного водорода почти нет. В силу исключительной летучести в крайне небольших количествах свободный водород встречается лишь в верхних слоях атмосферы. Не случайно водородом надувают шары для зондов. Остальной водород на Земле входит в состав различных химических соединений, например, воды. Два атома водорода на один атом кислорода в молекуле воды составляют примерно 1/9 часть от массы всей молекулы.
Получить воду из водорода в условиях Земли исключительно просто: для этого его надо всего лишь сжечь, чтобы он вступил в химическую реакцию с содержащимся в атмосфере кислородом
Только делать это надо с большой осторожностью, поскольку в определенных пропорциях с воздухом водород образует так называемый «гремучий газ», унесший в свое время немалое количество жизней. Именно поэтому от водорода отказались при надувании воздушных шаров и дирижаблей
В то же время водород находит широкое применение в качестве компонента (восстановителя) ракетного топлива. Температура горения водорода очень высока — свыше 2000оС, что придает исключительно мощную тягу ракетным двигателям. Использование водорода в космической промышленности имеет свои достоинства и недостатки. Главный недостаток — взрывоопасность, главное достоинство — отсутствие вредных выбросов, ведь продуктом сгорания водорода является самая обыкновенная вода.
Водород в организме человека
В нашем организме половина всех атомов — это атомы водорода. Однако, поскольку водород — самый легкий химический элемент, то он составляет всего лишь 10% от массы нашего тела.
Чистый водород, то есть не входящий в состав химических соединений, биологической ценности для нашего организма не имеет. В то же время без водорода вряд ли на Земле вообще могла зародиться жизнь, ведь он входит в состав подавляющего количества органических веществ, самым простым из которых можно считать метан (СН4). Понятное дело, что без водорода не было бы воды — основы всей жизни, в которой она зародилась и без которой в принципе обойтись не может.
Космос
В космосе ни один элемент не встречается так часто, как водород. Объем водорода в составе элементов Солнца — более половины его массы. Большинство звёзд образует водород, находящийся в виде плазмы. Основная часть разнообразных газов туманностей и межзвёздной среды тоже состояит из водорода. Он присутствует в кометах, в атмосфере целого ряда планет. Естественно, не в чистом виде, — то как свободный Н2, то как метан СН4, то как аммиак NH3, даже как вода Н2О. Очень часто встречаются радикалы СН, NH, SiN, OH, РН и тому подобные. Как поток протонов водород является частью корпускулярного солнечного излучения и космических лучей.
В обычном водороде смесь двух устойчивых изотопов — это лёгкий водород (или протий 1Н) и тяжёлый водород (или дейтерий — 2Н или D). Есть и другие изотопы: радиоактивный тритий — 3Н или Т, иначе — сверхтяжёлый водород. А ещё очень неустойчивый 4Н. В природе соединение водорода содержит изотопы в таких пропорциях: на один атом дейтерия приходится 6800 атомов протия. Тритий образуется в атмосфере из азота, на который воздействуют нейтроны космических лучей, но ничтожно мало. Что обозначают числа массы изотопов? Цифра указывает, что ядро протия — только с одним протоном, а у дейтерия в ядре атома не только протон, но и нейтрон. У трития в ядре к одному протону уже два нейтрона. А вот 4Н содержит три нейтрона на один протон. Поэтому физические свойства и химические у изотопов водорода очень сильно отличаются по сравнению с изотопами всех других элементов, — слишком большое различие масс.

Особенности водорода как топлива для двигателя
В ДВС бензин смешивается с воздухом, после чего подается в цилиндры и сгорает, в результате чего происходит перемещение поршней и движение транспортного средства.
Применение водорода в виде топлива имеет ряд нюансов:
- После сжигания топливной смеси на выходе образуется только пар.
- Реакция воспламенения происходит быстрее, чем в случае с дизельным топливом или бензином.
- Благодаря детонационной устойчивости, удается поднять степень сжатия.
- Теплоотдача водорода на 250% выше, чем у топливно-воздушной смеси.
- Водород — летучий газ, поэтому он попадает в мельчайшие зазоры и полости. По этой причине немногие металлы способны перенести его разрушительное влияние.
- Хранение такого топлива происходит в жидкой или сжатой форме. В случае пробоя бака водород испаряется.
- Нижний уровень пропорции газа для вхождения в реакцию с кислородом составляет 4%. Благодаря этой особенности, удается настроить режимы работы мотора путем дозирования консистенции.
С учетом перечисленных нюансов применять H2 в чистом виде для двигателя внутреннего сгорания нельзя. Требуется внесение конструктивных изменений в ДВС и установка дополнительного оборудования.
Полезные свойства водорода
Водород легче воздуха в четырнадцать с половиной раз.
Его же отличает и самая высокая теплопроводность среди прочих газов (белее чем в семь раз превышает теплопроводность воздуха).
В былые времена воздушные шары и дирижабли заполняли водородом. После серии катастроф в середине 1930-х, закончившихся взрывами дирижаблей, конструкторам пришлось искать водороду замену.
Теперь для подобных летательных аппаратов используется гелий, который намного дороже водорода, зато не так взрывоопасен.
Водород хорошо зарекомендовал себя в качестве компонента ракетного топлива.

Фото 3. Водород применяется для изготовления ракетного топлива
Во многих странах ведутся исследования по созданию экономичных двигателей для легковых и грузовых автомобилей на основе водорода.
Автомобили на водородном топливе значительно экологичнее своих бензиновых и дизельных собратьев.
При обычных условиях (комнатная температура и естественное атмосферное давление) водород неохотно вступает в реакции.
При нагревании смеси водорода и кислорода до 600 °C начинается реакция, завершающаяся образованием молекул воды.
Эту же реакцию можно спровоцировать с помощью электрической искры.
Реакции при участи водорода завершаются, лишь когда участвующие в реакции компоненты будут израсходованы целиком.
Температура горящего водорода достигает 2500-2800 °C.
С помощью водорода производят очистку различных типов топлива на основе нефти и нефтепродуктов.
В живой природе водород заменить нечем, так как он присутствует в любой органике (включая нефть) и во всех белковых соединениях.
Без участия водорода жизнь на Земле была бы невозможна.
Водородный баланс планеты
В Земной атмосфере находится около 2.5 млрд. тонн водорода, который улетучивается в космос по 250 тысяч тонн в год. Источником восполнения «космических потерь» является водородная дегазация Земли в различных проявлениях.
Водородная дегазация планеты — явление выделения водорода в смеси с другими флюидными газами (чаще всего углеводородами, гелием и радоном) в рифтовых зонах, при извержениях вулканов, из разломов земной коры, кимберлитовых трубок, некоторых шахт, и скважин. Во многих случаях землетрясения тектонического происхождения сопровождаются увеличением содержания водорода в воздухе на территории эпицентра и прилегающих площадях.

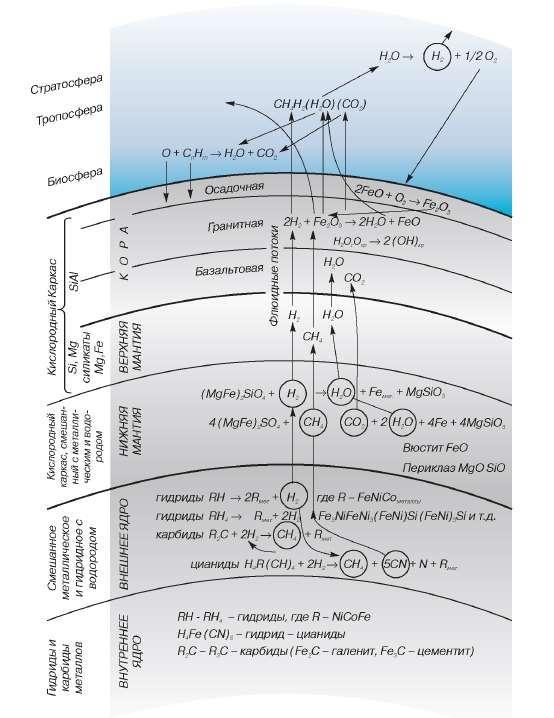 Геохимическая модель Земли
Геохимическая модель Земли
Как видно из схемы водородной дегазации, до поверхности Земли глубинный водород доходит в виде углеводородов, воды и в виде газа Н2. В общий водородный баланс добавляют и реакции гидролиза океанической воды при амфиболизации, хлоритизации, серпентинизации пород мантии в зонах субдукции по преобладающей схеме:
2Mg2SiO4(оливин) + 22H2O = 3Mg6{Si4O10}(OH)8(серпентин) + 6Mg(OH)2(брусит) + 4H2.
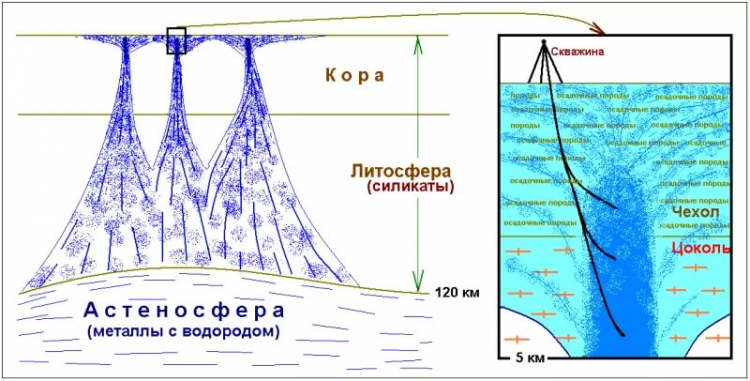
Литосфера, как плотный слой оксидов, является сложнопреодолимым барьером, препятствующим выходу водорода на поверхность. В результате происходит накопление газа под корой, где он вступает в химические реакции с прочими веществами, что сопровождается дополнительным выделением тепла. Скорее всего, именно наличие водорода делает астеносферу квази-жидкой средой. Полученные методом сейсмотомографии данные свидетельствуют о том, что на глубине около 100 км над астеносферой формируются многочисленные очаги землетрясений, фиксирующие подъем флюидного и расплавного материала.
Химические свойства
В соединениях по большей части водород показывает степень окисления (валентность) +1, как натрий и другие щелочные металлы. Его и рассматривают как их аналог, стоящий во главе первой группы системы Менделеева. Но ион водорода в гидридах металлов заряжен отрицательно, со степенью окисления -1. Также этот элемент близок к галогенам, которые даже способны замещать его в органических соединениях. Значит, водород можно отнести и к седьмой группе системы Менделеева. В обычных условиях молекулы водорода активностью не отличаются, соединяясь только с самыми активными неметаллами: хорошо с фтором, а если светло — с хлором. Но при нагревании водород становится другим — он со многими элементами вступает в реакцию. Атомарный водород по сравнению с молекулярным очень активен химически, так в связи с кислородом образуется вода, а попутно выделяется энергия и тепло. При комнатной температуре эта реакция очень медленная, зато при нагревании выше пятисот пятидесяти градусов получается взрыв.
Используется водород для восстановления металлов, потому что у их оксидов он отнимает кислород. Со фтором водород образует взрыв даже в темноте и при минус двухсот пятидесяти двух градусах по Цельсию. Хлор и бром возбуждают водород только при нагревании или освещении, а йод — только при нагревании. Водород с азотом образует аммиак (так производятся большинство удобрений). При нагревании он очень активно взаимодействует с серой, и получается сероводород. С теллуром и селеном вызвать реакцию водорода трудно, а с чистым углеродом реакция происходит при очень высоких температурах, и получается метан. С оксидом углерода водород образует разные органические соединения, здесь влияют давление, температура, катализаторы, и всё это имеет огромное практическое значение. И вообще, роль водорода, а также и его соединений исключительно велика, поскольку он даёт кислотные свойства протонным кислотам. Со многими элементами образуется водородная связь, влияющая на свойства и неорганических и органических соединений.

Получение и применение
Получают водород в промышленных масштабах из природных газов — горючих, коксового, газов переработки нефти. Также его можно получить методом электролиза там, где электроэнергия не слишком дорога. Однако важнейшим способом производства водорода является каталитическое взаимодействие углеводородов, по большей части метана, с водяным паром, когда получается конверсия. Также широко применяется и способ окисления углеводородов кислородом. Добыча водорода из природного газа является самым дешёвым способом. Другие два — использование коксового газа и газа нефтепереработки — водород выделяется, когда сжижаются остальные компоненты. Они более легко поддаются сжижению, а для водорода, как мы помним, нужно -252 градуса.
Очень популярна в использовании перекись водорода. Лечение этим раствором применяется очень часто. Молекулярную формулу Н2О2 вряд ли назовут все те миллионы людей, которые хотят быть блондинками и осветляют себе волосы, а также и те, кто любит чистоту на кухне. Даже те, кто обрабатывает царапины, полученные от игры с котёнком, чаще всего не отдают себе отчёта, что применяют лечение водородом. Зато все знают историю: с 1852 года водород долгое время использовался в воздухоплавании. Дирижабль, изобретённый Генри Гиффардом, был создан на основе водорода. Их называли цеппелинами. Вытеснило цеппелины с небесных просторов стремительное развитие самолётостроения. В 1937 году произошла крупная авария, когда сгорел дирижабль «Гинденбург». После этого случая цеппелины более не использовались никогда. Зато в конце восемнадцатого века распространение воздушных шаров, наполненных водородом, было повсеместным. Помимо производства аммиака, сегодня водород необходим для изготовления метилового спирта и других спиртов, бензина, гидрогенизированного тяжёлого жидкого топлива и твёрдого топлива. Не обойтись без водорода при сварке, при резке металлов — она может быть кислородно-водородной и атомно-водородной. А тритий и дейтерий дают жизнь атомной энергетике. Это, как мы помним, изотопы водорода.

7. Химические свойства
Доля диссоциировавших молекул водорода
Молекулы водорода Н2 довольно прочны, и для того, чтобы водород мог вступить в реакцию, должна быть затрачена большая энергия:
- Н2 = 2Н − 432 кДж
Поэтому при обычных температурах водород реагирует только с очень активными металлами, например с кальцием, образуя гидрид кальция:
- Ca + Н2 = СаН2
и с единственным неметаллом — фтором, образуя фтороводород:
- F2 + H2 = 2HF
С большинством же металлов и неметаллов водород реагирует при повышенной температуре или при другом воздействии, например при освещении:
- О2 + 2Н2 = 2Н2О
Он может «отнимать» кислород от некоторых оксидов, например:
- CuO + Н2 = Cu + Н2O
Записанное уравнение отражает восстановительные свойства водорода.
- N2 + 3H2 → 2NH3
С галогенами образует галогеноводороды:
- F2 + H2 → 2HF, реакция протекает со взрывом в темноте и при любой температуре,
- Cl2 + H2 → 2HCl, реакция протекает со взрывом, только на свету.
С сажей взаимодействует при сильном нагревании:
- C + 2H2 → CH4
8.1. Взаимодействие со щелочными и щёлочноземельными металлами
При взаимодействии с активными металлами водород образует гидриды:
- 2Na + H2 → 2NaH
- Ca + H2 → CaH2
- Mg + H2 → MgH2
Гидриды — солеобразные, твёрдые вещества, легко гидролизуются:
- CaH2 + 2H2O → Ca(OH)2 + 2H2↑
Оксиды восстанавливаются до металлов:
- CuO + H2 → Cu + H2O
- Fe2O3 + 3H2 → 2Fe + 3H2O
- WO3 + 3H2 → W + 3H2O
8.2.3. Гидрирование органических соединений
Молекулярный водород широко применяется в органическом синтезе для восстановления органических соединений. Эти процессы называют реакциями гидрирования. Эти реакции проводят в присутствии катализатора при повышенных давлении и температуре. Катализатор может быть как гомогенным (напр. Катализатор Уилкинсона), так и гетерогенным (напр. никель Ренея, палладий на угле).
Так, в частности, при каталитическом гидрировании ненасыщенных соединений, таких как алкены и алкины, образуются насыщенные соединения — алканы.
Подводные аппараты на перекиси водорода
В 1938—1942 годах на Кильских верфях под руководством инженера Вальтера построили опытную лодку У-80 работавшую на перекиси водорода. На испытаниях корабль показал скорость полного подводного хода 28,1 узла. Полученные в результате разложения перекиси пары воды и кислорода использовали в качестве рабочего тела в турбине, после чего удаляли их за борт.
На рисунке условно показано устройство подводной лодки с двигателем на перекиси водорода
Всего немцы успели построить 11 лодок с ПГТУ.
После разгрома гитлеровской Германии в Англии, США, Швеции и СССР проводились работы с целью довести замысел Вальтера до практической реализации. Была построена советская подлодка (проект 617) с двигателем Вальтера в конструкторском бюро Антипина.
Знаменитая ПОДВОДНАЯ РАКЕТО-ТОРПЕДА ВА-111 «ШКВАЛ».
Тем временем успехи атомной энергетики позволили более удачно решить проблему мощных подводных двигателей. И эти идеи успешно применили в торпедных двигателях. Walter HWK 573. (работающий под водой двигатель первой в мире управляемой противокорабельной ракеты «воздух-поверхность» GT 1200A для поражения корабля ниже ватерлинии). Планирующая торпеда (УАБ) GT 1200A имела подводную скорость 230 км/ч, являясь прототипом высокоскоростной торпеды СССР «Шквал». Торпеда ДБТ принята на вооружение в декабре 1957 года, работала на перекиси водорода и развивала скорость 45 узлов при дальности хода до 18 км.
Газогенератором через кавитационную головку создается воздушный пузырь вокруг корпуса объекта (парогазовый пузырь) и, вследствие падения гидродинамического сопротивления (сопротивления воды) и применения реактивных двигателей, достигается требуемая подводная скорость движения (100 м/с), превышающая в разы скорость самой быстрой обычной торпеды. Для работы используется гидрореагирующее топливо (щелочные металлы при взаимодействии с водой выделяют водород).
4.3. Физические свойства
Спектр излучения водорода
Эмиссионный спектр водорода
Водород — самый лёгкий газ, он легче воздуха в 14,5 раз. Очевидно, что чем меньше масса молекул, тем выше их скорость при одной и той же температуре. Как самые лёгкие, молекулы водорода движутся быстрее молекул любого другого газа и тем самым быстрее могут передавать теплоту от одного тела к другому. Отсюда следует, что водород обладает самой высокой теплопроводностью среди газообразных веществ. Его теплопроводность примерно в семь раз выше теплопроводности воздуха.
Молекула водорода двухатомна — Н2. При нормальных условиях — это газ без цвета, запаха и вкуса. Плотность 0,08987 г/л (н.у.), температура кипения −252,76 °C, удельная теплота сгорания 120.9×106 Дж/кг, малорастворим в воде — 18,8 мл/л. Водород хорошо растворим во многих металлах (Ni, Pt, Pd и др.), особенно в палладии (850 объёмов на 1 объём Pd). С растворимостью водорода в металлах связана его способность диффундировать через них; диффузия через углеродистый сплав (например, сталь) иногда сопровождается разрушением сплава вследствие взаимодействия водорода с углеродом (так называемая декарбонизация). Практически не растворим в серебре.
Фазовая диаграмма водорода
Жидкий водород существует в очень узком интервале температур от −252,76 до −259,2 °C. Это бесцветная жидкость, очень лёгкая (плотность при −253 °C 0,0708 г/см³) и текучая (вязкость при −253 °C 13,8 спуаз). Критические параметры водорода очень низкие: температура −240,2 °C и давление 12,8 атм. Этим объясняются трудности при ожижении водорода. В жидком состоянии равновесный водород состоит из 99,79 % пара-Н2, 0,21 % орто-Н2.
Твердый водород, температура плавления −259,2 °C, плотность 0,0807 г/см³ (при −262 °C) — снегоподобная масса, кристаллы гексогональной сингонии, пространственная группа P6/mmc, параметры ячейки a=3,75 c=6,12. При высоком давлении водород переходит в металлическое состояние.
Молекулярный водород существует в двух спиновых формах (модификациях) — в виде орто- и параводорода. В молекуле ортоводорода o-H2 (т. пл. −259,10 °C, т. кип. −252,56 °C) ядерные спины направлены одинаково (параллельны), а у параводорода p-H2 (т. пл. −259,32 °C, т. кип. −252,89 °C) — противоположно друг другу (антипараллельны). Равновесная смесь o-H2 и p-H2 при заданной температуре называется равновесный водород e-H2.
Равновесная мольная концентрация пара-водорода
Разделить модификации водорода можно адсорбцией на активном угле при температуре жидкого азота. При очень низких температурах равновесие между ортоводородом и параводородом почти нацело сдвинуто в сторону последнего. При 80 К соотношение форм приблизительно 1:1. Десорбированный параводород при нагревании превращается в ортоводород вплоть до образования равновесной при комнатной температуре смеси (орто-пара: 75:25). Без катализатора превращение происходит медленно (в условиях межзвёздной среды — с характерными временами вплоть до космологических), что даёт возможность изучить свойства отдельных модификаций.
Глобальные перспективы
Безусловно, пока доля водородной энергетики относительно невелика. Да и сам водород сегодня не столько топливо, сколько сырьё для производства аммиака и метанола. Однако существующее положение вещей меняется и не исключено, что уже в среднесрочной перспективе водород сможет заменить природный газ.
В частности, в Японии уже началось создание глобальной сети производства водорода для энергетических установок. Причём для его транспортировки в жидком виде стране потребуется около 80 танкеров.
В 2019 году в австралийском городе Гастингсе начато строительство специального водородного терминала. Сжиженный водород оттуда будет отправляться, в том числе и в Японию.
Все эти факты говорят о том, что о высоком потенциале водородной энергетики свидетельствуют не только прогнозы аналитиков, но и инвестиции крупных корпораций. А это означает, что традиционным энергоносителям рано или поздно придётся уступить своё место на пьедестале.
6. Свойства изотопов
Источники информации:
| Изотоп | Z | N | Масса (а. е. м.) | Период полураспада | Спин | % в природе | Тип и энергия распада | |
|---|---|---|---|---|---|---|---|---|
| 1H | 1 | 1,007 825 032 07(10) | Стабилен | 1⁄2+ | 99,9885(70)% | |||
| 2H | 1 | 1 | 2,014 101 777 8(4) | Стабилен | 1+ | 0,0115(70)% | ||
| 3H | 1 | 2 | 3,016 049 277 7(25) | 12,32(2) года | 1⁄2+ | β− | 18,591(1) кэВ | |
| 4H | 1 | 3 | 4,027 81(11) | 1,39(10)×10−22 с | 2− | -n | 23,48(10) МэВ | |
| 5H | 1 | 4 | 5.035 31(11) | >9,1×10−22 с | (1⁄2+) | -nn | 21,51(11) МэВ | |
| 6H | 1 | 5 | 6,044 94(28) | 2,90(70)×10−22 с | 2− | −3n | 24,27(26) МэВ | |
| 7H | 1 | 6 | 7,052 75(108) | 2,3(6)×10−23 с | 1⁄2+ | -nn | 23,03(101) МэВ |
В круглых скобках приведено среднеквадратическое отклонение значения в единицах последнего разряда соответствующего числа.
Применение
Водород сегодня применяется во многих областях. Структура мирового потребления водорода представлена в следующей таблице
| Применение | Доля |
|---|---|
| Производство аммиака | 54 % |
| Нефтепереработка и химическая промышленность | 35 % |
| Производство электроники | 6 % |
| Металлургия и стекольная промышленность | 3 % |
| Пищевая промышленность | 2 % |
Химическая промышленность
Химическая промышленность — это крупнейший потребитель водорода. Около 50 % мирового выпуска водорода идёт на производство аммиака. Ещё около 8 % используется для производства метанола. Из аммиака производят пластмассы, удобрения, взрывчатые вещества и прочее. Метанол является основой для производства некоторых пластмасс.
Нефтеперерабатывающая промышленность
В нефтепереработке водород используется в процессах гидрокрекинга и гидроочистки, способствуя увеличению глубины переработки сырой нефти и повышению качества конечных продуктов. Для этих целей используется порядка 37 % всего производимого в мире водорода.
Пищевая и косметическая промышленность
При производстве саломаса (твердый жир, производимый из растительных масел). Саломас является основой для производства маргарина, косметических средств, мыла. Водород зарегистрирован в качестве пищевой добавки E949.
Химические лаборатории
Водород используется в химических лабораториях в качестве газа-носителя в газовой хроматографии. Такие лаборатории есть на многих предприятиях в пищевой, парфюмерной, металлургической и химической промышленности. Несмотря на горючесть водорода, его использование в такой роли считается достаточно безопасным, поскольку водород используется в незначительных количествах. Эффективность водорода как газа-носителя при этом лучше, чем у гелия, при существенно более низкой стоимости.
Авиационная промышленность
В настоящее время водород в авиации не используется. Когда-то дирижабли и воздушные шары наполняли водородом. Но в 30-х гг. XX в. произошло несколько катастроф, в ходе которых дирижабли взрывались и сгорали. В наше время дирижабли наполняют гелием, несмотря на его существенно более высокую стоимость.
Метеорология
Водород используется в метеорологии для заполнения оболочек метеозондов. Водород в этом качестве имеет преимущество перед гелием, так как он дешевле. Ещё более существенно, что водород вырабатывается прямо на метеостанции с помощью простого химического генератора или с помощью электролиза воды. Гелий же должен доставляться на метеостанцию в баллонах, что может быть затруднительно для удаленных мест.
Топливо
Водород используют в качестве ракетного топлива. Ввиду крайне узкого диапазона температур (менее 7 кельвинов), при котором водород остается жидкостью, на практике чаще используется смесь жидкой и твёрдой фаз (шугообразный водород).
Ведутся исследования по применению водорода как топлива для легковых и грузовых автомобилей, хотя здесь серьезную проблему представляет водородное охрупчивание сталей, не позволяющее напрямую переводить обычный ДВС на этот газ. Водород в ДВС меньше загрязняет окружающую среду локально (использование водорода в этом качестве затрудняет низкая эффективность его получения и сопряжённых дополнительных расходов на его сжатие, транспортировку), но так же, как и бензиновые/дизельные аналоги, потребляет и деградирует моторное масло и все остальные неэкологичные материалы, присущие двигателям внутреннего сгорания. В смысле экологии электромобили значительно лучше, перспективен также двигатель Стирлинга.[источник не указан 2108 дней]
В водородно-кислородных топливных элементах используется водород для непосредственного преобразования энергии химической реакции в электрическую.
Прочее
Атомарный водород используется для атомно-водородной сварки. Высокая теплопроводность водорода используется для заполнения сфер гирокомпасов и стеклянных колб филаментных LED-лампочек.
Примечания
- Hydrogen: electronegativities — www.webelements.com/hydrogen/electronegativity.html (англ.). Webelements.
- ↑ 12Редкол.:Кнунянц И. Л. (гл. ред.) Химическая энциклопедия: в 5 т. — Москва: Советская энциклопедия, 1988. — Т. 1. — С. 400-402. — 623 с. — 100 000 экз.
- ↑ 1234G. Audi, O. Bersillon, J. Blachot and A. H. Wapstra (2003). «The NUBASE evaluation of nuclear and decay properties — www.nndc.bnl.gov/amdc/nubase/Nubase2003.pdf». Nuclear Physics A 729: 3–128. DOI:10.1016/j.nuclphysa.2003.11.001 — dx.doi.org/10.1016/j.nuclphysa.2003.11.001.
- Züttel A.,Borgschulte A.,Schlapbach L. Hydrogen as a Future Energy Carrier.- Wiley-VCH Verlag GmbH & Co. KGaA, 2008. — ISBN 978-3-527-30817-0
- G. Audi, A.H. Wapstra, and C. Thibault (2003). «The AME2003 atomic mass evaluation (II). Tables, graphs, and references. — www.nndc.bnl.gov/amdc/masstables/Ame2003/Ame2003b.pdf». Nuclear Physics A 729: 337—676. DOI:10.1016/j.nuclphysa.2003.11.003 — dx.doi.org/10.1016/j.nuclphysa.2003.11.003.
- Правилов А. М. Фотопроцессы в молекулярных газах. М.: Энергоатомиздат, 1992.
- Журнал «Вестник Online». Аркадий Шварц. Снова о водороде — www.vestnik.com/issues/2004/0915/win/shvartz.htm
- ↑ 12 Книга рекордов Гиннесса для химических веществ — www.chemister.ru/Chemie/records.htm
Реакции водорода со сложными веществами
- при высокой температуре водород восстанавливает многие оксиды металлов:
ZnO+H 2 = Zn+H 2 O - метиловый спирт получают в результате реакции водорода с оксидом углерода (II):
2H 2 +CO → CH 3 OH - в реакциях гидрогенизации водород реагирует с многими органическими веществами.
Более подробно уравнения химических реакций водорода и его соединений рассмотрены на странице «Водород и его соединения — уравнения химических реакций с участием водорода «.
Применение водорода
- в атомной энергетике используются изотопы водорода — дейтерий и тритий;
- в химической промышленности водород используют для синтеза многих органических веществ, аммиака, хлороводорода;
- в пищевой промышленности водород применяют в производстве твердых жиров посредство гидрогенизации растительных масел;
- для сварки и резки металлов используют высокую температуру горения водорода в кислороде (2600°C);
- при получении некоторых металлов водород используют в качестве восстановителя (см. выше);
- поскольку водород является легким газом, его используют в воздухоплавании в качестве наполнителя воздушных шаров, аэростатов, дирижаблей;
- как топливо водород используют в смеси с СО.
В последнее время ученые уделяют достаточно много внимания поиску альтернативных источников возобновляемой энергии. Одним из перспективных направлений является «водородная» энергетика, в которой в качестве топлива используется водород, продуктом сгорания которого является обыкновенная вода.
Способы получения водорода
Промышленные способы получения водорода:
- конверсией метана (каталитическим восстановлением водяного пара) парами воды при высокой температуре (800°C) на никелевом катализаторе: CH 4 + 2H 2 O = 4H 2 + CO 2 ;
- конверсией оксида углерода с водяным паром (t=500°C) на катализаторе Fe 2 O 3: CO + H 2 O = CO 2 + H 2 ;
- термическим разложением метана: CH 4 = C + 2H 2 ;
- газификацией твердых топлив (t=1000°C): C + H 2 O = CO + H 2 ;
- электролизом воды (очень дорогой способ при котором получается очень чистый водород): 2H 2 O → 2H 2 + O 2 .
Лабораторные способы получения водорода:
- действием на металлы (чаще цинк) соляной или разбавленной серной кислотой: Zn + 2HCl = ZCl 2 + H 2 ; Zn + H 2 SO 4 = ZnSO 4 + H 2 ;
- взаимодействием паров воды с раскаленными железными стружками: 4H 2 O + 3Fe = Fe 3 O 4 + 4H 2 .
Аноним
1. Водород. Общая характеристика
Водород H — первый элемент в периодической системе, самый распространённый элемент во Вселенной (92%); в земной коре массовая доля водорода составляет всего 1%.
Впервые выделен в чистом виде Г. Кавендишем в 1766 г. В 1787г. А. Лавуазье доказал, что водород — химический элемент.
Атом водорода состоит из ядра и одного электрона. Электронная конфигурация — 1S1. Молекула водорода двухатомная. Связь ковалентная неполярная.
Радиус атома — (0,08 нм);
потенциал ионизации (ПИ) — (13,6 эВ);
электроотрицательность (ЭО) — (2,1);
степени окисления — (-1; +1).
2. Примеры соединений, содержащих водород
HCL, H2O,H2S04 и тд.
Аноним
В данном задании вам необходимо дать общую характеристику элементу водород.