Оэ металлы какие свойства определяют при испытании сварных соединений
Содержание:
- Основы релейной защиты ›› 1-7. Расчеты релейной защиты от междуфазных КЗ на электромеханических реле для воздушных сетей 6 и 10 кВ в сельской местности
- Металлы и их отличительные свойства
- Свойства таблицы Менделеева
- Статьи ›› Компенсированная и комбинировано заземленная нейтраль. Опыт эксплуатации сети 6 кВ металлургического комбината
- Общая характеристика
- Периодическая таблица Менделеева
- Металлы в таблице Менделеева
- Происхождение слова «металл»
- Основы релейной защиты ›› 2-2. Максимальная токовая защита без пуска по напряжению и токовая отсечка
- Структура металлов
- ИССЛЕДУЕМЫЕ СВОЙСТВА
- Статьи ›› Направленные защиты. Особенности применения
Основы релейной защиты ›› 1-7. Расчеты релейной защиты от междуфазных КЗ на электромеханических реле для воздушных сетей 6 и 10 кВ в сельской местности
Общие сведения. В сельской местности электроснабжение осуществляется, как правило, по воздушным линиям (BJ1) напряжением 10 и, реже, 6 кВ, которые подключаются к подстанциям с высшим напряжением 35 или 110 кВ, а иногда и более высокого класса напряжения. Благодаря сооружению большого числа питающих линий и подстанций 35, 110 кВ во всех сельскохозяйственных районах нашей страны значительно снизилась средняя протяженность линий 10 (6) кВ. Появилось много сравнительно коротких линий (до 10 км), но наряду с ними сохраняется еще значительное число BJI 10 кВ, протяженность которых исчисляется десятками километров, а также таких BJI 10 кВ, которые могут значительно удлиняться при создании кратковременных аварийных и ремонтных схем электроснабжения.
Металлы и их отличительные свойства
Все химические элементы можно довольно условно поделить на металлы и неметаллы. Что же их отличает друг от друга? Как отличить металл от неметалла?
Из 118 открытых веществ 94 относят к группе металлов. Группа представлена разнообразными подгруппами:
- Щелочные
- Щелочноземельные
- Переходные металлы
- Легкие
- Полуметаллы
- Лантаноиды
- Актиноиды
- Неопределенные — Бериллий и Магний.
Какие же признаки являются общими для всех металлов?
- Все металлы при комнатной температуре являют твёрдыми веществами. Это справедливо для всех элементов, кроме ртути, которая тверда до минус 39 градусов Цельсия. В комнатных условиях ртуть — это жидкость.
- Большинство из элементов этой группы имеют довольно высокую температуру плавления. Например, Вольфрам плавится при температуре 3410 градусов Цельсия. По этой причине его используют для изготовления нити в лампах накаливания.
- Все металлы пластичны. Это проявляется в том, что кристаллическая решетка металла позволяет атомам смещаться. В результате металлы могут гнуться без физической деформации, поддаются ковке. Особой пластичностью обладают медь, золото и серебро. Именно поэтому исторически они были первыми металлами, которые обрабатывал человек. Далее он научился обрабатывать железо.
- Все металлы очень хорошо проводят электричество, что опять же связано со строением металлической кристаллической решетки, имеющей подвижные электроны. Кроме всего прочего, эти элементы очень легко проводят тепло.
- Ну и, наконец, все металлы имеют характерный, ни с чем не сравнимый металлический блеск. Цвет чаще всего сероватой с голубым отливом. Au, Cu или Cs имеют желтый и красный оттенки.
Свойства таблицы Менделеева
Напомним, что группами
называют вертикальные ряды в периодической системе и химические свойства элементов главных и побочных подгрупп значительно различаются.
Свойства элементов в подгруппах закономерно изменяются сверху вниз:
- усиливаются металлические свойства и ослабевают неметаллические;
- возрастает атомный радиус;
- возрастает сила образованных элементом оснований и бескислородных кислот;
- электроотрицательность падает.
Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения, существует всего восемь форм кислородных соединений. В периодической системе их часто изображают общими формулами, расположенными под каждой группой в порядке возрастания степени окисления элементов: R 2 O, RO, R 2 O 3 , RO 2 , R 2 O 5 , RO 3 , R 2 O 7 , RO 4 , где символом R обозначают элемент данной группы. Формулы высших оксидов относятся ко всем элементам группы, кроме исключительных случаев, когда элементы не проявляют степени окисления, равной номеру группы (например, фтор).
Оксиды состава R 2 O проявляют сильные основные свойства, причём их основность возрастает с увеличением порядкового номера, оксиды состава RO (за исключением BeO) проявляют основные свойства. Оксиды состава RO 2 , R 2 O 5 , RO 3 , R 2 O 7 проявляют кислотные свойства, причём их кислотность возрастает с увеличением порядкового номера.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения. Существуют четыре формы таких соединений. Их располагают под элементами главных подгрупп и изображают общими формулами в последовательности RH 4 , RH 3 , RH 2 , RH.
Соединения RH 4 имеют нейтральный характер; RH 3 — слабоосновный; RH 2 — слабокислый; RH — сильнокислый характер.
Напомним, что периодом
называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров.
В пределах периода с увеличением порядкового номера элемента:
- электроотрицательность возрастает;
- металлические свойства убывают, неметаллические возрастают;
- атомный радиус падает.

Статьи ›› Компенсированная и комбинировано заземленная нейтраль. Опыт эксплуатации сети 6 кВ металлургического комбината
Главной целью исследования являлось сравнение особенностей процессов, происходящих при ОЗЗ в сети с компенсированной нейтралью (наличие только ДГР в нейтрали) и после установки резисторов параллельно катушке. С применением методов статистической обработки результатов по выборке, включающей 239 осциллограмм, показано, как меняется динамика процессов, вызывающих опасные воздействия на изоляцию сети, в зависимости от способа заземления нейтрали. Это позволит в дальнейшем более корректно и обоснованно подходить к выбору способа заземления нейтрали в сетях 6–35 кВ, режим эксплуатации которых близок к описываемому.
Общая характеристика
Металлами называют группу элементов, в виде простых веществ, которые обладают металлическими свойствами (пластичность, ковкость, блеск, электронная проводимость и т. д.)
Основное отличие элементов-металлов – они обладают только восстановительными свойствами, а в реакциях могут только окисляться. В соединениях они могут иметь только положительные степени окисления как в элементарных положительно заряженных ионах, так и в сложных ионах, где они образуют положительные центры.
Рис. 1. Список металлов.
Как правило, на внешнем уровне элементов металлов находится небольшое число электронов (1-3), значения электроотрицательности невысокие. К металлам относятся все s-элементы (кроме водорода и гелия), d- и f-элементы, а также p-элементы под чертой бор-астат. Для типичных металлов характерен большой размер атомов, что способствует легкости отдачи валентных электронов. Образующиеся положительные ионы устойчивы, так как имеют завершенную внешнюю электронную оболочку.
Периодическая таблица Менделеева
Периодическая система была составлена Дмитрием Менделеевым во второй половине 19 века. Открытие не только позволило упростить работу химиков, она смогла объединить в себе как в единой системе все открытые химические вещества, а также предсказать будущие открытия.
Создание данной структурированной системы бесценно для науки и для человечества в целом. Именно это открытие дало толчок развитию всей химии на долгие годы.
В интервью одному журналисту ученый объяснил, что работал над ней 25 лет и то, что она ему снилась – вполне естественно, но это не значит, что во сне пришли все ответы.
Созданная Менделеевым система делится на две части:
- периоды – столбики по горизонтали в одну или две строки (ряды),
- группы – вертикальные строчки, в один ряд.
Всего в системе 7 периодов, каждый следующий элемент отличен от предыдущего большим количеством электронов в ядре, т.е. заряд ядра каждого правого показателя больше левого на единицу. Каждый период начинается с металла, а заканчивается инертным газом – именно это и есть периодичность таблицы, ведь свойства соединений меняются внутри одного периода и повторяются в следующем. При этом, следует помнить, что 1-3 периоды неполные или малые, в них всего 2, 8 и 8 представителей. В полном периоде (т.е. оставшихся четырех) по 18 химических представителей.
В группе располагаются химические соединения с одинаковой высшей валентностью, т.е. у них одинаковое электронное строение. Всего в системе представлено 18 групп (полная версия), каждая из которых начинается щелочью и заканчивается инертным газом. Все, представленные в системе субстанции, можно разделить на две основные группы – металл или неметалл.
Для облегчения поиска группы имеют свое название, а металлические свойства субстанций усиливаются с каждой нижней строчкой, т.е. чем ниже соединение, тем больше у него будет атомных орбит и тем слабее электронные связи. Также меняется и кристаллическая решетка – она становится ярко выраженной у элементов с большим количеством атомных орбит.
В химии используют три вида таблиц:
- Короткая – актиноиды и лантаноиды вынесены за границы основного поля, а 4 и все последующие периоды занимают по 2 строчки.
- Длинная – в ней актиноиды и лантаноиды вынесены за границу основного поля.
- Сверхдлинная – каждый период занимает ровно 1 строку.
Главной считается та таблица Менделеева, которая была принята и подтверждена официально, но для удобства чаще используют короткую версию. Металлы и неметаллы в таблице Менделеева располагаются согласно строгим правилам, которые облегчают работу с ней.
Металлы в таблице Менделеева
 В системе Менделеева сплавы имеют преобладающее число и список их весьма велик – они начинаются с Бора (В) и заканчиваются полонием (Po) (исключением являются германий (Ge) и сурьма (Sb)). У этой группы есть характерные признаки, они разделены на группы, но их свойства при этом неоднородны. Характерные их признаки:
В системе Менделеева сплавы имеют преобладающее число и список их весьма велик – они начинаются с Бора (В) и заканчиваются полонием (Po) (исключением являются германий (Ge) и сурьма (Sb)). У этой группы есть характерные признаки, они разделены на группы, но их свойства при этом неоднородны. Характерные их признаки:
- пластичность,
- электропроводимость,
- блеск,
- легкая отдача электронов,
- ковкость,
- теплопроводность,
- твердость (кроме ртути).
Из-за различной химической и физической сути свойства могут существенно отличаться у двух представителей этой группы, не все они похожи на типичные природные сплавы, к примеру, ртуть – это жидкая субстанция, но относится к данной группе.
 В обычном своем состоянии она жидкая и без кристаллической решетки, которая играет ключевую роль в сплавах. Только химические характеристики роднят ртуть с данной группой элементов, несмотря на условность свойств этих органических соединений. То же самое касается и цезия – самого мягкого сплава, но он не может в природе существовать в чистом виде.
В обычном своем состоянии она жидкая и без кристаллической решетки, которая играет ключевую роль в сплавах. Только химические характеристики роднят ртуть с данной группой элементов, несмотря на условность свойств этих органических соединений. То же самое касается и цезия – самого мягкого сплава, но он не может в природе существовать в чистом виде.
Некоторые элементы такого типа могут существовать только доли секунды, а некоторые не встречаются в природе совсем – их создали в искусственных условиях лаборатории. У каждой из групп металлов в системе есть свое название и признаки, которые отличают их от других групп.
При этом отличия у них весьма существенные. В периодической системе все металлы располагаются по количеству электронов в ядре, т.е. по увеличению атомной массы. При этом для них характерно периодическое изменение характерных свойств. Из-за этого в таблице они не размещаются аккуратно, а могут стоять неправильно.
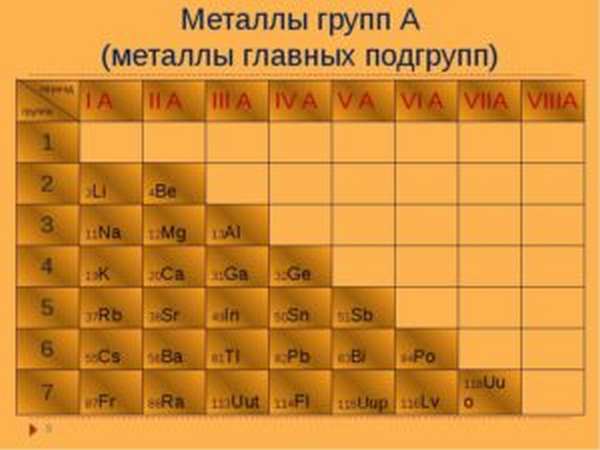 В первой группе щелочей нет веществ, которые бы встречались в чистом виде в природе – они могут пребывать только в составе различных соединений.
В первой группе щелочей нет веществ, которые бы встречались в чистом виде в природе – они могут пребывать только в составе различных соединений.
Как отличить металл от неметалла?
Как определить металл в соединении? Существует простой способ определения, но для этого необходимо иметь линейку и таблицу Менделеева. Для определения надо:
- Провести условную линию по местам соединения элементов от Бора до Полония (можно до Астата).
- Все материалы, которые будут слева линии и в побочных подгруппах – металл.
- Вещества справа – другого типа.
Однако у способа есть изъян – он не включает в группу Германий и Сурьму и работает только в длинной таблице. Метод можно использовать в качестве шпаргалки, но чтобы точно определить вещество, следует запомнить список всех неметаллов. Сколько их всего? Мало – всего 22 вещества.
В любом случае, для определения природы вещества необходимо рассматривать его в отдельности. Легко будет элементы, если знать их свойства
Важно запомнить, что все металлы:
- При комнатной температуре – твердые, за исключением ртути. При этом они блестят и хорошо проводят электрический ток.
- У них на внешнем уровне ядра меньшее количество атомов.
- Состоят из кристаллической решетки (кроме ртути), а все другие элементы имеют молекулярную или ионную структуру.
- В периодической системе все неметаллы – красного цвета, металлы – черного и зеленого.
- Если двигаться слева направо в периоде, то заряд ядра вещества будет увеличиваться.
- У некоторых веществ свойства выражены слабо, но они все равно имеют характерные признаки. Такие элементы относятся к полуметаллам, например Полоний или Сурьма, они обычно располагаются на границе двух групп.
Важно запомнить, что при перемещении в таблице сверху вниз становятся сильнее неметаллические свойства веществ, поскольку там располагаются элементы, которые имеют отдаленные внешние оболочки. Их ядро отделено от электронов и поэтому они притягиваются слабее
Происхождение слова «металл»
Слово «металл» заимствовано из немецкого языка. Отмечается в «Травнике» Николая Любчанина, написанном в 1534 году: «…злато и серебро всех металей одолеваетъ». Окончательно усвоено в Петровскую эпоху. Первоначально имело общее значение «минерал, руда, металл»; разграничение этих понятий произошло в эпоху М. В. Ломоносова.
|
Металлом называется светлое тело, которое ковать можно. Таких тел находим только шесть: золото, серебро, медь, олово, железо и свинец. Разделяются на высокие и простые металлы; которое разнство в том состоит, что высоких одним огнём без помощи других материй в пепел сожечь не можно, а напротив того простые через едину онаго силу в пепел обращаются. … За полуметаллы почитаются мышьяк, сурьма, висмут, цинк и ртуть. М. В. Ломоносов |
Немецкое слово «metall» заимствовано из латинского языка, где «metallum» — «рудник, металл». Латинское, в свою очередь, заимствовано из греческого языка (μεταλλον — «рудник, копь»).
Основы релейной защиты ›› 2-2. Максимальная токовая защита без пуска по напряжению и токовая отсечка
РАСЧЕТЫ ЗАЩИТ ПОНИЖАЮЩИХ ТРАНСФОРМАТОРОВ
2-2. Максимальная токовая защита без пуска по напряжению и токовая отсечка Особенности выполнения и расчета. Основные условия расчета максимальной токовой защиты для линий 6 и 10 кВ, изложенные в § 1-1, могут быть применены и для выбора уставок максимальной токовой защиты (без пуска по напряжению) понижающих трансформаторов. Выбор тока срабатывания защиты производится по выражениям (1-1) — (1-4), где только лишь коэффициент надежности согласования кнс выбирается несколько большим при наличии на трансформаторе устройства регулирования напряжения тока под нагрузкой (РПН). При расчетах аварийных токов КЗ за трансформаторами с РПН, а также токов самозапуска нагрузки, следует учитывать существенные изменения сопротивлений рассеяния трансформатора (хтр) при изменении положения регулятора РПН (см. ниже). При расчете токов КЗ и выборе уставок защит необходимо также учитывать все возможные режимы работы трансформаторов при их числе более одного, а также при наличии АВР в питаемой сети.
Структура металлов
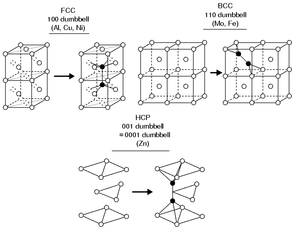
Кристаллическая структура сплавов
Вакансия в кристаллической решётке
Образование дендритов
См. также: Металловедение
Ни один металл невозможно приготовить в абсолютно чистом состоянии. Технически «чистые» металлы могут содержать до нескольких процентов примесей, и если эти примеси являются элементами с низким атомным весом (например, углерод, азот или кислород), то в пересчёте на атомные проценты содержание этих примесей может быть очень большим. Первые небольшие количества примесей в металле обычно входят в кристалл в виде твёрдого раствора. Можно выделить два главных типа твёрдых растворов:
- первый, когда атомы примеси намного меньше атомов металла-растворителя, растворённые атомы располагаются в решётке растворителя по междоузлиям, или «пустотам». Образование таких твёрдых растворов — твёрдых растворов внедрения — почти всегда сопровождается расширением решётки растворителя, и в окрестности каждого растворённого атома имеется локальное искажение решётки;
- второй, когда атомы примеси и растворителя имеют приблизительно одинаковые размеры, образуется твёрдый раствор замещения, в котором атомы растворённого элемента замещают атомы растворителя, так что атомы обоих сортов занимают места в узлах общей решётки. В таких случаях тоже вокруг каждого растворённого атома имеется искажённая область, а будет ли при этом решётка расширяться или сжиматься, зависит от относительных размеров атомов растворителя и растворённого вещества.
Для большей части металлов наиболее важными элементами, образующими твёрдые растворы внедрения, являются водород, бор, углерод, азот и кислород. Присутствие дислокаций всегда приводит к появлению аномально больших или малых межатомных расстояний. В присутствии примесей каждая дислокация окружена «атмосферой» примесных атомов. Примесные атмосферы «закрепляют» дислокации, потому что в результате перемещения дислокаций будет образовываться новая конфигурация с повышенной энергией. Границы между кристаллами также являются областями с аномальными межатомными расстояниями и, следовательно, тоже растворяют примесные атомы легче, чем неискажённые области кристаллов.
При увеличении содержания примесей растворённые атомы входят и в основную массу кристалла, однако всё ещё имеется избыток примеси по границам зёрен и вокруг дислокаций. Когда содержание примеси превышает предел растворимости, появляется новая фаза, которая может представлять собой или растворённое вещество, или промежуточную фазу, или соединение. В таких случаях границы между фазами могут быть двух родов. В общем случае кристаллическая структура частичек примеси слишком отлична от структуры металла-растворителя, поэтому решётки двух фаз не могут переходить одна в другую, образуя непрерывную структуру. В таких случаях на границах раздела фаз образуются слои с нерегулярной (искажённой) структурой. С образованием границ связано появление свободной поверхностной энергии, однако энергия деформации решётки растворителя относительно невелика. В таких случаях говорят, что эти частицы выделяются некогерентно.
B ряде случаев межатомные расстояния и кристаллическая структура металла-растворителя и частичек примеси таковы, что некоторые плоскости могут соединяться между собой, образуя непрерывную структуру. Тогда говорят, что частицы второй фазы выделяются когерентно и, поскольку сопряжение решёток никогда не бывает абсолютно точным, вокруг границы образуется сильно напряжённая область. В тех случаях, когда энергия деформации слишком велика для этого, соседние кристаллы могут контактировать таким образом, что при этом в пограничных слоях возникают области упругой деформации, а на самой границе раздела — дислокации. В таких случаях говорят, что частицы выделяются полукогерентно.
При повышении температуры вследствие увеличения амплитуды колебаний атомов может образоваться дефект кристаллической решётки, который называют вакансия или «дырка». Диффузия вакансий является одним из механизмов образования дислокаций.
Как правило, кристаллизация металла происходит путём переохлаждения с образованием дендритной структуры. По мере разрастания дендритные кристаллы соприкасаются, при этом образуются различные дефекты структуры. В большинстве случаев металл затвердевает так, что первая порция кристаллов содержит меньше примесей, чем последующие. Поэтому, как правило, примеси концентрируются на границах зёрен, образуя стабильные структуры.
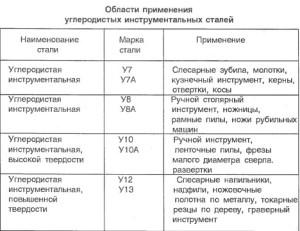
ИССЛЕДУЕМЫЕ СВОЙСТВА
У каждого металла есть свои физические свойства, исследовав которые можно понять, насколько деталь противостоит деформации. Проще говоря, насколько она будет долговечной. Чтобы это узнать деталь нужно подвергнуть той самой механической деформации. При этом главная задача — узнать максимальные возможности детали. Поэтому ее подвергают сильным нагрузкам до тех пор, пока она не разрушится.
Выше мы уже перечисляли свойства, которые можно определить методом механического разрушающего контроля. Это пластичность, твердость сварных швов, их прочность и ударная вязкость. Но далее мы расскажем подробнее, что кроется за каждым из этих терминов.
Итак, пластичность — это показатель металла, благодаря которому можно понять, насколько деталь подвержена изменению формы. Чтобы узнать показатель пластичности деталь подвергается механическому удлинению.
Далее твердость. Твердость металла — это показатель, благодаря которому мы можем узнать, насколько деталь противостоит проникновению в ее структуру другого предмета. Существует множество способов определения твердости (метод Бринеля, метод Роквелла, метод Виккерса и так далее). Всех их объединяет одно — в испытуемую деталь подается какой-нибудь предмет (стальной шарик, алмазный конус, алмазная пирамида) и фиксируется, насколько деталь сопротивляется этому механическому воздействию. В этом материале мы не будем подробно рассказывать о каждом методе проверки на твердость, поскольку их больше десятка и это тема для отдельной статьи.
Также испытывается прочность металла. Прочность и твердость во многом похожи, но не стоит их путать. Прочностью называют способность детали противостоять различным нагрузкам, в том числе растяжению. Детали помещают в специальный аппарат, который растягивает их в разные стороны. Такое испытание на прочность вполне эффективно. Но для большей эффективности детали могут дополнительно нагревать в ходе испытания. Для этих целей используется муфельная печь, встроенная в испытательную машину. С помощью печи можно заодно узнать и теплостойкость заготовки. Рекомендуется нагревать деталь не менее получаса, только результаты будут более достоверными.
Не забывайте и про ударную вязкость. Ударная вязкость — это способность металла к сопротивлению ударным нагрузкам. Деталь могут в прямом смысле испытывать с помощью механических ударов, пока не узнают ее предел. Самый распространенный способ проверки на ударную вязкость — это использование маятника, на конце которого расположено грузило. Маятник поднимают и затем опускают, в ходе падения он набирает определенную скорость и с силой бьет деталь.
Статьи ›› Направленные защиты. Особенности применения
Области использования В автор определил свою позицию по области применения ненаправленных токовых защит от замыканий на землю: это кабельные сети со значительным числом присоединений к каждой секции, причем каждое из этих присоединений характеризуется относительно малым емкостным током. Такой случай характерен, например, для внутризаводских сетей 6–10 кВ. Использование заземляющих резисторов существенно расширяет возможности эффективного использования ненаправленных токовых защит в таких сетях даже при наличии в сети дугогасящего реактора. Сети с воздушными ЛЭП характеризуются тем, что при обрыве провода с падением его на землю однофазные замыкания (ОЗЗ) часто сопровождаются большими переходными сопротивлениями в месте повреждения . В этом случае ток замыкания определяется не только значением сопротивления заземляющего резистора, а в первую очередь значением переходного сопротивления. Ненаправленные токовые защиты становятся неэффективными – они перестают чувствовать повреждение уже при переходных сопротивлениях порядка нескольких сотен ом. Если в сети отсутствуют дугогасящие реакторы, то в рассматриваемом случае, по мнению автора, наиболее эффективны направленные защиты, реагирующие на токи и напряжения промышленной частоты. Направленные защиты могут быть полезны также при защите ответственных синхронных двигателей, генераторов и некоторых других силовых элементов . Однако при рассмотрении этого класса защит возникает существенная трудность: известно значительное количество разновидностей защит от ОЗЗ, отличающихся принципом действия и основными характеристиками, но до сих пор отсутствует (по крайней мере, в отечественной литературе) какая бы то ни было классификация разновидностей защит внутри класса «направленные защиты от ОЗЗ». Ниже под направленными защитами от ОЗЗ будем понимать такие, которые реагируют на ток, напряжение нулевой последовательности и фазовый угол между ними.