Гафний: применение и свойства
Содержание:
- Culture growth
- History
- Технологии промышленного получения гафния
- Свойства
- Особенности
- Ссылки Править
- Получение
- Конкретные места применения сплавов и соединений
- Кельтий и гафний
- Производство
- Химические свойства
- Соединения двух- трех- и четырехвалентного Hf
- Commensal strain
- История
- Область применения
- Физические свойства
Culture growth
Hafnia grows in media containing 2% to 5% NaCl, a pH range of 4.9 to 8.25, and thermal gradients of 4 °C to 44 °C; the optimum temperature for growth has been reported as 35 °C.
There is general agreement that almost 100% of Hafnia strains grow on MacConkey, Hektoen enteric, eosin methylene blue, and xylose-lysine-deoxycholate agars, all of which are differential to moderately selective media.
On more inhibitory selective media, 25% to 60% of strains fail to grow on Salmonella-Shigella (SS) agar, while 75% to 100% of isolates are inhibited on brilliant green medium. Classic strains of H. alvei are lactose and sucrose negative and as such appear as nonfermenting colonies on enteric isolation media.
On moderately selective agars, they typically appear as large, smooth, convex, translucent colonies of 2 to 3 mm in diameter with an entire edge; some may exhibit an irregular border.
History
The genus Hafnia is one of more than 40 genera that currently comprise the order Enterobacterales.
Although Møller originally described this genus in 1954, the legitimacy of this group was constantly challenged over the next two decades, often being referred to by synonyms such as «Enterobacter alvei«, «Enterobacter aerogenes subsp. hafniae» and «Enterobacter hafniae» but it is mostly referenced by its current name, Hafnia alvei, in the literature.
In 1977, a study concluded that at the end of Camembert manufacturing Hafnia alvei remains as the dominant species. Hafnia alvei is a psychrotrophic strain, which can develop at low temperatures, meaning that it doesn’t stop growing during the storage phase of cheese unlike E. coli.
In 1983, Enterobacterales were discovered in freshly produced Camembert: 51% of the identified Enterobacterales were Hafnia alvei strains compared to only 9% of Escherichia coli. These authors also showed that Hafnia alvei grew to a high concentration in cheese (up to 107 CFU/g), in both raw milk and pasteurised milk cheeses.
A few years later, in 1987, Hafnia alvei was identified by a Spanish team in raw ewes’ milk representing 6.5% of the total Enterobacterales species present.
In 2014, a collaborative study working on cheese ripening, involving the French INRA and an Italian University, identified H. alvei in raw milk used to make the traditional Caciocavallo Pugliese Cheese.
Hafnia alvei is also present in fermented foods other than dairy products, it has been identified over the years in traditional meals around the planet.
In 1987, American scientists studying Brassicaceae found Hafnia alvei while analysing the microflora of fresh harvested collards, they believed the Hafnia alvei originated from soil contamination but not necessarily as a pathogen.
Hafnia has also been identified in fermented coffee seeds in Ethiopia and Ohio, USA. American researchers studied the microbiome of the coffee seeds and identified Hafnia alvei among numerous other strains and species, including 13 species of Enterobacterales. This study highlighted that the richness of the seeds’ microbiome was linked to the fermentation process and the coffee quality. The richest order of bacteria identified was the Enterobacterales containing Hafnia alvei. This family is often found in humid and nutrient rich environments similar to coffee processing conditions. Thus, they could play a critical role in the fermentation.
Hafnia alvei was also been identified in commercial Kimchi, a traditional Korean meal made with Asian cabbage, radish, spices and salted fermented seafood. Scientists suggest the source of Hafnia in this case is the fermented seafood.
In 2004, Mexican scientists isolated Hafnia alvei (among other bacteria such as Lactobacillus acidophilus or plantarum) from Pulque a traditional beverage made from fermented Maguey (also known as Agave).
And finally, Hafnia alvei was also isolated from meat products, particularly refrigerated beef due to the presence of Hafnia alvei on slaughtered cattle. It can be found alongside E. Coli in Chorizo, a popular semi-dry fermented Spanish sausage. Fermented sausages made in Spain were also reported to contain the Hafnia alvei strain, responsible for producing histamine that is crucial to the ripening process.
Технологии промышленного получения гафния
Исходным сырьем для получения гафния являются минеральные циркониевые руды и в первую очередь ZrSiO4, в котором присутствует до 2% металла по условиям производства могут быть замещены атомами гафния.
По технологии для получения металлического гафния и циркония минералы измельчают и смешивают с углеродосодержащим материалом, например графитом. После этого такую смесь подают в печь нагретую до 1800˚ C без подачи чистого воздуха на горение. При этом гафний и цирконий с углеродной пылью, образуя карбиды и готовы к дальнейшей технической переработке, но уже по отдельности.
Потом полученные материалы снова измельчают, загружают в шахтную печь и нагревают до 500˚C в присутствии газообразного хлора, для образования тетрахлоридных соединений гафния, циркония и использования их для получения чистых металлов в результате дробной кристаллизации.
По сути, на сегодняшний день весь производимый гафний это результат попутной переработки исходного сырья с целью получения чистого циркония для обеспечения реакторных технологий в ядерной энергетике. При этом для получения 1 кг гафния перерабатывается около 50 кг циркония. Поэтому общие объемы производства этих металлов напрямую зависит от объемов добычи циркония.
Свойства
Конфигурация внешней электронной оболочки атома 5d26s2; в соединениях проявляет степень окисления +4, редко +3, +2; электроотрицательность по Полингу 1,3; атомный радиус 156 пм, ионный радиус Hf4+ 82 пм (координац. число 6).
Г. – серебристо-белый (в виде порошка – тёмно-серый) пластичный металл, tпл 2230 °C, tкип ок. 4600 °C, плотность 13310 кг/м3; ниже 1740 °C устойчива гексагональная плотноупакованная α -модификация, выше – кубическая β-модификация. Теплоёмкость (при постоянном давлении, в стандартном состоянии) 25,7 Дж/(моль·К), теплопроводность при нагревании от 50 до 500 °C уменьшается от 22,3 до 20,5 Вт/(м·К), удельное электрич. сопротивление составляет 40,0·10–8 Ом·м (20 °C) и 170·10–8 Ом·м (1500 °C). Г. обладает высокими поперечным сечением захвата тепловых нейтронов 115·10–28 м2 и эмиссионной способностью – работа выхода электрона для α-модификации 3,53 эВ. Модуль Юнга равен 78 ГПа, коэф. Пуассона 0,37, твёрдость по Бринеллю 1700 МПа. Механич. свойства Г. зависят от содержания примесей и определяются способом его получения и рафинирования. Чистый Г. поддаётся прокатке, ковке, штамповке.
В компактном виде Г. устойчив на воздухе и лишь при нагревании до 500–600 °C начинает медленно окисляться, выше 700 °C образуется диоксид HfO2. Порошкообразный Г. пирофорен. До темп-ры 300 °C устойчив к действию паров воды. Не взаимодействует с растворами щелочей, до 100 °C – с HCl, H2SO4 и HNO3, но растворяется в смесях минер. кислот, особенно в присутствии фторид-ионов. При нагревании взаимодействует с галогенами, образуя тетрагалогениды. Образует нитрид HfN, карбид HfC, силициды HfSi, HfSi2 и др., которые принадлежат к тугоплавким соединениям.
К важнейшим соединениям Г. относятся диоксид HfO2, тетрафторид HfF4, тетрахлорид HfCl4, тетраиодид HfI4, гидроксиды общей формулы HfO2·xH2O, гидроксонитрат Hf(OH)2(NO3)2·H2O, гафнаты (соли гидроксидов), фторогафнаты (комплексы тетрафторида Г. с фторидами металлов).
Особенности
Физические характеристики
Гафний — солнечный, серебристый, податливый металл, который является стойким к коррозии и химически подобным цирконию (из-за того, что это имело то же самое число электронов валентности и быть в той же самой группе). Физические свойства гафниевых металлических образцов заметно затронуты примесями циркония, особенно ядерные свойства, как эти два элемента среди самого трудного, чтобы отделиться из-за их химического подобия.
Известная физическая разница между этими металлами — их плотность с наличием циркония о половине плотности гафния. Самые известные ядерные свойства гафния — его высокое тепловое поперечное сечение нейтронного захвата и что ядра нескольких различных гафниевых изотопов с готовностью поглощают два или больше нейтрона за штуку. В отличие от этого, цирконий практически очевиден для тепловых нейтронов, и он обычно используется для металлических компонентов ядерных реакторов – особенно claddings их прутов ядерного топлива.
Химические особенности
Гафний реагирует в воздухе, чтобы сформировать защитный фильм, который запрещает дальнейшую коррозию. Металл с готовностью не подвергается нападению кислотами, но может быть окислен с галогенами, или он может быть сожжен в воздухе. Как его родственный цирконий металла, точно разделенный гафний может загореться спонтанно в воздухе, оказав влияние, подобное полученному в Дыхании Дракона. Металл стойкий к сконцентрированным щелочам.
Химия гафния и циркония так подобна, что эти два не могут быть отделены на основе отличающихся химических реакций. Точки плавления и точки кипения составов и растворимости в растворителях — существенные различия в химии этих двойных элементов.
Изотопы
По крайней мере 34 изотопа гафния наблюдались, располагаясь в массовом числе от 153 до 186. Пять стабильных изотопов находятся в диапазоне 176 — 180. Полужизни радиоактивных изотопов колеблются только с 400 мс для Половины, к 2.0 petayears (10 лет) для самого стабильного, Половина
Ядерная Половина изомера была в центре противоречия в течение нескольких лет относительно его потенциального использования в качестве оружия.
Возникновение
Гафний, как оценивается, составляет приблизительно 5,8 частей на миллион верхней корки Земли массой. Это не существует как свободный элемент в природе, но сочтено объединенным в твердом растворе с цирконием в естественных составах циркония, таких как циркон, ZrSiO, у которого обычно есть приблизительно 1 – 4% Циркония заменили Половиной. Редко, отношение Половины/Циркония увеличивается во время кристаллизации, чтобы дать isostructural минерал ‘hafnon’ (Половина, Цирконий) SiO, с атомной Половиной> Цирконий. Старое (устаревшее) название множества циркона, содержащего необычно высокое содержание Половины, является alvite.
Основной источник циркона (и следовательно гафний) руды является тяжелыми минеральными месторождениями руды песков, пегматиты особенно в Бразилии и Малави и carbonatite вторжениях особенно Корона Полиметаллическая Залежь при Сварке горы, Западная Австралия. Потенциальный источник гафния — trachyte туфы, содержащие редкие гафниевые цирконом силикаты eudialyte или armstrongite, в Даббо в Новом Южном Уэльсе, Австралия.
Гафниевые запасы спроектированы, чтобы продлиться менее чем 10 лет, если мировые увеличения населения и требование растут.
Ссылки Править
- Химия и технология редких и рассеянных элементов. Ч. 2. Под ред К. Большакова. Изд. 2. М.: Высшая школа, 1976.
| H | He | |||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | |||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |
| Cs | Ba | * | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| Fr | Ra | ** | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Uub | Uut | Uuq | Uup | Uuh | Uus | Uuo | |
| * | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | |||
| ** | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr |
| Это незавершённая статья о химическом элементе.Вы можете помочь проекту, исправив и дополнив её. |
|
Выделить Гафний и найти в: |
|
- Страница 0 — краткая статья
- Страница — энциклопедическая статья
- Разное — на страницах: , , ,
Получение
Среднее содержание гафния в земной коре — около 4 г/т. Ввиду отсутствия у гафния собственных минералов и постоянного сопутствия его цирконию, его получают путём переработки циркониевых руд, где он содержится в количестве 2,5 % от веса циркония (циркон содержит 4 % HfO2, бадделеит — 4—6 % HfO2). В мире в год в среднем добывается около 70 тонн гафния, и объёмы его добычи пропорциональны объёмам добычи циркония
Интересна особенность скандиевого минерала — тортвейтита: в нём содержится гафния в процентном отношении гораздо больше, чем циркония, и это обстоятельство очень важно при переработке тортвейтита на скандий и концентрировании гафния из него.
Мировые ресурсы гафния
Цены на гафний 99 % в 2007 году в среднем составляли $780 за килограмм (по материалам infogeo.ru)
Мировые ресурсы гафния в пересчёте на двуокись гафния несколько превышают 1 миллион тонн. Структура распределения этих ресурсов выглядит приблизительно следующим образом:
- Австралия — более 630 тысяч тонн,
- ЮАР — почти 287 тысяч тонн,
- США — чуть более 105 тысяч тонн,
- Индия — около 70 тысяч тонн,
- Бразилия — 9,88 тысяч тонн.
Подавляющая часть сырьевой базы гафния в зарубежных странах представлена цирконом прибрежных морских россыпей.
Запасы гафния в России и СНГ, по оценкам независимых специалистов[Каких?], весьма велики[Насколько?] и в этом отношении при развитии гафниевой промышленности Россия способна стать безусловным лидером на мировом рынке гафния. Стоит также в связи с этим упомянуть весьма значительные ресурсы гафния на Украине. Основные гафнийсодержащие минералы в России и СНГ представлены лопаритом, цирконом, бадделеитом, редкометалльными щелочными гранитами.
Конкретные места применения сплавов и соединений
Кроме атомной промышленности, гафний востребован в металлургии, как легирующее вещество. Будучи тугоплавким металлом, он делает сплавы с кобальтом, никелем, титаном более прочными.
Благодаря этому HfCo нашли свое применение в турбостроении, а также нескольких видах промышленности: пищевой, нефтяной, химической.

Фото с завода турбостроения ОАО “Турбоатом”
HfNi добавление даже малой доли гафния в сплавы никеля положительно влияют на процессы сварки, швы получаются равномерными, незаметными и прочными, как и весь сплав. Дополнительно к этому повышается антикоррозийная способность материала.
Износостойкие нитридные покрытия, используемые на лопастях газовых турбин методом катодно-ионной бомбардировки, легируют, применяя катоды из циркония с гафнием (ЦГ20). Это в 3-4 раза увеличивает эксплуатационную пригодность.
HfТi легированный титан активно используется в судостроительстве, где активно применяется для деталей двигателей.
Сверхмощные постоянные магниты, например, тербия и самария не обходятся без присутствия Hf в своих составах.
Также славятся своей тугоплавкостью карбид гафния (20), считающийся аналогом карбида тантала (80).
Гафний значительно улучшает свойства алюминия. Всего 1% легирующего металла и можно говорить о прочном сплаве, повышенном пределе прочности при механических деформациях: сдвиг и кручение. Улучшается вибростойкость.
Благодаря высокой диэлектрической проницаемости Hf, может стать элементом следующего поколения, его оксиды должны заменить SiO в микроэлектронике. Интересный факт: Intel Penryn использует HfО в 45- нмпроцессорах.
Кроме того, высокий показатель преломления оксида гафния способствует тому, чтобы использовать его при изготовлении приборов ночного виденья (это специальные марки стекол).
Большое будущее ждет HfSi, который также обладает высокой диэлектрической проницаемостью (специальная керамика). Также в микроэлектронике требуются резистивные пленки с заданными параметрами: сплавы Hf и скандия – отличный материал для их производства.
Еще одна область, где активно применяется Hf – это производство многослойных рентгеновских зеркал. При их изготовлении силицид гафния не принимает прямого вхождения. Однако общий вид формулы HfB2 + SiC + Si говорит об активном участии бромида и кремния в создании прочных стекол. Подобная методика используется для выполнения высокопрочных пленок напылением или нанесением специальной кисточкой. Иногда данную методику так и называют поверхностное легирование.

Кельтий и гафний
Д. И. Менделеев предвидел будущее открытие элемента с порядковым номером 72. Но описать его свойства с той же обстоятельностью, как свойства тоже еще не открытых скандия, германия и галлия, Менделеев не мог. Стройность периодической системы необъяснимо нарушали лантан и следующие за ним элементы. Позже Богуслав Браунер, выдающийся чешский химик, друг и сподвижник Менделеева, предложил выделить 14 лантаноидов в самостоятельный ряд, а в основном «тексте» таблицы поместить их все в клетку лантана. В 1907 г. был открыт самый тяжелый лантаноид — лютеций. Впрочем, уверенности в том, чтолютеций — последний и самый тяжелый из редкоземельных элементов, у большинства химиков не было. Систематические поиски элемента № 72 начались лишь в XX в.
В 1911 г. Жорж Урбен сообщил об открытии нового элемента в рудах редких земель. В честь некогда населявших территорию Франции древних племен кельтов он назвал новый элемент кельтием. В 1922 г. Довилье, тоже француз, исследуя смесь редких земель, применил усовершенствованные методы рентгенографического анализа. Заметив в спектре две новые линии, Довилье решил, что эти линии принадлежат элементу с порядковым номером 72, и кельтий признали пятнадцатым лантаноидом.
Но радость открытия была недолгой. К этому времени электронная модель атома была разработана уже настолько, что на ее основе Нильс Бор смог объяснить периодичность строения атомов, объяснить особенности и порядок размещения элементов в периодической системе. На основании своих расчетов Бор заключил, что последним редкоземельным элементом должен быть элемент № 71 — лютеций, а элемент № 72, по его мнению, должен быть аналогом циркония.
Экспериментально проверить выводы Бора взялись сотрудники Института теоретической физики в Копенгагене Костер и Хевеши. С этой целью они исследовали несколько образцов циркониевых минералов. Остатки, полученные после выщелачивания кипящими кислотами норвежских и гренландских цирконов, были подвергнуты рентгено-спектральному анализу. Линии рентгенограммы совпали с характерными линиями, вычисленными для элемента № 72 по закону Мозли. На основании этого Костер и Хевеши в 1923 г. объявили об открытии элемента № 72 и назвали его гафнием в честь города, где было сделано это открытие (Hafnia — латинское название Копенгагена). В той же статье они отметили, что вещество, полученное Урбеном и Довилье, не могло быть элементом с порядковым номером 72, так как указанная ими длина волн линий рентгеновского спектра отличалась от теоретических значений намного больше, чем это допустимо для экспериментальной ошибки. А вскоре сотрудники того же института Вернер и Хансен показали, что спектральные линии, обнаруженные Урбеном, соответствовали линиям не гафния, а лютеция; в спектре же образцов, содержащих 90% гафния, не встречалось ни одной спектральной линии Урбена.
В 1924 г. в отчете Комиссии по атомным весам было однозначно указано, что элемент с порядковым номером 72 должен быть назван гафнием, как это предложили Костер и Хевеши. С тех пор названию «гафний» отдали предпочтение все ученые мира, кроме ученых Франции, которые до 1949 г. употребляли название «кельтий».
Производство
Тяжелые минеральные месторождения руды песков ильменита руд титана и рутила приводят к большей части добытого циркония, и поэтому также большей части гафния.
Цирконий — хороший ядерный металл оболочки топливного стержня с желательными свойствами очень низкого нейтронного поперечного сечения захвата и хорошей химической стабильности при высоких температурах. Однако из-за поглощающих нейтрон свойств гафния, гафниевые примеси в цирконии заставили бы его быть намного менее полезным для ядерно-реакторных заявлений. Таким образом почти полное разделение циркония и гафния необходимо для их использования в ядерной энергии. Производство циркония без гафния — главный источник для гафния.
Химические свойства гафния и циркония почти идентичны, который делает два трудными отделиться. Методы, сначала используемые — фракционная кристаллизация солей фторида аммония или фракционируемая дистилляция хлорида — не оказались подходящими для производства промышленных весов. После того, как цирконий был выбран в качестве материала для ядерных реакторных программ в 1940-х, метод разделения должен был быть развит. Жидко-жидкие процессы извлечения с большим разнообразием растворителей были развиты и все еще используются для производства гафния. Приблизительно половина всего гафниевого произведенного металла произведена как побочный продукт обработки циркония. Конечный продукт разделения гафниевый (IV) хлорид. Очищенный гафний (IV) хлорид преобразован в металл сокращением с магнием или натрием, как в процессе Kroll.
:: HfCl + 2 мг (1100 °C) → 2 MgCl + половина
Дальнейшая очистка произведена химической транспортной реакцией, развитой Аркелем и де Бое: В замкнутом сосуде гафний реагирует с йодом при температурах 500 °C, формируя гафний (IV) йодид; в вольфрамовой нити 1700 °C происходит обратная реакция, и йод и гафний освобождены. Гафний формирует твердое покрытие в вольфрамовой нити, и йод может реагировать с дополнительным гафнием, приводящий к устойчивому переворачивают.
:: Половина + 2 я (500 °C)
:: HfI (1700 °C) → половина + 2 я
Химические свойства
Гафний, как и тантал, — достаточно инертный материал из-за образования тонкой пассивной плёнки оксидов на поверхности. В целом химическая стойкость гафния гораздо больше, чем у его аналога — циркония.
Лучшим растворителем гафния является фтороводородная кислота (HF) или смесь фтороводородной и азотной кислот, а также царская водка.
При высоких температурах (свыше 1000 К) гафний окисляется на воздухе, а в кислороде сгорает. Реагирует с галогенами. По стойкости к кислотам подобен стеклу. Так же, как и цирконий, обладает гидрофобными свойствами (не смачивается водой).
Соединения двухвалентного гафния
HfBr2, дибромид гафния — твёрдое вещество чёрного цвета, самовоспламеняющееся на воздухе. Разлагается при температуре 400 °C на гафний и тетрабромид гафния. Получают диспропорционированием трибромида гафния в вакууме при нагревании.
Соединения трёхвалентного гафния
HfBr3, трибромид гафния — чёрно-синее твёрдое вещество. Диспропорционирует при 400 °C на дибромид и тетрабромид гафния. Получают восстановлением тетрабромида гафния при нагревании в атмосфере водорода или с металлическим алюминием.
Соединения четырёхвалентного гафния
- HfO2, диоксид гафния — бесцветные моноклинные кристаллы (плотность — 9,98 г/см³) или бесцветные тетрагональные кристаллы (плотность — 10,47 г/см³). Последние имеют Tпл 2900 °C, малорастворимы в воде, диамагнитны, обладают более осно́вным характером, чем ZrO2 и обнаруживают каталитические свойства. Получают нагреванием металлического гафния в кислороде или прокаливанием гидроксида, диоксалата, дисульфата гафния.
- Hf(OH)4, гидроксид гафния — белый осадок, растворяющийся при добавлении щёлочей и пероксида водорода с образованием пероксогафниатов. Получают глубоким гидролизом солей четырёхвалентного гафния при нагревании или обработкой растворов солей гафния(IV) щёлочами.
- HfF4, тетрафторид гафния — бесцветные кристаллы. Tпл 1025 °C, плотность — 7,13 г/см³. Растворим в воде. Получают термическим разложением соединения (NH4)2[HfF6] в токе азота при 300 °C.
- HfCl4, тетрахлорид гафния — белый порошок, сублимирующийся при 317 °C. Tпл 432 °C. Получают действием хлора на металлический гафний, карбид гафния или смесь оксида гафния(II) с углем.
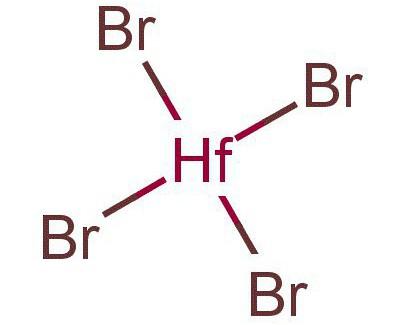
- HfBr4, тетрабромид гафния — бесцветные кристаллы. Сублимируются при 322 °C. Tпл 420 °C. Получают действием паров брома на нагретую до 500 °C смесь оксида гафния(II) с углем.
- HfI4, тетраиодид гафния — жёлтые кристаллы. Сублимирует при 427 °C и термически диссоциирует при 1400 °C. Получается взаимодействием гафния с иодом при 300 °C.
- Hf(HPO4)2, гидрофосфат гафния — белый осадок, растворимый в серной и фтороводородной кислотах. Получают обработкой растворов солей гафния(IV) ортофосфорной кислотой.
Соединения двух- трех- и четырехвалентного Hf
У данного элемента значение валентности является переменным и, в соответствии с различными величинами количества возможных х-ских связей, существуют несколько важнейших соединений гафния с другими веществами.
Двухвалентный дибромид гафния имеет темно-зеленый цвет. При температуре 400 градусов по Цельсию начинает процесс разложения с образованием Hf и HfBr4. В промышленности добывают диспропорционированием в вакууме HfBr3 под термическим воздействием.
Трехвалентный Hf представлен трибромидом (HfBr3) – это вещество черно-синего цвета, довольно твердое. Под воздействием температуры, равной 400 градусам по Цельсию, начинает диспропорционировать на два компонента тетрабромбиты гафния и дибромбиды. Способ получения заключается в восстановлении HfBr4 путем нагревания в водороде, возможно с добавлением алюминия.
К соединениям четырехвалентного гафния относится довольно большое количество соединений, а именно HfO2 – его диоксид, а также гидроксид с х-ской формулой Hf(OH)4. Тут же находятся третрахлорид (HfCl4), тетрафторид (HfF4), тетраиодид (HfI4) и вышеупомянутый тетрабомид гафния (HfBr), еще есть гидрофосфаты гафния (Hf(HPO4)2).
Commensal strain
Most standard microbiology texts list mammals, birds, reptiles, fish, soil, water, sewage, and foods as sources from which hafniae can be recovered.
The gastrointestinal tracts of animals, and in particular mammals, appear to be a very common ecologic habitat for hafniae. Paleomicrobiology investigations have identified H. alvei originating from intestinal mass samples and sediment collected from 12,000-year-old mastodon remains in Michigan and Ohio. In a study of 642 Australian mammals, Gordon and FitzGibbon found that H. alvei was the third most common enteric species identified, following Escherichia coli and E. cloacae. The isolation of H. alvei was significantly associated with recovery from marsupial carnivores and murid rodents.
Hafniae have also been recovered sporadically from the manure samples of pack animals collected from national park trails and from 7% of the grizzly and black bear specimens tested.
Among avian species, H. alvei has been frequently isolated from birds of prey, including falcons, owls, and turkey vultures; even high-altitude alpine accentors that have virtually no contact with humans have had Hafnia isolated from them, at frequencies ranging from 3% to 16%.
Other sources for H. alvei include reptiles (snakes and skinks), invertebrates, insects, fish, and bats.
История
В его отчете о Периодическом Законе Химических элементов, в 1869, Дмитрий Менделеев неявно предсказал существование более тяжелого аналога титана и циркония. Во время его формулировки в 1871, Менделеев полагал, что элементы были заказаны их атомными массами и помещенным лантаном (элемент 57) в пятне ниже циркония. Точное размещение элементов и местоположение недостающих элементов были сделаны, определив определенный вес элементов и сравнив химические и физические свойства.
Спектроскопия рентгена, сделанная Генри Мозли в 1914, показала прямую зависимость между спектральной линией и эффективным ядерным обвинением. Это привело к ядерному обвинению или атомному числу элемента, используясь устанавливать его место в пределах периодической таблицы. С этим методом Мозли определил число лантанидов и показал промежутки в последовательности атомного числа в номерах 43, 61, 72, и 75.
Открытие промежутков привело к обширному поиску недостающих элементов. В 1914 несколько человек требовали открытия после того, как Генри Мозли предсказал промежуток в периодической таблице для тогда неоткрытого элемента 72. Жорж Юрбен утверждал, что нашел элемент 72 в редких земных элементах в 1907 и издал его результаты на гафнии в 1911. Ни спектры, ни химическое поведение, подобранное к элементу, найденному позже, и поэтому его требование, не выключались после давнего противоречия. Противоречие состояло частично в том, потому что химики одобрили химические методы, которые привели к открытию гафния, в то время как физики полагались на использование нового метода спектроскопии рентгена, который доказал, что вещества, обнаруженные Юрбеном, не содержали элемент 72. К началу 1923 несколько физиков и химиков, таких как Нильс Бор и Чарльз Р. Бери предложили, чтобы элемент 72 напомнил цирконий и поэтому не был частью редкой земной группы элементов. Эти предложения были основаны на теориях Бора атома, спектроскопии рентгена Мосли и химических аргументах Фридриха Панета.
Поощренный этими предложениями и новым появлением в 1922 требований Юрбена, что элемент 72 был редким земным элементом, обнаруженным в 1911, Дирк Костер и Георг фон Хевези были мотивированы, чтобы искать новый элемент в рудах циркония. Гафний был обнаружен двумя в 1923 в Копенгагене, Дания, утвердив оригинальное предсказание 1869 года Менделеева. Это было в конечном счете найдено в цирконе в Норвегии посредством анализа спектроскопии рентгена. Место, где открытие имело место, привело к элементу, являющемуся названным по имени латинского имени «Копенгагена», Hafnia, родного города Нильса Бора. Сегодня, Отделение естественных наук Копенгагенского университета использует в его печати стилизованное изображение гафниевого атома.
Гафний был отделен от циркония до повторной перекристаллизации двойных фторидов аммония или калия Талем Valdemar Дженцен и фон Хевезей. Антон Эдуард ван Аркель и Ян Хендрик де Бое были первыми, чтобы подготовить металлический гафний мимолетным гафниевым паром tetra-йодида по горячей вольфрамовой нити в 1924. Сегодня этот процесс для отличительной очистки циркония и гафния все еще используется.
В 1923 четыре предсказанных элемента все еще отсутствовали в периодической таблице: 43 (технеций) и 61 (promethium) радиоактивные элементы и только присутствуют в незначительных количествах в окружающей среде, таким образом делая элементы 75 (рений) и 72 (гафний) последние два неизвестных нерадиоактивных элемента. Так как рений был обнаружен в 1925, гафний был рядом с последним элементом со стабильными изотопами, который будет обнаружен.
Область применения
В середине XX века для гафния были определены шесть существующих изотопов, при этом каждый из них имеет свою способность к поглощению илучения. Этот химический элемент начинают использовать для изготовления стержней-поглотителей при работе ядерных реакторов. Были открыты и другие полезные свойства этого металла. И в результате за 10 лет производство гафнияувеличилось с 40 кг/год до 60 тонн.
72-й химический элемент имеет высокую механическую прочность, отличается жаростойкостью и рядом других полезных свойств. Поэтому кроме ядерной энергетики гафний применяют для;
- производства особо прочных и жаростойких сплавов в металлургии;
- изготовления микросхем и электронных приборов;
- в производстве рентгеновских и телевизионных лучевых трубок;
- нанесения защитных покрытий от воздействия коррозии;
- изготовления электродов в лампах накаливания;
- сплав гафния с танталом используется в ракетной технике;
- в химическом производстве, как металл устойчивый к воздействию кислот, щелочей и других химически активных веществ.
Высокая прочность и плотность гафниевого материала способствовали его применению в оптике и аэрокосмических отраслях. 90% элемента химического №72 используется сегодня в ядерной энергетике, для изготовления элементов защиты.
Однако высокая стоимость гафния ограничивает его широкое применение и наиболее часто его используют в виде тонкого защитного покрытия на поверхности более дешевых металлов. Дороговизна этих металлов объясняется трудоемкостью его получения, а так же относительно небольшими и рассеянными запасами в земной коре.
Физические свойства
Гафний
Аномальный пик на экспериментальной кривой теплоёмкости гафния (1) и её разложение на дебаевскую составляющую (2) и аномальный остаток (3) — разность (1)-(2), слагающийся из больцмановских (4, 5) компонент
Гафний — блестящий серебристо-белый металл, твёрдый и тугоплавкий. В мелкодисперсном состоянии имеет тёмно-серый, почти чёрный цвет; матовый. Плотность при нормальных условиях — 13,31 г/см3. Температура плавления составляет 2506 K (2233 °C), кипит при 4876 K (4603 °C).
Гафний обладает высоким сечением захвата тепловых нейтронов — (115 барн у естественной смеси изотопов), тогда как у его химического аналога, циркония, сечение захвата на 3 порядка меньше, около 0,2 барн. В связи с этим цирконий, используемый для создания реакторных ТВЭЛов, должен быть тщательно очищен от гафния.
Температурная зависимость теплоёмкости гафния (аналогично теплоёмкости германия — Ge) имеет аномальный вид — на кривой теплоёмкости в диапазоне температур 60—80 К наблюдается пик, который не может быть объяснён никакой теорией, предполагающей гуковский закон сил, так как никакая суперпозиция эйнштейновских функций не даёт кривой с максимумом. В данном случае аномальный вид кривой теплоёмкости определяется суперпозицией колебательной (дебаевской) и диффузионной (больцмановской) компонент поглощения тепла кристаллической решеткой.
Изотопы гафния
Основная статья: Изотопы гафния
Известно более 30 изотопов гафния с массовыми числами от 153 до 188 (количество протонов 72, нейтронов от 81 до 116), и 26 ядерных изомеров. 5 изотопов стабильны и встречаются в природе (176Hf, 177Hf, 178Hf, 179Hf, 180Hf). Благодаря огромному периоду полураспада (период полураспада 2×1015 лет) в природе встречается один нестабильный изотоп, 174Hf.
Известен изомер гафния 178m2Hf
Он привлек внимание общественности в связи с исследованиями агентства оборонных исследований DARPA по принудительному распаду изомера с выделением значительных энергий. Начали высказываться гипотезы о возможности построения гафниевой бомбы (англ.)русск.
Тем не менее в научной среде ставится под сомнение как возможность управляемого взрывного распада 178m2Hf так и возможность получения изомера в количествах, необходимых для создания оружия.