Кристаллическая решетка алмаза и его свойства
Содержание:
Химические свойства
При обычных температурах углерод химически инертен, при достаточно высоких температурах соединяется со многими элементами, проявляет сильные восстановительные свойства. Химическая активность разных форм углерода убывает в ряду: аморфный углерод, графит, алмаз, на воздухе они воспламеняются при температурах соответственно выше 300—501 °C, 600—700 °C и 800—1000 °C.
Степень окисления бывает от −4 до +4. Сродство к электрону 1,27 эВ; энергия ионизации при последовательном переходе от С к С4+ соответственно 11,2604, 24,383, 47,871 и 64,19 эВ.
Неорганические соединения
Углерод реагирует со многими элементами. Соединения с неметаллами имеют свои собственные названия — метан, тетрафторметан.
Продуктами горения углерода являются CO и CO2 (монооксид углерода и диоксид углерода соответственно). Известен также неустойчивый недооксид углерода С3О2 (температура плавления −111 °C, температура кипения 7 °C) и некоторые другие оксиды (например, C12O9, C5O2, C12O12). Графит и аморфный углерод начинают реагировать с водородом при температуре 1200 °C, с фтором при 900 °C.
Углекислый газ реагирует с водой, образуя слабую угольную кислоту — H2CO3, которая образует соли — карбонаты. На Земле наиболее широко распространены карбонаты кальция (минеральные формы — мел, мрамор, кальцит, известняк и др.) и магния (минеральная форма доломит).
Графит с галогенами, щелочными металлами и др. веществами образует соединения включения. При пропускании электрического разряда между угольными электродами в атмосфере азота образуется циан. При высоких температурах взаимодействием углерода со смесью Н2 и N2 получают синильную кислоту:
- NH3+CH4 →Pt HCN+3H2↑{\displaystyle {\mathsf {NH_{3}+CH_{4}\ {\xrightarrow {Pt}}\ HCN+3H_{2}\uparrow }}}
Также такой же реакцией получают циан
- 2NH3+2CH4 →Pt (CN)2+7H2↑{\displaystyle {\mathsf {2NH_{3}+2CH_{4}\ {\xrightarrow {Pt}}\ (CN)_{2}+7H_{2}\uparrow }}}
При реакции углерода с серой получается сероуглерод CS2, известны также CS и C3S2. Получен селенид углерода CSe2. С большинством металлов углерод образует карбиды, например:
- 4Al+3C →t Al4C3{\displaystyle {\mathsf {4Al+3C\ {\xrightarrow {t}}\ Al_{4}C_{3}}}}
- Ca+2C →t CaC2{\displaystyle {\mathsf {Ca+2C\ {\xrightarrow {t}}\ CaC_{2}}}}
Важна в промышленности реакция углерода с водяным паром:
- C+H2O → CO↑+H2↑{\displaystyle {\mathsf {C+H_{2}O\ {\xrightarrow {}}\ CO\uparrow +H_{2}\uparrow }}}
При нагревании углерод восстанавливает оксиды металлов до металлов. Данное свойство широко используется в металлургической промышленности.
Органические соединения
Способность углерода образовывать полимерные цепочки порождает огромный класс соединений на основе углерода, которых значительно больше, чем неорганических, и изучением которых занимается органическая химия. Среди них наиболее обширные группы: углеводороды, белки, жиры, углеводы и др.
Соединения углерода составляют основу земной жизни, а их свойства во многом определяют спектр условий, в которых подобные формы жизни могут существовать. По числу атомов в живых клетках доля углерода около 25 %, по массовой доле — около 18 %.
Молекулы
О них стоит сказать в отдельности. Атомы обсуждаемого вещества могут соединяться, вследствие чего образуются сложные молекулы углерода. От насыщенных Na, С2 и Н2, между которыми слишком слабое притяжение, их отличает склонность конденсироваться в твердое состояние. Молекулы углерода могут оставаться в газообразном состоянии, только если поддерживать высокую температуру. Иначе вещество мгновенно затвердеет.
Некоторое время тому назад в США, в Берклеевской национальной лаборатории, была синтезирована новая форма твердого углерода. Это – С36. И его молекулу образует 36 углеродных атомов. Вещество образуется вместе с фуллеренами С60. Происходит это между двумя электродами графита, в условиях пламени дугового разряда. Ученые предполагают, что молекулы нового вещества обладают интересными химико-электрическими свойствами, которые пока не изучены.

Токсическое действие
Углерод поступает в окружающую среду в составе выхлопных газов автотранспорта, при сжигании угля на ТЭС, при открытых разработках угля, подземной его газификации, получении угольных концентратов и др. Концентрация углерода над источниками горения 100—400 мкг/м³, крупными городами 2,4—15,9 мкг/м³, сельскими районами 0,5 — 0,8 мкг/м³. С газоаэрозольными выбросами АЭС в атмосферу поступает (6—15)·109 Бк/сут 14СО2.
Высокое содержание углерода в атмосферных аэрозолях ведет к повышению заболеваемости населения, особенно верхних дыхательных путей и легких. Профессиональные заболевания — в основном антракоз и пылевой бронхит. В воздухе рабочей зоны ПДК, мг/м³: алмаз 8,0, антрацит и кокс 6,0, каменный уголь 10,0, технический углерод и углеродная пыль 4,0; в атмосферном воздухе максимальная разовая 0,15, среднесуточная 0,05 мг/м³.
Токсическое действие 14С, вошедшего в состав биологических молекул (особенно в ДНК и РНК), определяется его радиационным взаимодействием с β-частицами (14С (β) → 14N), приводящим к изменению химического состава молекулы. Допустимая концентрация 14С в воздухе рабочей зоны ДКА 1,3 Бк/л, в атмосферном воздухе ДКБ 4,4 Бк/л, в воде 3,0·104 Бк/л, предельно допустимое поступление через органы дыхания 3,2·108 Бк/год.
Как «упаковываются» слои кристаллической решетки?
Представим, есть слои А и В. При гексагональной упаковке слои можно укладывать несколькими способами, и при этом образуется гексагональная плотная упаковка или гранецентрированная кубическая упаковка. Соблюдается условие: каждый шар верхнего слоя касается 3х шаров нижнего. Шары 3го слоя расположены четко над шарами 1го слоя, шары 4го – над 2ыми и т.д.
Более сложное строение имеет гексагональная кубическая упаковка (ГКУ) – шары 3го слоя находятся над промежутками 2го слоя, и поэтому слои С и А имеют существенные различия.
Объемно центрированная кубическая упаковка складывается только одним способом: каждый шар находится в центре куба, вершины которого заняты другими шарами, т.е. каждый шар касается 8-ми соседних, при этом принято говорить о том, что каждый атом имеет координационное число, равное 8.
|
Гексагональная плотная упаковка |
Гранецентрированная кубическая упаковка |
Объемно центрированная кубическая упаковка |
Если говорить о координационных числах гранецентрированная кубическая упаковка и гексагональная плотная упаковка, то оно равно 12.
В пространстве можно эти типы упаковок представить так:
|
Гексагональная плотная упаковка |
Гранецентрированная кубическая упаковка |
Объемно центрированная кубическая упаковка |
Структура
Интересно, что электронные орбитали атома углерода не одинаковы. Они имеют разную геометрию. Все зависит от степени гибридизации. Есть три наиболее часто встречающиеся геометрии:
- Тетраэдрическая. Она образуется, когда происходит смешение трех р- и одного s-электронов. Такая геометрия атома углерода наблюдается у лонсдейлита и алмаза. Аналогичную структуру имеет метан и прочие углеводороды.
- Тригональная. Данную геометрию образует смешение двух р- и одной s-электронной орбитали. Еще один р-элемент не принимает участия в гибридизации, но он задействован при образовании π-связи с прочими атомами. Эта структура свойственна фенолу, графиту и прочим модификациям.
- Дигональная. Эта структура образуется вследствие смешения s- и р-электронов (по одному). Интересно, что выглядят электронные облака, как несимметричные гантели. Вытянуты они вдоль оного направления. Еще два р-электрона образуют пресловутые π-связи. Данная геометрия характерна для карбина.
Не так давно, в 2010 году, ученые из университета, который находится в Ноттингеме, открыли соединение, в котором сразу четыре атома оказались в одной плоскости. Его название – мономерный дилитио метандий.
Физические свойства
Карбин представляет собой мелкокристаллический порошок чёрного цвета (плотность 1,9÷2 г/см³), обладает полупроводниковыми свойствами. Получен в искусственных условиях из длинных цепочек атомов углерода, уложенных параллельно друг другу. Карбин — линейный полимер углерода. В молекуле карбина атомы углерода соединены в цепочки либо поочерёдно тройными и одинарными связями (полииновое строение), либо постоянно двойными связями (поликумуленовое строение). Это вещество впервые получено советскими химиками Ю.П.Кудрявцевым, А.М.Сладковым,В.И.Касаточкиным и В. В. Коршаком в начале 60-х гг в Институте элементоорганических соединений Академии наук СССР (ИНЭОС). Карбин обладает полупроводниковыми свойствами, причём под воздействием света его проводимость сильно увеличивается. На этом свойстве основано первое практическое применение — в фотоэлементах.
Применение
Графит используют в карандашной промышленности, но в смеси с глиной, для уменьшения его мягкости. Также его используют в качестве смазки при особо высоких или низких температурах. Его невероятно высокая температура плавления позволяет делать из него тигли для заливки металлов. Способность графита проводить электрический ток также позволяет изготавливать из него высококачественные электроды.
Алмаз благодаря исключительной твёрдости — незаменимый абразивный материал. Алмазным напылением обладают шлифовальные насадки бурмашин. Кроме этого, огранённые алмазы — бриллианты — используются в качестве драгоценных камней в ювелирных украшениях. Благодаря редкости, высоким декоративным качествам и стечению исторических обстоятельств бриллиант неизменно является самым дорогим драгоценным камнем. Исключительно высокая теплопроводность алмаза (до 2000 Вт/м·К) делает его перспективным материалом для полупроводниковой техники в качестве подложек для процессоров. Но относительно высокая себестоимость добычи алмазов ($97,47 за один карат) и сложность обработки алмаза ограничивают его применение в этой области.
В фармакологии и медицине широко используются различные соединения углерода: производные угольной кислоты и карбоновых кислот, различные гетероциклы, полимеры и другие соединения. Так, карболен (активированный уголь), применяется для абсорбции и выведения из организма различных токсинов; графит (в виде мазей) — для лечения кожных заболеваний; радиоактивные изотопы углерода — для научных исследований (радиоуглеродный анализ).
Углерод играет огромную роль в жизни человека. Его применения столь же разнообразны, как сам этот многоликий элемент. В частности, углерод является неотъемлемой составляющей стали (до 2,14 % масс.) и чугуна (более 2,14 % масс.)
Углерод является основой всех органических веществ. Любой живой организм состоит в значительной степени из углерода. Углерод — основа жизни. Источником углерода для живых организмов обычно является СО2 из атмосферы или воды. В результате фотосинтеза он попадает в биологические пищевые цепи, в которых живые существа поедают друг друга или останки друг друга и тем самым добывают углерод для строительства собственного тела. Биологический цикл углерода заканчивается либо окислением и возвращением в атмосферу, либо захоронением в виде угля или нефти.
Углерод в виде ископаемого топлива: угля и углеводородов (нефть, природный газ) — один из важнейших источников энергии для человечества.
Структура модификаций углерода алмаза
Основное состояние атома — это состояние с максимальным чистом неспаренных валентных электронов. Образованию химической связи между атомами углерода предшествует переход атомов в возбужденное состояние с максимальным числом неспаренных электронов по схеме 2s²2p² → 2s¹2p¹2p¹2p¹ . Потенциал ионизации атома углерода 11,256 эВ . Атомы углерода, соединяясь, образуют ковалентные связи (металлическая связь не может образоваться, так как слишком велика энергия отрыва электрона: сродство к электрону атома углерода — 1,27 эВ).
В результате sp³-гибридизации валентных электронов образуются четыре равноценные σ-связи под углом 109° 28′ друг к другу, направленные к вершинам правильного тетраэдра. Так связаны атомы в алмазе, лонсдейлите, метане, адамантане.
Атомы углерода ( алмаз )могут быть в состоянии, при котором происходит 2sp² — гибридизация электронов. Каждый атом углерода образует три σ-связи в одной плоскости под углом 120° относительно друг друга и, кроме того, дополнительно имеет по одному p-электрону. Вследствие перекрывания электронных облаков над и под плоскостью, в которой находятся атомы с σ-связями, р-электроны образуют π-связи. Так связаны атомы углерода в графите и ароматических соединениях.
Возможна также sp-гибридизация атомов углерода, при которой образуются две σ-связн под углом 180° друг к другу и в результате перекрывания двух орбиталей каждого из атомов углерода две π-связи. Так связаны атомы в карбине, ацетилене и его производных.
Существуют аморфные и частично кристаллические переходные формы углерода (сажа, кокс, стеклоуглерод и др.), и которых сочетаются различные типы связей.
Предыстория открытия
Вопрос о возможности существования форм углерода с sp-гибридизацией атомов неоднократно рассматривался теоретически. Ещё в 1885 году немецкий химик Адольф Байер пытался синтезировать цепочечный углерод из производных ацетилена ступенчатым методом. Однако попытка Байера получить полиин (соединение, содержащие в молекуле не менее трёх изолированных или сопряженных связей С≡С) оказалась неудачной, он получил углеводород, состоящий из четырёх молекул ацетилена, соединенных в цепочку, и оказавшийся чрезвычайно неустойчивым. Неустойчивость низших полиинов послужила Байеру основанием для создания теории напряжения, в которой он постулировал невозможность получения цепочечного углерода. Авторитет ученого охладил интерес исследователей к синтезу полиинов, и работы в этом направлении надолго прекратились.
Одномерная (линейная) форма углерода долгое время оставалась недостающим звеном в аллотропии углерода. Важным стимулом для возобновления работ в этой области явилось открытие в 1930-е годы представителей полиацетиленового ряда в природе. В некоторых растениях и низших грибах были обнаружены соединения полиинового ряда, содержащие до пяти сопряженных ацетиленовых группировок. Одними из первых, кто решился бросить вызов авторитету предшественников, стали химики лаборатории высокомолекулярных соединений ИНЭОС Алексей Михайлович Сладков, Юрий Павлович Кудрявцев. Проведённая ими работа привела к открытию новой линейной аллотропной формы углерода.
В 1959–1960 годах в лаборатории высокомолекулярных соединений ИНЭОС, возглавляемой академиком Коршаком, проводились систематические исследования реакции окислительного сочетания диацетиленовых соединений. Было установлено, что в присутствии солей двухвалентной меди эта реакция может быть проведена с любыми диацетиленовыми соединениями с образованием полимеров, элементарное звено которых сохраняет углеродный скелет исходного диацетилена. При этом сначала образуются полимерные полиацетилениды Cu(I). Этот вариант реакции окислительного сочетания был назван окислительной дегидрополиконденсацией. Ученые предположили, что в качестве мономера для такой поликонденсации можно взять и ацетилен. Действительно, при пропускании ацетилена в водно-аммиачный раствор соли Cu(II) быстро выпадал черный осадок. Именно этот путь привёл А.М.Сладкова, Ю.П.Кудрявцева, В.В.Коршака, и В.И.Касаточкина к открытию линейной формы углерода, которую назвали «карбин».
По словам первооткрывателей карбина, самым сложным для них было определить, какими же связями соединены в цепочку углеродные атомы. Это могли быть чередующиеся одинарные и тройные связи (–С≡С–С≡С–), только двойные связи (=С=С=С=С=), или и те, и другие одновременно. Лишь через несколько лет удалось доказать, что в полученном карбине двойных связей нет. Подтверждением полиинового строения цепочек послужило образование щавелевой кислоты при озонировании карбина.
Однако теория допускала существование и углеродного линейного полимера только с двойными связями, который и был получен в 1968 году В.П.Непочатых: встречный синтез (восстановлением полимерного гликоля) привёл к образованию линейного полимера углерода с кумуленовыми связями, который назвали поликумуленом. Доказательством наличия двойных связей в полученном веществе стал тот факт, что при озонировании поликумулена получается только диоксид углерода.
Итак, были получены две формы линейного углерода: полииновая (–С≡С–)n, или α-карбин, и поликумуленовая (=С=С=)n, или β-карбин. Авторами открытия было проведено детальное исследование структуры карбина различными методами, изучены его термодинамические и электрофизические свойства.
Известно несколько сообщений о находках карбиносодержащих углеродных веществ, сделанных А.Г.Виттакером в цейлонском графите и графите различных штатов США, В.И.Касаточкиным в природном алмазе, Ф.Дж.Рейтингером в графите Шри-Ланки, Г.В.Вдовыкиным в метеорите.
Детальные способы получения, физические и химические свойства карбина и его применения описаны в ряде работ Ю.П.Кудрявцева, С.Е.Евсюкова, М.Б.Гусевой,В.П.Бабаева, Т.Г.Шумиловой.
История
Углерод в виде древесного угля применялся в древности для выплавки металлов. Издавна известны аллотропные модификации углерода: алмаз и графит.
На рубеже XVII—XVIII вв. возникла теория флогистона, выдвинутая Иоганном Бехером и Георгом Шталем. Эта теория признавала наличие в каждом горючем теле особого элементарного вещества — невесомого флюида — флогистона, улетучивающегося в процессе горения. Так как при сгорании большого количества угля остается лишь немного золы, флогистики полагали, что уголь — это почти чистый флогистон. Именно этим объясняли, в частности, «флогистирующее» действие угля, — его способность восстанавливать металлы из «известей» и руд. Поздние флогистики (Реомюр, Бергман и другие) уже начали понимать, что уголь представляет собой элементарное вещество. Однако впервые таковым «чистый уголь» был признан Антуаном Лавуазье, исследовавшим процесс сжигания в воздухе и кислороде угля и других веществ. В книге Гитона де Морво, Лавуазье, Бертолле и Фуркруа «Метод химической номенклатуры» (1787) появилось название «углерод» (carbone) вместо французского «чистый уголь» (charbone pur). Под этим же названием углерод фигурирует в «Таблице простых тел» в «Элементарном учебнике химии» Лавуазье.
В 1791 году английский химик Теннант первым получил свободный углерод; он пропускал пары фосфора над прокалённым мелом, в результате чего образовывались фосфат кальция и углерод. То, что алмаз при сильном нагревании сгорает без остатка, было известно давно. Ещё в 1751 год германский император Франц I согласился дать алмаз и рубин для опытов по сжиганию, после чего эти опыты даже вошли в моду. Оказалось, что сгорает лишь алмаз, а рубин (окись алюминия с примесью хрома) выдерживает без повреждения длительное нагревание в фокусе зажигательной линзы. Лавуазье поставил новый опыт по сжиганию алмаза с помощью большой зажигательной машины и пришёл к выводу, что алмаз представляет собой кристаллический углерод. Второй аллотроп углерода — графит — в алхимическом периоде считался видоизменённым свинцовым блеском и назывался plumbago; только в 1740 году Потт обнаружил отсутствие в графите какой-либо примеси свинца. Шееле исследовал графит (1779) и, будучи флогистиком, счёл его сернистым телом особого рода, особым минеральным углём, содержащим связанную «воздушную кислоту» (СО2) и большое количество флогистона.
Двадцать лет спустя Гитон де Морво путём осторожного нагревания превратил алмаз в графит, а затем в угольную кислоту.
Происхождение названия
В XVII—XIX веках в русской химической и специализированной литературе иногда применялся термин «углетвор» (Шлаттер, 1763; Шерер, 1807; Севергин, 1815); с 1824 года Соловьёв ввёл название «углерод». Соединения углерода имеют в названии часть карбо(н) — от лат. carbō (род. п. carbōnis) «уголь».
Графит
Теперь можно более подробно рассказать о самых известных модификациях такого вещества, как углерод.
Графит – это самородный минерал со слоистой структурой. Вот его особенности:
- Он отлично проводит ток.
- Является относительно мягким веществом из-за своей низкой твердости.
- При нагревании в отсутствие воздуха проявляет устойчивость.
- Не плавится.
- На ощупь жирный, скользкий.
- В природном графите содержится 10-12% примесей. Как правило, это окислы железа и глины.
Если говорить о химических свойствах, то стоит отметить, что с солями и щелочными металлами это вещество образует так называемые соединения включения. Еще графит при высокой температуре реагирует с кислородом, сгорая до углекислого газа. Но вот контакт с неокисляющими кислотами никакого результата за собой не влечет – это вещество в них просто не растворяется.
Применяют графит в самых разных сферах. Его используют при изготовлении футеровочных плит и плавильных тиглей, в производстве нагревательных элементов и электродов. Без участия графита невозможно получить синтетические алмазы. Также он играет роль замедлителя нейтронов в ядерных реакторах. И, конечно же, из него делают стержни для карандашей, мешая с каолином. И это лишь часть сфер, где он используется.

Структура карбина[править]
Зигзагообразное строение углеродных цепочек -a и -b карбине
При использовании высокоэнергетических методов исследований возможен переход карбина в другие формы углерода. При этом представления о структуре карбина длительное время были несовершенством.
Авторы открытия карбина пришли к модели его кристаллической структуры в виде совокупности цепочек кумуленового или полиинового типа, упакованных в кристаллы за счет вандерваальсовых сил. Цепочки предполагали прямолинейными, т.к. каждый атом углерода находится в состоянии sp-гибридизации.
При полном отсутствии химических межмолекулярных сшивок между цепочками изначально получается постулированный карбин, т.е. совокупность химически не связанных прямолинейных цепочек. Поэтому параметр c кристаллической ячейки должен иметь два значения для исследуемого карбина соответственно – 2,9 и 1,3 . Реальные же значения этого параметра изменялись от 7,68 до
15,36 .
Это несоответствие было устранено Р.Хайманном, который предположил, что внутри цепочек есть зигзаги, причем углы этих зигзагов равны 120°, а расстояния между ними (длина прямой части цепочки) определяются статистически. Зигзаги в цепочках завершают период идентичности в кристалле. Скорее всего, в реальных объектах отдельные углеродные цепочки сшиты друг с другом, причем сшивки расположены с определённой частотой и периодичностью и протяженность линейных фрагментов разная.
В настоящее время установлено, что структура карбина действительно образуют атомы углерода, собранные в цепочки двойными связями (-карбин) или чередующимися одинарными и тройными связями (-карбин). Полимерные цепочки имеют химически активные концы ( несут локализованный отрицательный заряд) и имеют изгибы с цепочечными вакансиями, где цепочки соединяются между собой за счет перекрывания -орбиталей атомов углерода.
Важное значение для образования сшивок имеет присутствие примесей металлов, как Fe, K. Доказательством присутствия зигзагов в линейной углеродной цепочке было получено в теоретической работе Коршака: результаты его расчета хорошо согласуются с экспериментальным ИК-спектром карбина.. В результате последующих исследований структуры кристаллического карбина была предложена модель элементарной его ячейки
Согласно этой модели элементарная ячейка карбина составлена параллельными цепочками углерода, которые имеют зигзаги и в результате чего ячейка становится двуслойной. Толщина одного слоя цепочки состоит из шести атомов углерода. В нижнем слое цепочки атомы плотно упакованы и расположены в центре и по углам гексагона, в то время как в верхнем слое центральная цепочка отсутствует, а в образовавшейся вакансии могут располагаться атомы примеси. Это могут быть катализаторы кристаллизации карбина. Такая модель дает основания к раскрытию феномена карбина, а также объясняет, в какой конфигурации может стабилизироваться в общем случае неустойчивая совокупность линейных цепочек углерода
В результате последующих исследований структуры кристаллического карбина была предложена модель элементарной его ячейки. Согласно этой модели элементарная ячейка карбина составлена параллельными цепочками углерода, которые имеют зигзаги и в результате чего ячейка становится двуслойной. Толщина одного слоя цепочки состоит из шести атомов углерода. В нижнем слое цепочки атомы плотно упакованы и расположены в центре и по углам гексагона, в то время как в верхнем слое центральная цепочка отсутствует, а в образовавшейся вакансии могут располагаться атомы примеси. Это могут быть катализаторы кристаллизации карбина. Такая модель дает основания к раскрытию феномена карбина, а также объясняет, в какой конфигурации может стабилизироваться в общем случае неустойчивая совокупность линейных цепочек углерода.
Химические свойства
При обычных температурах углерод химически инертен, при достаточно высоких температурах соединяется со многими элементами, проявляет сильные восстановительные свойства. Химическая активность разных форм углерода убывает в ряду: аморфный углерод, графит, алмаз, на воздухе они воспламеняются при температурах соответственно выше 300—501 °C, 600—700 °C и 800—1000 °C.
Степень окисления бывает от −4 до +4. Сродство к электрону 1,27 эВ; энергия ионизации при последовательном переходе от С к С4+ соответственно 11,2604, 24,383, 47,871 и 64,19 эВ.
Неорганические соединения
Углерод реагирует с неметаллами при нагревании
| Реагент | Уравнение | Описание |
|---|---|---|
| O2{\displaystyle {\ce {O2}}} | 2C+O2→t2CO↑{\displaystyle {\ce {2C + O2 -> 2CO ^}}} 2CO+O2→t2CO2↑{\displaystyle {\ce {2CO + O2 -> 2CO2 ^}}} | Продуктами горения углерода являются CO и CO2 (монооксид углерода и диоксид углерода соответственно).
Известен также неустойчивый недооксид углерода С3О2 (температура плавления −111 °C, температура кипения 7 °C) и некоторые другие оксиды (например, C12O9, C5O2, C12O12). Углекислый газ реагирует с водой, образуя слабую угольную кислоту — H2CO3, которая образует соли — карбонаты.
На Земле наиболее широко распространены карбонаты кальция (минеральные формы — мел, мрамор, кальцит, известняк и др.) и магния (минеральная форма доломит). |
| S{\displaystyle {\ce {S}}} Se{\displaystyle {\ce {Se}}} | C+S→tCS2{\displaystyle {\ce {C + S -> CS2}}} C+Se→tCSe2{\displaystyle {\ce {C + Se -> CSe2}}} | При реакции углерода с серой получается сероуглерод CS2, известны также CS и C3S2.
Получен селенид углерода CSe2. |
| H2{\displaystyle {\ce {H2}}} F2{\displaystyle {\ce {F2}}} | C+2H2→t,P,catCH4↑{\displaystyle {\ce {C + 2H2 -> CH4 ^}}} C+2F2→>900°CCF4{\displaystyle {\ce {C + 2F2 -> CF4}}} | Из углерода можно получить метан в присутствии оксидов железа, однако гораздо практичнее получать метан из синтез газа.
Графит и аморфный углерод начинают реагировать с водородом при температуре 1200 °C, с фтором при 900 °C. |
| Si{\displaystyle {\ce {Si}}} | C+Si→tSiC{\displaystyle {\ce {C + Si -> SiC}}} | При сплавлении получается карбид кремния. |
| N2{\displaystyle {\ce {N2}}} | 2C+N2→t(CN)2{\displaystyle {\ce {2C + N2 -> (CN)2}}} | При пропускании электрического разряда между угольными электродами в атмосфере азота образуется циан.
При высоких температурах взаимодействием углерода со смесью Н2 и N2 получают синильную кислоту:
Такой же реакцией получают циан
|
| P{\displaystyle {\ce {P}}} | Не реагирует |
Графит с галогенами, щелочными металлами и др. веществами образует соединения включения.
| Уравнение | Описание |
|---|---|
| C+H2O→tCO↑+H2↑{\displaystyle {\ce {C + H2O -> CO ^ + H2 ^}}} | Важна в промышленности реакция углерода с водяным паром для получения синтез газа |
| 3C+S+2KNO3→tK2S+3CO2↑+N2↑{\displaystyle {\ce {3C + S + 2KNO3 -> K2S + 3CO2 ^ + N2 ^}}} | Горение чёрного пороха. |
| 5C+4KNO3⟶2K2CO3+3CO2↑+2N2↑{\displaystyle {\ce {5C + 4KNO3 -> 2K2CO3 + 3CO2 ^ + 2N2 ^}}} C+2KNO3⟶2KNO2+CO2↑{\displaystyle {\ce {C + 2KNO3 -> 2KNO2 + CO2 ^}}} | С калиевой селитрой углерод проявляет восстановительные свойства. |
| 3C+BaSO4⟶BaS+2CO↑+CO2↑{\displaystyle {\ce {3C + BaSO4 -> BaS + 2CO ^ + CO2 ^}}} | Восстанавливает сульфат бария |
| C+MxOy→tM+CO↑{\displaystyle {\ce {C + M_{x}O_{y}-> M + CO ^}}} C+CaO→2500°CCaC2+CO↑{\displaystyle {\ce {C + CaO -> CaC2 + CO ^}}} | При сплавлении углерод восстанавливает оксиды металлов до металлов. Данное свойство широко используется в металлургической промышленности. |
С большинством металлов углерод образует карбиды, например:
- 4Al+3C→tAl4C3{\displaystyle {\ce {4Al + 3C -> Al4C3}}}
- Ca+2C→tCaC2{\displaystyle {\ce {Ca + 2C -> CaC2}}}
Органические соединения
Способность углерода образовывать полимерные цепочки порождает огромный класс соединений на основе углерода, которых значительно больше, чем неорганических, и изучением которых занимается органическая химия. Среди них наиболее обширные группы: углеводороды, белки, жиры, углеводы и др.
Соединения углерода составляют основу земной жизни, а их свойства во многом определяют спектр условий, в которых подобные формы жизни могут существовать. По числу атомов в живых клетках доля углерода около 25 %, по массовой доле — около 18 %.
Токсическое действие
Углерод поступает в окружающую среду в составе выхлопных газов автотранспорта, при сжигании угля на ТЭС, при открытых разработках угля, подземной его газификации, получении угольных концентратов и др. Концентрация углерода над источниками горения 100—400 мкг/м³, крупными городами 2,4—15,9 мкг/м³, сельскими районами 0,5 — 0,8 мкг/м³. С газоаэрозольными выбросами АЭС в атмосферу поступает (6—15)⋅109 Бк/сут 14СО2.
Высокое содержание углерода в атмосферных аэрозолях ведет к повышению заболеваемости населения, особенно верхних дыхательных путей и лёгких. Профессиональные заболевания — в основном антракоз и пылевой бронхит. В воздухе рабочей зоны ПДК, мг/м³: алмаз 8,0, антрацит и кокс 6,0, каменный уголь 10,0, технический углерод и углеродная пыль 4,0; в атмосферном воздухе максимальная разовая 0,15, среднесуточная 0,05 мг/м³.
Токсическое действие 14С, вошедшего в состав биологических молекул (особенно в ДНК и РНК), определяется его радиационным взаимодействием с β-частицами (14С (β) → 14N), приводящим к изменению химического состава молекулы. Допустимая концентрация 14С в воздухе рабочей зоны ДКА 1,3 Бк/л, в атмосферном воздухе ДКБ 4,4 Бк/л, в воде 3,0⋅104 Бк/л, предельно допустимое поступление через органы дыхания 3,2⋅108 Бк/год.
Формула вещества
Состоит алмаз полностью из углерода. Этого элемента содержится около 0,15% в Земной коре. Атомный номер вещества — 6, что говорит о количестве протонов в ядре. Соответственно, у алмазов, которые полностью состоят из углерода, то есть являются аллотропной формой этого вещества, атомный номер такой же.
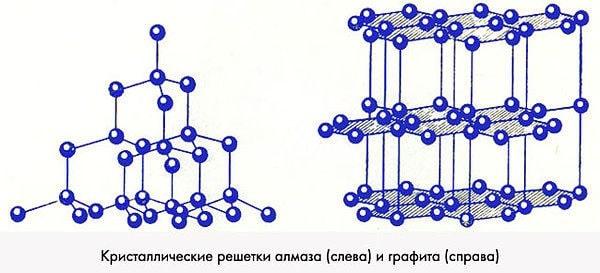 Расположение атомов у алмаза и графита
Расположение атомов у алмаза и графита
Такое понятие, как форма аллотропной модификации, означает, что из простого вещества, например, углерода, могут формироваться другие простые вещества, которые будут отличаться между собой свойствами и строением атомов. То есть содержание одно, а форма и вид — абсолютно разные, взять хотя бы противоположности: графит и алмаз. При этом углерод — один из немногих веществ, которое имеет несколько форм модификаций.
Выделяют такие вещества, которые состоят только из углерода:
- алмаз;
- графит;
- карбин;
- лонсдейлит;
- фуллерены;
- углеродные нанотрубки для изготовления микроволокон;
- графен;
- уголь, сажа.
Интересным вопросом для ученых является вопрос, можно ли превратить одну аллотропную модификацию в другую. Как раз этим они и занимаются по отношению к графиту и другим веществам из этой группы. Поскольку стоимость алмаза — самая высокая, а цена других модификаций ниже. Пока процесс возможен только лишь в обратную сторону: если алмаз нагреть без воздуха до температуры свыше 500 градусов по Цельсию, то камень взорвется и превратится в графит. При этом дальнейшее плавление камня показывает аномальные результаты, отличные от других веществ. А вот в обратном направлении реакция не происходит.
Разница между модификациями объясняется строением кристаллической решетки вещества. Химическая формула тут не играет никакой роли. Вся суть заключается в пространственной конфигурации атомов углерода и связи между ними. Так, в строении алмаза решетка имеет кубическое строение.
Связь между атомами — самая прочная, с точки зрения химии, ковалентная. При этом кубическая система использует всего 18 атомов и считается самой плотной формой упаковки этих частиц. Поэтому алмаз и является самым твердым веществом планеты.
В центрах граней тетраэдра также располагаются атомы, связанные между собой ковалентно. А вот если рассматривать тот же графит, то в его кристаллической решетке часть связей ковалентная, а часть дисульфидная, которая имеет свойство разрываться. Вследствие этого электроны могут мигрировать, и вещество получает металлические свойства.
Но это разбор атомных форм углерода, поскольку именно атомы и формируют кристаллическую решетку. А вот недавно ученые обнаружили и молекулярные формы вещества в составе фуллеренов, многогранников из углерода. Сейчас обнаружили новые молекулярные соединения с содержанием углерода — от С60 до С540, над которыми проводятся исследования.
На основе формулы, а также конфигурации атомов, ученые пытаются воссоздать картину в лабораторных условиях. В природе алмазы находят в кимберлитовых и лампроитовых трубках, а также на россыпях. Камни формируются миллионы лет в определенных условиях с участием магматических пород, сейсмоактивности, а также под действием высоких температур.
Существует и версия о занесении алмаза вместе с метеоритами, поскольку углерода достаточно много в космическом пространстве. А также одну из его модификаций — лосдейлит — ученые обнаружили в составе метеоритов.
На сегодняшний день алмазы изготавливают такими способами:
- Под давлением и высокой температурой в специальных машинах. Ученые добиваются от графита образования новых ковалентных связей. Такой тип камней называют HPHT.
- Пленочный способ происходит также с участием графита, осаждение которого происходит под действием паров метана.
- Производство камней вследствие взрывного синтеза.
Даже несмотря на то, что все знают формулу бриллианта, ну или его не ограненного вещества (алмаза), никто из ученых не смог с точностью воспроизвести камень с таким же строением кристаллической решетки, как это сделала природа. Поэтому стоимость камня держится на высоком уровне, а добыча из недр Земли не прекращается.
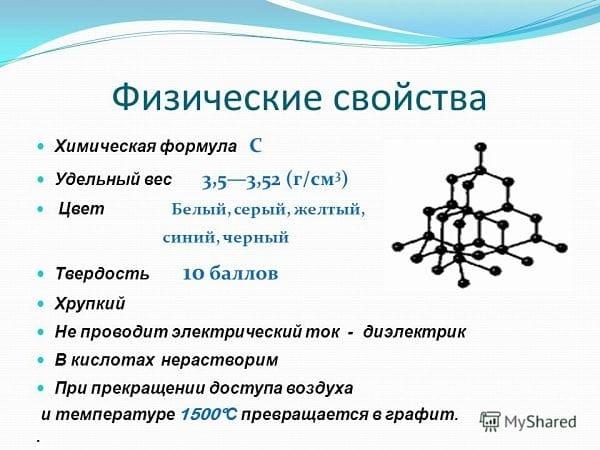 Физические свойства алмазов
Физические свойства алмазов