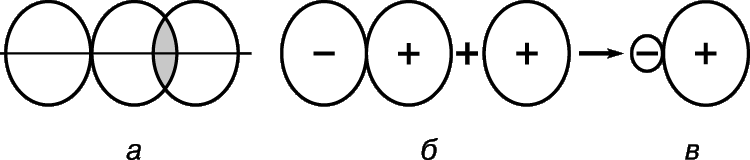Стекло
Содержание:
- Ссылки
- Металлы Яна — Теллера
- Является ли стекло жидкостью?
- В природе
- Молекулярно-кинетическая теория
- Низкотемпературные состояния
- Твердое ли стекло?
- Аморфное состояние — вещество
- Еще редакция Сlutch cоветует прочитать:
- Такое невесомое, но такое тяжелое
- Сверхкритические жидкости (флюиды)
- Получение
- Разница между аморфными и кристаллическими твердыми веществами
- Вырожденный газ
- Основные свойства стекла
Ссылки
- http://bse.sci-lib.com/article081157.html
- http://www.chemport.ru/chemical_encyclopedia_article_3544.html
- http://bse.sci-lib.com/article106117.html
- http://dic.academic.ru/dic.nsf/ruwiki/120066
- http://dic.academic.ru/dic.nsf/enc3p/211226
- A.K. Varshneya. Fundamentals of inorganic glasses. Society of Glass Technology, Sheffield, 682pp. (2006)
- Ожован. Топологические характеристики связей в окисных системах SiO2 и GeO2 при переходе стекло-жидкость. ЖЭТФ, 130 (5) 944—956 (2006)
- http://dic.academic.ru/dic.nsf/ruwiki/120066
- Черняк Людмила Менделевна. Из истории стекла
- Разновидность строительного стекла
Металлы Яна — Теллера

Ученые во главе с химиком Космасом Прассидесом экспериментировали, вводя рубидий в структуру молекул углерода-60 (в простом народе известных под фуллеренами), что приводило к тому, что фуллерены принимают новую форму. Этот металл назван в честь эффекта Яна — Теллера, который описывает, как давление может изменять геометрическую форму молекул в новых электронных конфигурациях. В химии давление достигается не только за счет сжатия чего-то, но и за счет добавления новых атомов или молекул в ранее существовавшую структуру, изменяя ее основные свойства.
Когда исследовательская группа Прассидеса начала добавлять рубидий в молекулы углерода-60, молекулы углерода изменялись от изоляторов к полупроводникам. Тем не менее из-за эффекта Яна — Теллера молекулы пытались остаться в старой конфигурации, что создавало вещество, которое пыталось быть изолятором, но обладало электрическими свойствами сверхпроводника. Переход между изолятором и сверхпроводником никогда не рассматривался, пока не начались эти эксперименты.
Интересно в металлах Яна — Теллера то, что они становятся сверхпроводниками при высоких температурах (-135 градусов по Цельсию, а не при 243,2 градуса, как обычно). Это приближает их к приемлемым уровням для массового производства и экспериментов. Если все подтвердится, возможно, мы будем на шаг ближе к созданию сверхпроводников, работающих при комнатной температуре, что, в свою очередь, произведет революцию во многих отраслях нашей жизни.
Является ли стекло жидкостью?
Рассмотрим характеристики жидкостей и твердых тел. Жидкости имеют определенный объем, но они принимают форму своего контейнера. Твердое тело имеет фиксированную форму, а также фиксированный объем. Таким образом, чтобы стекло было жидким, оно должно было бы иметь возможность изменять свою форму или течение. Стекло течет? Нет!
Вероятно, идея о том, что стекло — это жидкость, возникла из наблюдения за старым оконным стеклом, которое в нижней части толще, чем сверху. Это создает впечатление, что гравитация могла вызвать медленное течение стекла.
Тем не менее, стекло делает не течь со временем! У более старого стекла есть изменения в толщине из-за способа, которым это было сделано. Выдувному стеклу будет не хватать однородности, потому что пузырьки воздуха, используемые для разбавления стекла, не будут равномерно расширяться через первоначальный стеклянный шар. Стекло, которое вращалось при нагревании, также не имеет равномерной толщины, потому что первоначальный стеклянный шарик не является идеальной сферой и не вращается с идеальной точностью. Стекло наливали, когда расплавленный стал толще на одном конце и тоньше на другом, потому что стекло начало охлаждаться в процессе разливки. Имеет смысл, что более толстое стекло будет либо образовываться на дне пластины, либо будет ориентировано таким образом, чтобы сделать стекло максимально устойчивым.
Современное стекло изготавливается таким образом, что имеет ровную толщину. Когда вы смотрите на современные стеклянные окна, вы никогда не увидите, чтобы стекло стало более толстым в нижней части. Можно измерить любое изменение толщины стекла с помощью лазерных методов; таких изменений не наблюдалось.
В природе
В природе стекла существуют в составе вулканических пород, которые быстро охладились из жидкой магмы при соприкосновении с холодным воздухом или водой. Иногда встречаются стёкла в составе метеоритов, расплавившихся при движении в атмосфере.
Когда была установлена идентичность строения, состава и свойств обычного силикатного стекла многим минералам, последние стали квалифицироваться как разновидности его природного аналога, именуясь в соответствии с условиями формирования: некристаллизовавшиеся производные быстро остывшей лавы — вулканическим стеклом (пемза, обсидианы, пехштейн, базальты и др.), а образовавшиеся из земной горной породы в результате удара космического тела — метеоритным (молдавит).
Молекулярно-кинетическая теория
Все молекулы состоят из мельчайших частиц – атомов. Все открытые на настоящий момент атомы собраны в таблице Менделеева.
Атом – это мельчайшая, химически неделимая частица вещества, сохраняющая его химические свойства. Атомы соединяются между собой химическими связями. Ранее мы уже рассматривали виды химических связей и их свойства. Обязательно озучите теорию по теме: Типы химических связей, перед тем, как изучать эту статью!
Теперь рассмотрим, как могут соединяться частицы в веществе.
В зависимости от расположения частиц друг относительно друга свойства образуемых ими веществ могут очень сильно различаться. Так, если частицы расположены друг от друга далеко (расстояние между частицами намного больше размеров самих частиц), между собой практически не взаимодействуют, перемещаются в пространстве хаотично и непрерывно, то мы имеем дело с газом.
Если частицы расположены близко друг к другу, но хаотично, больше взаимодействуют между собой, совершают интенсивные колебательные движения в одном положении, но могут перескакивать в другое положение, то это модель строения жидкости.
Если же частицы расположены близко к друг другу, но более упорядоченно, и больше взаимодействуют между собой, а двигаются только в пределах одного положения равновесия, практически не перемещаясь в другиеположения, то мы имеем дело с твердым веществом.
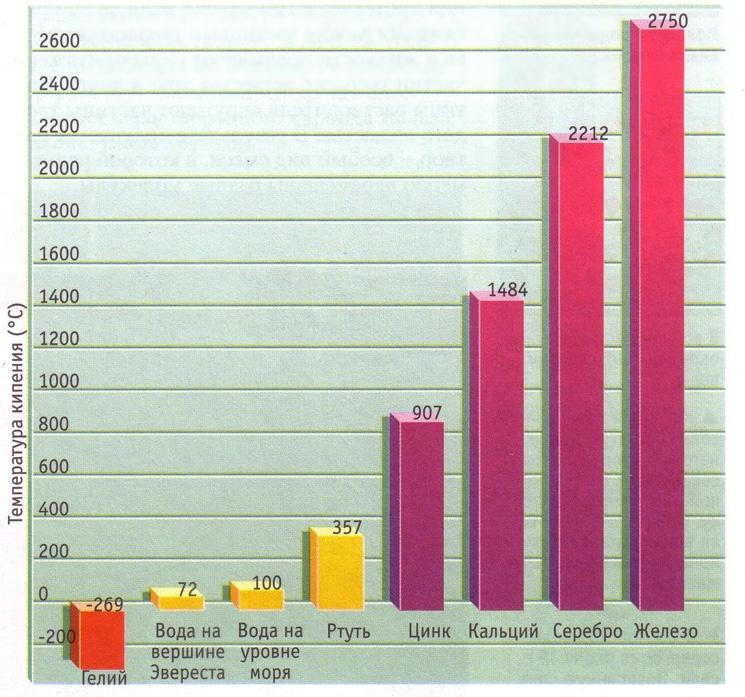
Большинство известных химических веществ и смесей могут существовать в твердом, жидком и газообразном состояниях. Самый простой пример – это вода. При нормальных условиях она жидкая, при 0 оС она замерзает – переходит из жидкого состояния в твердое, и при 100 оС закипает – переходит в газовую фазу – водяной пар. При этом многие вещества при нормальных условиях – газы, жидкости или твердые. Например, воздух – смесь азота и кислорода – это газ при нормальных условиях. Но при высоком давлении и низкой температуре азот и кислород конденсируются и переходят в жидкую фазу. Жидкий азот активно используют в промышленности. Иногда выделяют плазму, а также жидкие кристаллы, как отдельные фазы.
Очень многие свойства индивидуальных веществ и смесей объясняются взаимным расположением частиц в пространстве друг относительно друга!
Данная статья рассматривает свойства твердых тел, в зависимости от их строения. Основные физические свойства твердых веществ: температура плавления, электропроводность, теплопроводность, механическая прочность, пластичность и др.
Температура плавления – это такая температура, при которой вещество переходит из твердой фазы в жидкую, и наоборот.
Пластичность – это способность вещества деформироваться без разрушения.
Электропроводность – это способность вещества проводить ток.
Ток – это упорядоченное движение заряженных частиц. Таким образом, ток могут проводить только такие вещества, в которых присутствуют подвижные заряженные частицы. По способности проводить ток вещества делят на проводники и диэлектрики. Проводники – это вещества, которые могут проводить ток (т.е. содержат подвижные заряженные частицы). Диэлектрики – это вещества, которые практически не проводят ток.
В твердом веществе частицы вещества могут располагаться хаотично, либо более упорядоченно. Если частицы твердого вещества расположены в пространстве хаотично, вещество называют аморфным. Примеры аморфных веществ – уголь, слюдяное стекло.
Аморфный бор
Если частицы твердого вещества расположены в пространстве упорядоченно, т.е. образуют повторяющиеся трехмерные геометрические структуры, такое вещество называют кристаллом, а саму структуру – кристаллической решеткой. Большинство известных нам веществ – кристаллы. Сами частицы при этом расположены в узлах кристаллической решетки.
Кристаллические вещества различают, в частности, по типу химической связи между частицами в кристалле – атомные, молекулярные, металлические, ионные; по геометрической форме простейшей ячейки кристаллической решетки – кубическая, гексагональная и др.
В зависимости от типа частиц, образующих кристаллическую решетку, различают атомную, молекулярную, ионную и металлическую кристаллическую структуру.
Низкотемпературные состояния
Сверхтекучесть
Основная статья: Сверхтекучесть
Способность вещества в особом состоянии (квантовой жидкости), возникающем при понижении температуры к абсолютному нулю (термодинамическая фаза), протекать через узкие щели и капилляры без трения. До недавнего времени сверхтекучесть была известна только у жидкого гелия, однако в последние годы сверхтекучесть была обнаружена и в других системах: в разреженных атомных бозе-конденсатах, твёрдом гелии.
Сверхтекучесть объясняется следующим образом. Поскольку атомы гелия являются бозонами, квантовая механика допускает нахождение в одном состоянии произвольного числа частиц. Вблизи абсолютного нуля температур все атомы гелия оказываются в основном энергетическом состоянии. Поскольку энергия состояний дискретна, атом может получить не любую энергию, а только такую, которая равна энергетическому зазору между соседними уровнями энергии. Но при низкой температуре энергия столкновений может оказаться меньше этой величины, в результате чего рассеяния энергии попросту не будет происходить. Жидкость будет течь без трения.
Конденсат Бозе — Эйнштейна
Основная статья: Конденсат Бозе — Эйнштейна
Получается в результате охлаждения бозе-газа до температур, близких к абсолютному нулю. В таком сильно охлаждённом состоянии достаточно большое число атомов оказывается в своих минимально возможных квантовых состояниях и квантовые эффекты начинают проявляться на макроскопическом уровне. Конденсат Бозе — Эйнштейна проявляет ряд квантовых свойств, таких как сверхтекучесть и .
Фермионный конденсат
Основная статья: Фермионный конденсат
Представляет собой Бозе-конденсацию в режиме БКШ «атомных куперовских пар» в газах состоящих из атомов-фермионов.
(В отличие от традиционного режима бозе-эйнштейновской конденсации составных бозонов).
Такие фермионные атомные конденсаты являются «родственниками» сверхпроводников, но с критической температурой порядка комнатной и выше.
Вырожденный газ
Основная статья: Вырожденный газ
Газ, на свойства которого существенно влияют квантовомеханические эффекты, возникающие вследствие тождественности его частиц. Вырождение наступает в условиях, когда расстояния между частицами газа становятся соизмеримыми с длиной волны де Бройля; в зависимости от спина частиц выделяются два типа вырожденных газов — ферми-газ, образованный фермионами (частицами с полуцелым спином) и бозе-газ, образованный бозонами (частицами с целым спином).
Сверхтекучее твёрдое тело
Основная статья: Сверхтекучее твёрдое тело
Термодинамическая фаза квантовой жидкости, представляющей собой твёрдое тело со свойствами сверхтекучей жидкости.
Твердое ли стекло?
Возможно вы когда-нибудь слышали, что стекло тоже является жидкостью. Просто невероятно вязкой. В доказательство этому, приводятся в пример витражные стекла старых храмов. Если присмотреться, у этих стекол в нижней части можно увидеть утолщение — с течением веков стекло якобы медленно стекает вниз. На самом деле это ошибка. В старых телескопах, например, где оптика крайне чувствительна к малейшим дефектам и сдвигам, до сих пор не наблюдается никаких искажений и все они все еще отлично работают.
В случае с витражами, все объясняется несовершенством древних технологий изготовления стекла, которые не позволяли сделать его ровным по всей поверхности. И тогда их приходилось устанавливать утолщенной стороной вниз, для устойчивости.

Кстати у свинца вязкость меньше чем у стекла, поэтому если бы стекло было бы жидкостью, то свинцовые рамы витражей уже давно превратились бы в лужу.
Можно сделать вывод, что правильная кристаллическая структура вещества — это не то что делает его твердым. На самом деле, твердое тело от жидкого отличает сильная химическая связь между атомами и молекулами. Эта связь удерживает их на месте не давая смещаться. В воде, масле или даже смоле, молекулы могут перемещаться относительно друг друга при комнатной температуре, а в стекле это невозможно.
Аморфное состояние — вещество
Аморфное состояние вещества не является неизменным. При известных условиях удается получить типично аморфные вещества, как каучук и клей, в кристаллическом состоянии. Установлено, что многие аморфные вещества в действительности слагаются из кристаллов, но они настолько мелки, что не заметны даже под микроскопом.
Аморфное состояние вещества можно получить из достаточно вязкой жидкости, если быстро ее охладить, не отнимая теплоты отвердевания. Тогда может получиться переохлажденная жидкость, достаточно твердая в обыденном смысле этого слова, но с неупорядоченным расположением частиц.
Аморфное состояние вещества не является термодинамически равновесным. Оно метастабильно, и время его жизни может быть очень большим. Вещества в аморфном состоянии получают из жидкой фазы путем быстрого охлаждения или из газообразной фазы напылением на холодную подложку. При этом ближний порядок выражен тем меньше, чем больше скорость охлаждения или ниже темп — pa Т подложки.
Аморфное состояние вещества удобно описывать ( так часто и поступают) как очень вязкое жидкое состояние. В аморфном состоянии частицы тела почти неупорядочены, как в жидкости, но относительно неподвижны, как в кристалле.
Аморфное состояние вещества иногда рассматривают как жидкость с очень высокой вязкостью или как множество мельчайших кристаллов. Насколько точны такие аналогии.
Аморфное состояние вещества является ным между жидким и твердым. С одной стороны, ные вещества не текут и сохраняют свою форму, а с другой, они изотропны по свойствам, имеют только ближний порядок, а вместо четкой температуры плавления — довольно протяженный интервал с плавным переходом свойств от твердого состояния к типично жидкому текучему.
|
Схема расположения макромолекул вдоль пачки. |
Аморфное состояние веществ обычно характеризуется хаотическим расположением молекул. Вследствие этого физические свойства веществ по всем направлениям, в отличие от кристаллических веществ, одинаковы. Одинаковость свойств по всем направлениям называют изотропией: Такое представление ранее было перенесено и на высокомолекулярные соединения. Предполагалось, что и у этих соединений в аморфном состоянии отсутствует какой бы то ни был порядок в расположении молекул, все молекулы друг с другом хаотически перепутаны и свернуты в клубки, напоминающие войлок. В настоящее время установлено, что простые и более сложные формы упорядоченности наблюдаются и в аморфном состоянии полимеров. Это отличие от аморфного состояния низкомолекулярных веществ связано с большой длиной и другими особенностями полимерных молекул.
Аморфное состояние вещества иногда рассматривают как жидкость с очень высокой вязкостью или как множество мельчайших кристаллов. Насколько точны такие аналогии.
Аморфное состояние вещества, вообще говоря, — неустойчивое состояние. По прошествии некоторого времени аморфное вещество переходит в кристаллическое. Нередко, однако, время это бывает весьма значительным и измеряется годами и десятилетиями.
Аморфное состояние вещества иногда рассматривают как жидкость с очень высокой вязкостью или как множество мельчайших кристаллов. Насколько точны такие аналогии.
Аморфное состояние вещества является термодинамически нестабильным и при благоприятных условиях переходит в кристаллическое.
|
Различное состояние линейных полимеров. |
Для аморфного состояния вещества характерно беспорядочное расположение молекул, для кристаллического состояния — упорядоченное.
Чем отличается аморфное состояние вещества от кристаллического.
Еще редакция Сlutch cоветует прочитать:
-
«Встречайте нашу девочку!» Жена Павла Воли из Comedy Club сообщила о пополнении – двух детей было недостаточно.
-
Дан Балан будет в ярости! Беременная Кароль выгнулась на сцене в пикантной позе, показав настоящую страсть.
- В самом разгаре долгожданого лета мы рассказали, что значит SPF, как защитить кожу от солнца и правильно подобрать крем. Узнавай много нового и участвуй в конкурсе с ценными призами!
-
Каменских лопнет от зависти! Латиноамериканка Мишель Андраде надела крохотный купальник, сверкнув аппетитными формами.
-
Подарит Горбунову дочь? Катя Осадчая показала «беременный» животик – на карантине времени зря не теряли.
-
Яркое платье и модная стрижка боб каре: 73-летняя Ротару поразила стильным преображением.
Такое невесомое, но такое тяжелое
Своим обманчивым прозрачным и «пушиночным» видом стекло вводит нас в заблуждение. На то, что оно оказывается таким тяжелым, есть и физические причины, но психологические все-таки сильнее. Стекло — твердое тело. Объем листа стекла размером 2 × 3 м и толщиной 2 см составляет 120 л. Легко прикинуть, сколько будут весить 120 литровых бутылок с водой. Но стекло — твердое вещество, а не жидкость. При равном объеме вес листового стекла — где-то между льдом и металлом. Например, наш лист стекла должен иметь массу около 300 кг.
Стекло – прозрачно, и мы воспринимаем его как несуществующее, ожидаем от него легкости. Но как бы мы его себе не представляли – состоит стекло из бесчисленного количества атомов.
Сверхкритические жидкости (флюиды)
Большинство фазовых переходов происходит при определенной температуре и давлении. Общеизвестно, что повышение температуры в конечном счете превращает жидкость в газ. Тем не менее когда давление увеличивается вместе с температурой, жидкость совершает прыжок в царство сверхкритических жидкостей, у которых есть свойства как газа, так и жидкости. К примеру, сверхкритические жидкости могут проходить через твердые тела как газ, но также могут выступать в качестве растворителя, как жидкость. Интересно, что сверхкритическую жидкость можно сделать больше похожей на газ или на жидкость, в зависимости от комбинации давления и температуры. Это позволило ученым найти множество применений для сверхкритических жидкостей.
Хотя сверхкритические жидкости не так распространены, как аморфные твердые вещества, вы, вероятно, взаимодействуете с ними так же часто, как со стеклом. Сверхкритический диоксид углерода любят пивоваренные компании за его способность выступать в качестве растворителя при взаимодействии с хмелем, а кофе-компании используют его для производства лучшего кофе без кофеина. Сверхкритические жидкости также использовались для более эффективного гидролиза и чтобы электростанции работали при более высоких температурах. В общем, вы, вероятно, используете побочные продукты сверхкритических жидкостей каждый день.
Получение
В состояние стекла материал можно перевести путём быстрого охлаждения расплава. При этом вещество не успевает кристаллизоваться. Вещество, как правило, не должно быть чистым, то есть оно должно содержать примеси в виде раствора, препятствующие кристаллизации. В то же время известны некоторые соединения (например, оксид кремния, оксид бора, оксид фосфора), которые при комнатной температуре способны очень долго пребывать в стеклообразном состоянии. Все эти вещества имеют высокую температуру плавления, что указывает на высокую энергию активации, требуемую для быстрого перехода молекулы из одного равновесного состояния в соседнее. Чистые вещества с одноатомными молекулами не могут долго находиться в стеклообразном состоянии, даже если они имеют высокую температуру плавления (углерод, вольфрам).
Термодинамические характеристики стеклообразного состояния
Образование первичного звена («центра») кристаллизации в расплаве приводит к появлению поверхности раздела кристаллической и жидкой фаз, что влечёт рост свободной энергии системы, которая при температурах ниже температуры ликвидуса, то есть отвечающих жидкому состоянию, термодинамически менее устойчивому, чем кристаллическое, иначе — метастабильному, — энергии, меньшей, чем свободная энергия жидкости той же массы. При уменьшении размеров тела отношение его поверхности к объёму увеличивается — меньший радиус центра кристаллизации отвечает росту свободной энергии, связанной с появлением раздела фаз. Для любой жидкости в метастабильном состоянии при каждой заданной температуре характерен критический радиус центра кристаллизации, менее которого свободная энергия некоторого объёма вещества, включающего этот центр, выше свободной энергии объёма вещества той же массы, но без центра. При радиусе, равном критическому, эти энергии равны, а при радиусе, превышающем критический, дальнейший рост термодинамически закономерен. Противоречия термодинамике, справедливой для макрообъектов, снимает наличие следующего явления: постоянные флуктуации энергии в микрообъектах (относительно небольших по числу атомов), сказываются их внутренними энергетическими колебаниями некоторой средней величины. При снижении температуры число «докритических» центров увеличивается, что сопровождается ростом их среднего радиуса. Помимо термодинамического — на скорость образования центров влияет кинетический фактор: свобода перемещения частиц относительно друг друга обуславливает скорость образования и рост кристаллов.
Разница между аморфными и кристаллическими твердыми веществами
Геометрия / Структура
Аморфные твердые вещества: Аморфные твердые вещества не имеют упорядоченной структуры; им не хватает какого-либо рисунка или расположения атомов или ионов или какой-либо геометрической формы.
Кристаллические твердые вещества: Кристаллические твердые тела имеют определенную и правильную геометрию благодаря упорядоченному расположению атомов или ионов.
Температура плавления
Аморфные твердые вещества: Аморфные твердые вещества не имеют острой температуры плавления.
Кристаллические твердые вещества: Кристаллические твердые частицы имеют острую температуру плавления, где она переходит в жидкое состояние.
Теплота плавления
Аморфные твердые вещества: Аморфные твердые вещества не имеют характерной теплоты плавления, поэтому рассматриваются как переохлажденные жидкости или псевдо-твердая фаза.
Кристаллические твердые вещества: Кристаллические твердые частицы имеют определенную теплоту плавления, поэтому они рассматриваются как настоящие твердые вещества.
Анизотропия и изотропия
Аморфные твердые вещества: Аморфные твердые вещества изотропны, поскольку имеют одинаковые физические свойства во всех направлениях.
Кристаллические твердые вещества: Кристаллические твердые вещества анизотропны и, вследствие этого, их физические свойства различны в разных направлениях.
Общие примеры
Аморфные твердые вещества: Стекло, органические полимеры и т. Д. Являются примерами аморфных твердых веществ.
Кристаллические твердые вещества: Алмаз, кварц, кремний, NaCl, ZnS, все металлические элементы, такие как Cu, Zn, Fe и т. Д., Являются примерами кристаллических твердых веществ.
Межчастичные силы
Аморфные твердые вещества: Аморфные твердые вещества имеют ковалентно связанные сети.
Кристаллические твердые вещества: Кристаллические твердые частицы имеют ковалентные связи, ионные связи, связи Ван-дер-Ваала и металлические связи.
Рекомендации:
Конкурс Science Vision2Инженерная химияОсновные понятия химииИзображение предоставлено:«Кристаллический или аморфный» Автор Cristal_ou_amorphe.svg: Cdangпроизводственная работа: Sbyrnes321 (talk) — Cristal_ou_amorphe.svg
Вырожденный газ

Электронно-вырожденное вещество существует в основном в белых карликах. Оно образуется в ядре звезды, когда масса вещества вокруг ядра пытается сжать электроны ядра до низшего энергетического состояния. Однако в соответствии с принципом Паули, две одинаковых частицы не могут быть в одном энергетическом состоянии. Таким образом, частицы «отталкивают» вещество вокруг ядра, создавая давление. Это возможно только если масса звезды меньше 1,44 массы Солнца. Когда звезда превышает этот предел (известный как предел Чандрасекара), она просто коллапсирует в нейтронную звезду или в черную дыру.
Когда звезда коллапсирует и становится нейтронной звездой, у нее больше нет электронно-вырожденного вещества, она состоит из нейтронно-вырожденного вещества. Поскольку нейтронная звезда тяжелая, электроны сливаются с протонами в ее ядре, образуя нейтроны. Свободные нейтроны (нейтроны не связаны в атомном ядре) имеют период полураспада в 10,3 минуты. Но в ядре нейтронной звезды масса звезды позволяет нейтронам существовать за пределами ядер, образуя нейтронно-вырожденное вещество.
Другие экзотические формы вырожденного вещества также могут существовать, в том числе и странная материя, которая может существовать в редкой форме звезд — кварковых звезд. Кварковые звезды — это стадия между нейтронной звездой и черной дырой, где кварки в ядре развязаны и образуют бульон из свободных кварков. Мы пока не наблюдали такой тип звезд, но физики допускают их существование.
Основные свойства стекла
Физические свойства стекла
Вещество в стеклообразном состоянии можно характеризовать рядом физико-химических показателей:
- Вещества изотропны, то есть свойства их одинаковы во всех направлениях;
- При нагревании они не плавятся как кристаллы, они постепенно размягчаются при переходе из хрупкого в высоковязкое и в конце — в капельно-жидкое состояние, при этом не только вязкость, но и другие свойства изменяются непрерывно;
- Расплавляются и отвердевают обратимо. То есть выдерживают
неоднократный разогрев до расплавленного состояния, после охлаждения вновь приобретают первоначальные свойства при одинаковых режимах перехода (если не произойдет кристаллизация или ликвация). Обратимость прессов и свойств указывает на то, что стеклообразующие расплавы и затвердевшее стекло являются растворами в чистом виде. Обратимость — признак настоящего раствора.
Определение стекла как переохлаждённой жидкости вытекает из способа получения стекла. Для перевода кристаллического тела в стеклообразное состояние его необходимо расплавить и затем переохладить снова. Переход вещества из жидкого состояния в твердое при понижении температуры происходит двумя путями: вещество кристаллизуется либо застывает в виде стекла. По первому пути могут следовать почти все вещества. Однако кристаллизация присутствует только в тех веществах, которые будучи в жидком состоянии, обладают малой вязкостью и вязкость которых возрастает сравнительно медленно, почти до момента
кристаллизации. К таким веществам относится и оксид висмута, который в чистом состоянии практически не образует стекол.
Свойства стекла сопоставимы с понятием «свойство-состав» стеклообразных систем и показывыает, что свойства можно разделить на две группы в зависимости от молярного состава — на простые и сложные.
- Первая группа — стеклообразные системы с простой зависимостью от молярного состава и могут оцениваться по:
- Молярный объём;
- Коэффициент преломления;
- Изотропия;
- Дисперсия;
- Теримческий коэффициент линейного расширения;
- Диэлектрическая проницаемость;
- Модуль упругости;
- Удельная теплоемкость,
- Коэффициент теплопроводности.
- Вторая группа:
Ко второй группе относятся свойства, которые более чувствительные к изменению состава. Зависимость их от состава сложна и часто не поддается количественным обобщениям. Например: вязкость, электропроводность, скорость диффузии ионов, диэлектрические потери, химическая стойкость, светопропускание, твёрдость, поверхностное натяжение, кристаллизационная
способность и др. Расчёт этих свойств возможен лишь в конкретных случаях.
Химическая устойчивость
- Основная статья: Неорганическое стекло
- Основная статья: Органическое стекло
Химическая устойчивость стекла видна по устойчивому отношению его к различным агрессивным средам. Это одно из важных свойсттв стекол. Но весь диапазон возможных стеклообразных систем, их химическая устойчивость различаться — от предельно
устойчивого кварцевого стекла, оргстекла до растворимого (жидкого) стекла.