Классы опасности веществ
Содержание:
Диоксидифторид
Диоксидифторид — это страшное химическое вещество, имеющее также чарующее название FOOF, поскольку к двум атомам фтора крепятся два атома кислорода. В 1962 году химик А. Г. Штренг опубликовал работу под названием «Химические свойства диоксидифторида». И хотя это название не кажется пугающим, эксперименты Штренга определенно таковыми были.
FOOF изготавливается при очень низкой температуре, поскольку распадается при температуре кипения около -57 градусов по Цельсию. Во время своих экспериментов Штренг обнаружил, что FOOF взрывается, вступая в действие с органическими соединениями, даже при температуре -183 градуса Цельсия. Взаимодействуя с хлором, FOOF сильно взрывается, а контакт с платиной приводит к такому же эффекту.
Короче, в разделе результатов в работе Штренга было множество слов «вспышка», «искра», «взрыв», «сильно» и «огонь» в разных комбинациях. Не забывайте, что все это происходило при температурах, при которых большинство химических веществ по сути инертны.
Исследование химического вещества
Исследование химических веществ, как правило, проводится в специальных лабораториях и экспертных центрах. Это позволяет определить точный количественный и качественный состав исследуемого материала.
Если химический состав вещества полностью неизвестен, сотрудники лаборатории применяют целый комплекс аналитических методов. Специалисты выявляют точное содержание в образцах вещества тех или иных химических элементов.
Проведение исследования химического состава вещества происходит поэтапно:
- сначала специалисты определяют цели своей работы;
- затем, проводят классификацию образцов вещества;
- далее, идет количественный и качественный анализ.
Часто в лабораторных условиях различные вещества проверяются на содержание токсичных элементов и промышленных материалов.
Плавиковая кислота
Любой, кто работал в области химии, слышал байки про фтористоводородную кислоту. В техническом смысле это слабая кислота, которая нелегко расстается со своим ионом водорода. Поэтому быстрый химический ожог получит от нее довольно сложно. И в этом секрет ее коварства. Будучи относительно нейтральной, плавиковая кислота может проходить через кожу, не уведомляя вас, и попадать в организм. И оказавшись на месте, плавиковая кислота приступает к работе.
Когда кислота отдает свой протон, остается фтор, который вступает в реакцию с другими веществами. Эти реакции нарастают как снежный ком, и фтор сеет ужасный хаос. Одной из любимых целей фтора является кальций. Поэтому плавиковая кислота приводит к гибели костной ткани. Если жертву оставить без лечения, смерть будет наступать долго и больно.
Химические реакции
Химические реакции – это превращения одних веществ (исходных реагентов) в другие. При этом происходит перераспределение электронов.
В отличие от ядерных реакций, химические реакции не влияют на общее количество ядер атомов и не изменяют изотопный состав химических элементов.
Условия протекания химических реакций могут быть различными. Они могут проходить при физическом контакте реагентов, их смешивании, нагревании, а также при воздействии света, электрического тока, ионизирующего излучения. Часто химические реакции протекают под влиянием катализаторов.
Скорость химической реакции зависит от концентрации активных частиц во взаимодействующих веществах и от разницы между энергией связи, которая разрывается, и той энергией, которая образуется.
В результате химических процессов образуются новые вещества, свойства которых отличны от свойств исходных реагентов. Однако во время химических реакций не происходит образования атомов новых элементов.
Рациональная
Эта номенклатура возникла с момента появления классификации и единой теории строения органических соединений. Она несет национальный характер. Органические соединения получают свои названия по типу, или классу, к которому они относятся, согласно своим химическим и физическим признакам (ацетилены, кетоны, спирты, этилены, альдегиды и так далее). В настоящее время такая номенклатура используется исключительно в тех случаях, когда дает наглядное и более детальное представление о рассматриваемом соединении. Например: метилацетилен, диметилкетон, метиловый спирт, метиламин, хлоруксусная кислота и тому подобное. Таким образом, из названия сразу становится понятно то, из чего состоит органическое соединение, но более точное расположение групп-заместителей еще невозможно определить.

Цианистый калий
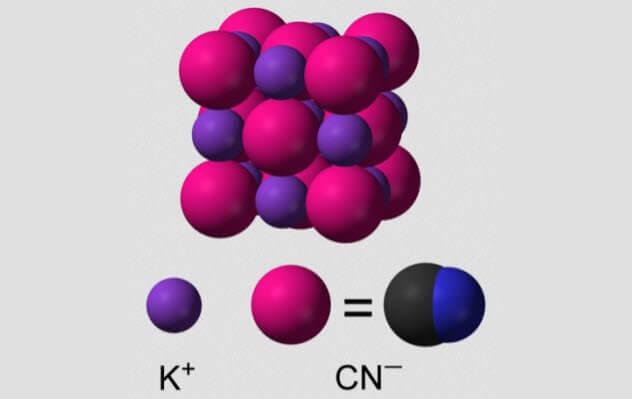
Цианид — простая молекула, всего лишь атом углерода, трижды связанный с атомом азота. Будучи небольшой, молекула цианида может просачиваться в белки и делать им очень плохо. Особенно цианид любит связываться с атомами железа в центре гемопротеинов. Один из гемопротеинов крайне полезен для нас: гемоглобин, белок, переносящий кислород в нашей крови. Цианид избавляет гемоглобин от способности перевозить кислород.
Когда цианистый калий вступает в контакт с водой, он разбивается на цианистый водород, который легко всасывается телом. Этот газ пахнет горьким миндалем, хотя не все могут его учуять.
Из-за быстрой реакции цианистый калий часто использовался как средство для многими людьми. Британские агенты времен Второй мировой войны носили таблетки цианида на случай поимки, и многие высокопоставленные нацисты также использовали капсулы цианистого калия, чтобы избегать правосудия.
Обозначение и индексация
Каждое химическое вещество имеет один или несколько систематические имена, обычно называемые согласно правилам IUPAC для обозначения. Альтернативная система используется Chemical Abstracts Service (CAS).
Много составов также известны их более общими, более простыми именами, многие из которых предшествуют систематическому имени. Например, давно известную сахарную глюкозу теперь систематически называют 6-(hydroxymethyl) oxane-2,3,4,5-tetrol. Натуральным продуктам и фармацевтическим препаратам также дают более простые имена, например умеренный Напроксен болеутоляющего — больше общего названия для химического соединения (S)-6-methoxy-α-methyl-2-naphthaleneacetic кислота.
Химики часто обращаются к химическим соединениям, используя химические формулы или молекулярную структуру состава. Был феноменальный рост в числе синтезируемых химических соединений (или изолировал), и затем сообщил в научной литературе профессиональными химиками во всем мире. Огромное количество химических соединений возможно через химическую комбинацию известных химических элементов. С мая 2011 известны приблизительно шестьдесят миллионов химических соединений. Названия многих из этих составов часто нетривиальны и следовательно не очень легки помнить или процитировать точно. Также трудно отслеживать их в литературе. Несколько международных организаций как IUPAC и CAS начали шаги, чтобы сделать такие задачи легче. CAS предоставляет услуги реферирования химической литературы и обеспечивает числовой идентификатор, известный как число регистрации CAS к каждому химическому веществу, о котором сообщили в химической литературе (такой как журналы химии и патенты). Эта информация собрана как база данных и обычно известна как индекс Химических веществ. Другие благоприятные для компьютера системы, которые были разработаны для получения информации о веществе: УЛЫБКИ и Международный Химический Идентификатор или InChI.
Триоксид серы
Триоксид серы — это прекурсор серной кислоты, необходимый также для некоторых реакций сульфирования. Если бы триоксид серы не был полезен, ни один здравомыслящий ученый не держал бы его при себе. Триоксид серы чрезвычайно едкий, когда вступает в контакт с органической материей.
Взаимодействуя с водой (которая составляет большую часть нашего тела), он создает серную кислоту с выделением тепла. Даже если он не попал непосредственно на вашу плоть, даже рядом находиться будет весьма опасно. Пары серной кислоты делают плохое с легкими. Проливание триоксида серы на органический материал вроде бумаги или дерева порождает токсичный огонь.
Трифторид хлора
Хлор и фтор по отдельности неприятные элементы. Но если они сочетаются в трифторид хлора, все становится еще хуже.
Трифторид хлора — это настолько коррозионное вещество, что его даже в стекле хранить не получится. Это такой сильный окислитель, что он сможет поджечь вещи, которые даже в кислороде не горят.
Даже пепел вещей, сгоревших в атмосфере кислорода, загорится под действием трифторида хлора. Ему даже не нужен источник воспламенения. Когда 900 килограммов трифторида хлора разлили в результате промышленной аварии, это химическое вещество растворило 0,3 метра бетона и метр гравия под собой.
Единственный (относительно) безопасный способ хранить это вещество — металлический контейнер, который уже был обработан фтором. Таким образом создается фтористый барьер, с которым не реагирует трехфтористый хлор. Встречаясь с водой, трифторид хлора мгновенно взрывается с выделением тепла и плавиковой кислоты.
Класс 4. Легковоспламеняющиеся вещества и материалы
Легковоспламеняющиеся вещества и материалы, кроме классифицированных как взрывчатые, способные во время перевозки легко загораться от внешних источников воспламенения, в результате трения, поглощения влаги, самопроизвольных химических превращений, а также при нагревании.
Подкласс 4.1 Легковоспламеняющиеся твёрдые вещества
К классу 4.1 относятся легковоспламеняющиеся вещества и изделия, десенсибилизированные взрывчатые вещества, являющиеся твердыми веществами, и самореактивные жидкости или твердые вещества. Легковоспламеняющимися твердыми веществами являются твердые вещества, способные легко загораться, и твердые вещества, способные вызвать возгорание при трении. Твердыми веществами, способными легко загораться, являются порошкообразные, гранулированные или пастообразные вещества, которые считаются опасными, если они могут легко загораться при кратковременном контакте с источником зажигания, таким, как горящая спичка, и если пламя распространяется быстро. Опасность может исходить не только от пламени, но и от токсичных продуктов горения. Особенно опасны в этом отношении порошки металлов, так как погасить пламя в этом случае трудно из-за того, что обычные огнетушащие вещества, такие, как диоксид углерода или вода, могут усугубить опасность.
Символ (пламя) — черный. Фон — белый с семью вертикальными красными полосами. Цифра «4» в нижнем углу.
Дополнительная информация о подклассе
Твердые десенсибилизированные взрывчатые вещества — это вещества, которые смочены водой или спиртами либо разбавлены другими веществами для подавления их взрывчатых свойств. Самореактивными веществами являются термически неустойчивые вещества, способные подвергаться бурному экзотермическому разложению даже без участия кислорода (воздуха). Некоторые самореактивные вещества могут перевозиться только в условиях регулирования температуры. Для обеспечения безопасности во время перевозки самореактивные вещества во многих случаях десенсибилизируются путем использования разбавителя.
Подкласс 4.2 Вещества, способные к самовозгоранию
К классу 4.2 относятся:
- пирофорные вещества — вещества, включая смеси и растворы (жидкие или твердые), которые даже в малых количествах воспламеняются при контакте с воздухом в течение пяти минут; эти вещества класса 4.2 наиболее подвержены самовозгоранию;
- самонагревающиеся вещества и изделия — вещества и изделия, включая смеси и растворы, которые при контакте с воздухом без подвода энергии извне способны к самонагреванию. Эти вещества воспламеняются только в больших количествах (килограммы) и лишь через длительные периоды времени (часы или дни). Причиной самонагревания этих веществ, приводящего к самовозгоранию, является реакция вещества с кислородом (содержащимся в воздухе), при которой выделяемое тепло не отводится достаточно быстро в окружающую среду.
Символ (пламя) — черный. Фон — верхняя половина белая, нижняя — красная. Цифра «4» в нижнем углу.
Подкласс 4.3 Вещества, выделяющие легковоспламеняющиеся газы при соприкосновении с водой
К классу 4.3 отнесены вещества, которые при реагировании с водой выделяют легковоспламеняющиеся газы, способные образовывать с воздухом взрывчатые смеси, а также изделия, содержащие такие вещества. Некоторые вещества при соприкосновении с водой могут выделять легковоспламеняющиеся газы, способные образовывать взрывчатые смеси с воздухом. Такие смеси легко воспламеняются от любых обычных источников зажигания, например открытого огня, искр слесарных инструментов или незащищенных электрических ламп. Образующиеся в результате этого взрывная волна и пламя могут создать опасность для людей и окружающей среды.
Символ (пламя) — черный или белый. Фон — синий. Цифра «4» в нижнем углу.
Диметилртуть
Две капли диметилртути — и всё.
В 1996 году Карен Веттерхан исследовала эффекты воздействия тяжелых металлов на организмы. Тяжелые металлы в своей металлической форме довольно плохо взаимодействуют с живыми организмами. Хотя это и не рекомендуется, вполне можно опустить руку в жидкую ртуть и успешно ее вынуть.
Поэтому чтобы ввести ртуть в ДНК, Веттерхан использовала диметилртуть, атом ртути с двумя присоединенными органическими группами. В процессе работы Веттерхан уронила каплю, может две, на свою латексную перчатку. Через шесть месяцев она умерла.
Веттерхан была опытным профессором и приняла все рекомендуемые меры предосторожности. Но диметилртуть просочилась через перчатки менее чем за пять секунд, а через кожу — менее чем за пятнадцать
Химическое вещество не оставило никаких явных следов и Веттерхан заметила побочные эффекты лишь несколько месяцев спустя, когда было уже слишком поздно лечиться.
Классификация вредных веществ
Число химикатов увеличивается с каждым годом и сейчас достигает 7 млн. Из них 60 тысяч широко применяются в промышленности и быту. Они различны по агрегатному состоянию, по характеру и интенсивности влияния на здоровье человека. Применяются 3 классификации.
Советуем почитать: Что относится к сооружениям механической и биологической очистки сточных вод?
По степени токсичности (классы опасности)
ГОСТ 12.1.007.-76 разделяет вредные элементы и соединения на 4 группы по интенсивности разрушительного воздействия на организм человека:
- 1 – чрезвычайно опасные (цианид калия, натрия, циановодород, хлорокись фосфора, фтороводород, ртуть, плутоний, полоний, озон, оксид свинца, бензапирен, винилхлорид);
- 2 – высоко опасные (гидроксид натрия, свинец, нитриты, стирол, сурьма, мышьяк, фенол, сероводород, хлороформ, фтор, соляная и серная кислоты, формальдегиды);
- 3 – умеренно опасные (бензин, азотная кислота, соединения марганца, алюминия, меди, никеля, серебра);
- 4 – малоопасные (керосин, этанол, аммиак, метан).
Веществу присваивается класс опасности в зависимости от принятых норм. Учитываются:
- предельно допустимая концентрация;
- летальная доза при попадании в желудок, на кожу, в органы дыхания;
- территория острого и хронического отравления.

Классификация химических веществ по классу опасности
По воздействию на организм
Выделяют 6 групп ядов по проявлению отравляющего действия.
- Общетоксические химические вещества. Поражают весь организм или системы органов (ЦНС, кроветворную систему и др). Такое действие оказывают углеводороды, спирты, анилин, сероводород, синильная кислота и ее соли, соли ртути, хлорированные углеводороды, оксид углерода и др.
- Раздражающие химические вещества. Воздействуют на слизистые, органы дыхания и зрения, кожу. Вызывают кратковременную потерю дееспособности или смерть, если поражены жизненно важные органы. Используются армиями, силовыми структурами, для личной самообороны. Этот хлор, аммиак, сероводород, соединения мышьяка, фосген и др.
- Сенсибилизирующие химические вещества. Вызывают реакцию, сходную с аллергической. Провоцирует астму, кожные заболевания. Такой эффект вызывают формальдегид, растворители, лаки и др.
- Канцерогенные химические вещества. Свободные радикалы вызывают образование раковых опухолей. Имеют накопительный характер воздействия. К ним относятся асбест, никель, бериллий, бензапирен.
- Мутагенные химические вещества. Влияя на половые клетки, изменяют генетическую информацию. Проявляется на потомстве. Это свинец, марганец, ртуть, радиоактивные вещества и др.
- Вещества, влияющие на репродуктивную функцию. Вызывают врожденные аномалии развития у зародыша, нарушают внутриутробное и послеродовое развитие потомства. К ним относятся ртуть, свинец, радиоактивные изотопы, стирол, аммиак, борная кислота.
По агрегатному состоянию
Вредные вещества имеют различные агрегатные состояния: твёрдое, жидкое и газообразное. Ещё образуются смешанные частицы – аэрозоли, содержащие пыль и пар.
Советуем почитать: Тепловое загрязнение окружающей среды: источники и последствия
Большое значение имеет дисперсность аэрозолей. Большие частицы (10мкм) быстрее оседают на поверхности и наносят меньше вреда. Мелкие частицы (менее 0,25 мкм) проходят через бронхи и оседают в лёгких