Таяние льда: природа явления и ее особенности
Содержание:
- Кристаллические и аморфные вещества
- Температуры и агрегатное состояние веществ
- Кристаллизация растворов
- Примеры химических явлений
- Кристаллические и аморфные вещества
- Обратимость физических и необратимость химических явлений
- Агрегатное состояние вещества
- Свежая ли рыба?
- Готовим лимонад
- Понятие о кристаллизации
- Температура замерзания воды
- «Плавление и кристаллизация. Удельная теплота плавления»
- «Физические и химические явления (химические реакции)»
Кристаллические и аморфные вещества
При описании физических свойств твердых веществ принято описывать структуру вещества. Если рассмотреть образец поваренной соли под увеличительным стеклом, можно заметить, что соль состоит из множества мельчайших кристаллов. В соляных месторождениях можно встретить и весьма крупные кристаллы. Кристаллы – твердые тела, имеющие форму правильных многогранников Кристаллы могут иметь различную форму и размер. Кристаллы некоторых веществ, таких как поваренная соль – хрупкие, их легко разрушить. Существуют кристаллы довольно твердые. Например, одним из самых твердых минералов считается алмаз. Если рассматривать кристаллы поваренной соли под микроскопом, можно заметить, что все они имеют похожее строение. Если же рассмотреть, например, частицы стекла, то все они будут иметь различное строение – такие вещества называют аморфными. К аморфным веществам относят стекло, крахмал, янтарь, пчелиный воск. Аморфные вещества – вещества, не имеющие кристаллического строения
Температуры и агрегатное состояние веществ
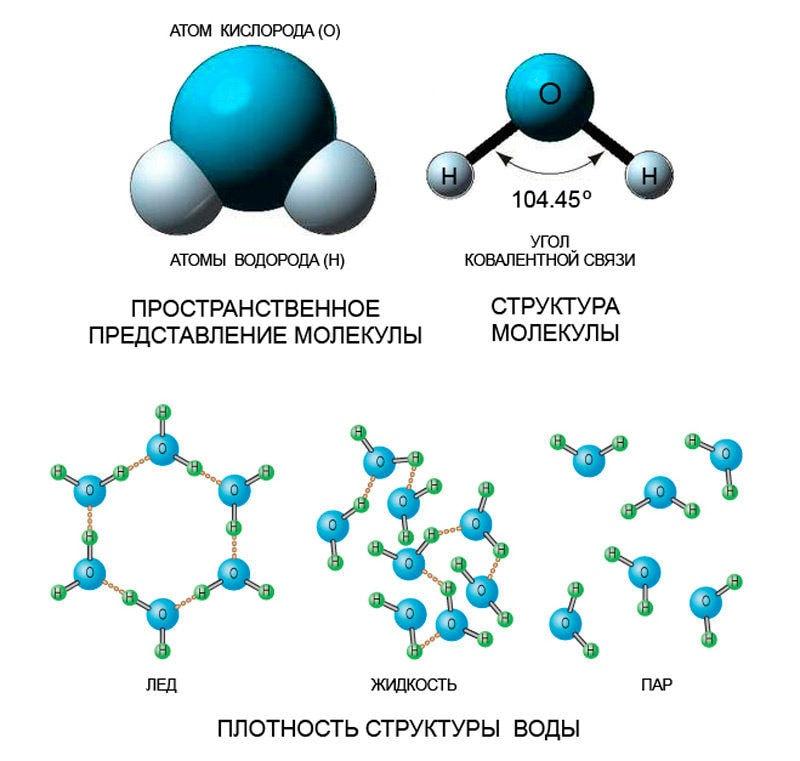 Молекула воды в различных агрегатных состояниях
Молекула воды в различных агрегатных состояниях
Чем выше температуры, тем дальше отстоят между собой молекулы любых веществ. Их отдаление друг от друга приводит к размягчению вещества, которое сначала становится жидким, а потом и вовсе газообразным. Этот процесс можно рассмотреть на примере железа, которое плавится в тигле и обретает жидкую форму. При сильном повышении температур оно может стать и газообразным, то есть, испариться, но для этого температура должна быть по-настоящему высокой.
Вода же при обычной комнатной температуре является жидкостью. При повышении температур она станет паром, а при понижении – льдом. Ведь понижение температуры имеет обратное влияние на молекулы – они сближаются. А при их сближении вещество становится тверже, плотнее. Такого же эффекта можно добиться при механическом прессовании любого вещества- оно станет тверже, опять же из-за сближения молекул.
Кристаллизация растворов
Вода – замечательный растворитель. Вещества, растворенные в ней, сдвигают точку кристаллизации, как правило, в сторону понижения. Чем выше концентрация раствора, тем при более низкой температуре будет происходить замерзание. Ярким примером служит морская вода, в которой растворено много различных солей. Их концентрация в воде океанов составляет 35 промилле, и кристаллизуется такая вода при –1,9 °C. Соленость воды в разных морях сильно отличается, поэтому и точка замерзания бывает различной. Так, вода Балтики имеет соленость не более 8 промилле, и температура кристаллизации ее близка к 0 °C. Минерализованные грунтовые воды также замерзают при температурах ниже нуля. Следует иметь в виду, что речь всегда идет только о кристаллизации воды: морской лед практически всегда пресный, в крайнем случае слабосоленый.

Водные растворы различных спиртов тоже отличаются пониженной температурой замерзания, причем кристаллизация их протекает не скачкообразно, а с некоторым интервалом температур. Например, 40-процентный спирт начинает замерзать при -22,5 °C, а окончательно кристаллизуется при -29,5 °C.
А вот раствор такой щелочи, как едкий натр NaOH или каустик являет собой интересное исключение: ему свойственна повышенная температура кристаллизации.
Примеры химических явлений
Как было сказано выше, любые процессы, которые происходят с изменением химического состава тел, принимающих в них участие, изучаются химией. Если возвращаться к примеру с автомобилем, то можно сказать, что процесс сжигания топлива в его двигателе является ярким примером химического явления, поскольку в результате него углеводороды, взаимодействуя с кислородом, приводят к образованию совершенно других продуктов сгорания, основными из которых являются вода и углекислый газ.
К еще одному из ярких примеров рассматриваемого класса явлений относится процесс фотосинтеза в зеленых растениях. Изначально они располагают водой, углекислым газом и солнечным светом, после же завершения фотосинтеза исходных реагентов уже нет, а на их месте образуются глюкоза и кислород.

В общем случае можно говорить, что любой живой организм представляет собой настоящий химический реактор, поскольку в нем происходят огромное количество преобразовательных процессов, например, распад аминокислот и образование из них новых протеинов, перевод углеводородов в энергию для мышечных волокон, процесс дыхания человека, при котором гемоглобин связывает кислород, и многие другие.
Одним из удивительных примеров химических явлений в природе признано холодное свечение светлячков, которое является результатом окисления специального вещества — люциферина.
В технической сфере примером химических процессов является изготовление красителей для одежды и продуктов питания.
Кристаллические и аморфные вещества
При описании физических свойств твердых веществ принято описывать структуру вещества. Если рассмотреть образец поваренной соли под увеличительным стеклом, можно заметить, что соль состоит из множества мельчайших кристаллов. В соляных месторождениях можно встретить и весьма крупные кристаллы.
Кристаллы – твердые тела, имеющие форму правильных многогранников
Кристаллы могут иметь различную форму и размер. Кристаллы некоторых веществ, таких как поваренная соль
– хрупкие, их легко разрушить
. Существуют кристаллы довольно твердые. Например, одним из самых твердых минералов считается алмаз.
Если рассматривать кристаллы поваренной соли под микроскопом, можно заметить, что все они имеют похожее строение. Если же рассмотреть, например, частицы стекла, то все они будут иметь различное строение – такие вещества называют аморфными.
К аморфным веществам относят стекло, крахмал, янтарь, пчелиный воск.
Аморфные вещества – вещества, не имеющие кристаллического строения
Обратимость физических и необратимость химических явлений
В некоторых источниках, при ответе на вопрос, чем физические явления отличаются от химических, можно встретить информацию о том, что физические явления являются обратимыми, а химические — нет, однако, это не совсем верно.
Направление любого процесса можно определить, используя законы термодинамики. Эти законы говорят, что всякий процесс может идти самопроизвольно только в случае уменьшения его энергии Гиббса (уменьшении внутренней энергии и увеличении энтропии). Однако, этот процесс всегда можно обратить вспять, если использовать внешний источник энергии. Для примера скажем, что недавно ученые открыли обратный фотосинтезу процесс, который является химическим явлением.
Агрегатное состояние вещества
Вещества могут существовать в нескольких агрегатных состояниях, три из которых вам известны: твердое, жидкое, газообразное. Например, вода в природе существует во всех трех агрегатных состояниях: твердом (в виде льда и снега), жидком (жидкая вода) и газообразном (водяной пар).
Известны вещества, которые не могут существовать в обычных условиях во всех трех агрегатных состояниях. Например, таким веществом является углекислый газ. При комнатной температуре это газ без запаха и цвета. При температуре –79°С
данное вещество «замерзает» и переходит в твердое агрегатное состояние. Бытовое (тривиальное) название такого вещества «сухой лед»
. Такое название дано этому веществу из-за того, что «сухой лед» превращается в углекислый газ без плавления, то есть, без перехода в жидкое агрегатное состояние, которое присутствует, например, у воды.
Таким образом, можно сделать важный вывод.
Вещество при переходе из одного агрегатного состояния в другое не превращается в другие вещества. Сам процесс некоего изменения, превращения, называется явлением.
Свежая ли рыба?
Материалы и инструменты:
-
рыба;
-
жидкость-индикатор (см. п. 1);
-
чайная ложка.
Ход опыта
- На туловище рыбы делаем глубокий надрез.
- Залейте в надрез ложку жидкости-индикатора.
Результат опыта
Если надрез приобрел розовый или сиреневый оттенок, рыба свежая. Синий или зеленый цвет свидетельствует об обратном.
Научное объяснение
Будучи хорошим индикатором, отвар красной капусты позволил нам определить кислотность среды. Слабо-сиреневая или розовая окраска указывает на нейтральную или слабокислую реакцию — значит, рыба хорошего качества.
Синий или зеленый цвет свидетельствует о щелочной среде, то есть рыба испортилась.
Нажмите здесь, чтобы узнать из чего еще можно приготовить природный рН-индикатор в домашних условиях.
Готовим лимонад
Материалы и инструменты:
-
лимонная кислота;
-
пищевая сода;
-
сахар;
-
чашка;
-
ложка.
Ход опыта
- Насыпаем в пробирку по одной чайной ложке лимонной кислоты и соды, затем добавляем две чайные ложки сахарного песка.
- Пересыпаем всю смесь в сухую чистую чашку, основательно перемешиваем.
- Разделяем смесь на несколько равных частей. Каждую часть можно упаковать в пакетик.
- Одну такую часть высыпать в стакан и залить водой.
Результат опыта
Получится шипучий и газированный напиток, освежающий, как лимонад.
Научное объяснение
При взаимодействии лимонной кислоты и гидрокарбоната натрия происходит реакция нейтрализации. Получаем натриевую соль лимонной кислоты, углекислый газ и воду.
Н₃С₆Н₅О₇ + 3NaHCO₃ –> Na₃C₆H₅O₇ + 3CO₂ + 3H₂O
Понятие о кристаллизации
Когда жидкость при охлаждении затвердевает, изменяется характер взаимодействия и расположения частиц вещества. Уменьшается кинетическая энергия беспорядочного теплового движения составляющих его частиц, и они начинают образовывать между собой устойчивые связи. Когда благодаря этим связям молекулы (или атомы) выстраиваются регулярным, упорядоченным образом, формируется кристаллическая структура твердого вещества.
Кристаллизация не охватывает одновременно весь объем охлаждаемой жидкости, а начинается с образования мелких кристалликов. Это так называемые центры кристаллизации. Они разрастаются послойно, ступенчато, путем присоединения все новых молекул или атомов вещества вдоль растущего слоя.
Температура замерзания воды
Процесс замерзания происходит при охлаждении её до ноля градусов по шкале Цельсия. Это касается не всей воды. Молекулы присоединяются к примесям, которыми являются частички пыли, соли и т.д. Поэтому чистая либо же дистиллированная вода, без присутствия этих самых примесей под воздействием низких температур по столбику Цельсия, дольше, чем обычная может оставаться в жидком состоянии.
Так же интересно, что при том, как другие вещества при замерзании уменьшаются в объеме, вода наоборот увеличивается. Все потому, что при переходе в твёрдое состояние, расстояние между молекулами расширяется. При том,что объём увеличивается, масса при замерзании не увеличивается, и весит столько же, сколько тёплая вода.
Многие задаются вопросом, почему вода не замерзает под толстым слоем льда. Любой физик ответит, что под слоем льда, вода не замерзает,так как поверхность льда служит теплоизолятором.

Отчего горячая вода замерзает быстрее холодной
Известен такой факт, что горячая или тёплая вода замерзает быстрее холодной воды. Невероятно, но факт. Это открытие сделал Эрасто Мпемба. Он проводил эксперименты с использованием мороженой массы,причём обнаружил, что если масса тёплая, то она быстрее замёрзнет. Причиной этого, как показали исследования, является высокая теплоотдача горячей и тёплой воды.

Взаимосвязаны ли температура замерзания воды и высота
Как известно, на высоте происходит изменение давления,поэтому температура перехода в твёрдое состояние всех водных растворов на высоте отличается от температуры на обычной поверхности.
Примеры изменения температурных показателей на высоте:
- высота 500 м – температура замерзания воды, является не ноль °C, как при обычных условиях, а при наличии уже одного °C;
- высота 1500 м – кристаллизация происходит при наличии около трёх° C и т.д.

Как давление влияет на процесс кристаллизации воды
Если разобраться о взаимосвязи давления и кристаллизации воды, то всё довольно просто.
Интересно! Чем выше давление, тем скорость преобразования воды в кристаллы льда ниже, а температура кипения выше!
Вот и весь секрет, а если логически подумать, то при понижении давления, все показатели идут в обратные стороны. Поэтому в горах сложно что — то сварить, так как температура, при которой кипит вода, не доходит до ста градусов Цельсия. И наоборот лёд плавится даже при низких температурах.
Температура кристаллизации водных растворов
Вода служит хорошим растворителем и поэтому легко соединяется с другими веществами. Полученные растворы, конечно же, будут замерзать при разных условиях. Рассмотрим пару вариантов температурных критериев для замерзания разных растворов на основе воды.
Вода и спирт. При большом количестве спирта в воде,процесс замерзания начнётся при наличии очень низких температур. К примеру, при соотношении 60% воды на 40% спирта, кристаллизация начнётся при наличии минус 22,5°C.
Вода и соль. Температура, при которой произойдёт замерзание напрямую связано со степенью солёности воды. Принцип таков, чем больше соли в воде, тем ниже температура кристаллизации. С показателями содержания соли напрямую связано как замерзает морская вода.
Вода и сода. Температура кристаллизации раствора 44 процентов, составляет плюс 7°C.
Вода и глицерин, при соотношении 80% на 20%, где 80 – это глицерин, а 20 – это вода, для замерзания раствора нужно наличие — 20°C.
Все температурные значения колеблются в зависимости от степени концентрации чужеродных растворов или иного вещества в воде.
«Плавление и кристаллизация. Удельная теплота плавления»
Плавление
Плавление — это процесс превращения вещества из твёрдого состояния в жидкое.
Наблюдения показывают, что если измельчённый лёд, имеющий, например, температуру –10 °С, оставить в тёплой комнате, то его температура будет повышаться. При 0 °С лёд начнет таять, а температура при этом не будет изменяться до тех пор, пока весь лёд не превратится в жидкость. После этого температура образовавшейся изо льда воды будет повышаться.
Это означает, что кристаллические тела, к которым относится и лед, плавятся при определённой температуре, которую называют температурой плавления
Важно, что во время процесса плавления температура кристаллического вещества и образовавшейся в процессе его плавления жидкости остаётся неизменной
В описанном выше опыте лёд получал некоторое количество теплоты, его внутренняя энергия увеличивалась за счёт увеличения средней кинетической энергии движения молекул. Затем лёд плавился, его температура при этом не менялась, хотя лёд получал некоторое количество теплоты. Следовательно, его внутренняя энергия увеличивалась, но не за счёт кинетической, а за счёт потенциальной энергии взаимодействия молекул. Получаемая извне энергия расходуется на разрушение кристаллической решетки. Подобным образом происходит плавление любого кристаллического тела.
Аморфные тела не имеют определённой температуры плавления. При повышении температуры они постепенно размягчаются, пока не превратятся в жидкость.
Кристаллизация
Кристаллизация — это процесс перехода вещества из жидкого состояния в твёрдое состояние. Охлаждаясь, жидкость будет отдавать некоторое количество теплоты окружающему воздуху. При этом будет уменьшаться её внутренняя энергия за счёт уменьшения средней кинетической энергии его молекул. При определённой температуре начнётся процесс кристаллизации, во время этого процесса температура вещества не будет изменяться, пока всё вещество не перейдет в твёрдое состояние. Этот переход сопровождается выделением определённого количества теплоты и соответственно уменьшением внутренней энергии вещества за счёт уменьшения потенциальной энергии взаимодействия его молекул.
Таким образом, переход вещества из жидкого состояния в твёрдое состояние происходит при определённой температуре, называемой температурой кристаллизации. Эта температура остаётся неизменной в течение всего процесса плавления. Она равна температуре плавления этого вещества.
На рисунке приведён график зависимости температуры твёрдого кристаллического вещества от времени в процессе его нагревания от комнатной температуры до температуры плавления, плавления, нагревания вещества в жидком состоянии, охлаждения жидкого вещества, кристаллизации и последующего охлаждения вещества в твёрдом состоянии.
Удельная теплота плавления
Различные кристаллические вещества имеют разное строение. Соответственно, для того, чтобы разрушить кристаллическую решётку твёрдого тела при температуре его плавления, необходимо ему сообщить разное количество теплоты.
Удельная теплота плавления — это количество теплоты, которое необходимо сообщить 1 кг кристаллического вещества, чтобы превратить его в жидкость при температуре плавления. Опыт показывает, что удельная теплота плавления равна удельной теплоте кристаллизации.
Удельная теплота плавления обозначается буквой λ. Единица удельной теплоты плавления — = 1 Дж/кг.
Значения удельной теплоты плавления кристаллических веществ приведены в таблице. Удельная теплота плавления алюминия 3,9*105 Дж/кг. Это означает, что для плавления 1 кг алюминия при температуре плавления необходимо затратить количество теплоты 3,9*105 Дж. Этому же значению равно увеличение внутренней энергии 1 кг алюминия.
Чтобы вычислить количество теплоты Q, необходимое для плавления вещества массой m, взятого при температуре плавления, следует удельную теплоту плавления λ умножить на массу вещества: Q = λm.
Эта же формула используется при вычислении количества теплоты, выделяющегося при кристаллизации жидкости.
Конспект урока «Плавление и кристаллизация. Удельная теплота плавления».
Следующая тема: «Тепловые машины. ДВС. Удельная теплота сгорания топлива».
«Физические и химические явления (химические реакции)»
Ключевые слова конспекта: Физические явления, химические явления, химические реакции, признаки химических реакций, значение физических и химических явлений.
Физические явления — это явления, при которых обычно изменяется только агрегатное состояние веществ. Примеры физических явлений — плавление стекла, испарение или замерзание воды.
Химические явления — это явления, в результате которых из данных веществ образуются другие вещества. При химических явлениях исходные вещества превращаются в другие вещества, обладающие другими свойствами. Примеры химических явлений — сгорание топлива, гниение органических веществ, ржавление железа, скисание молока.
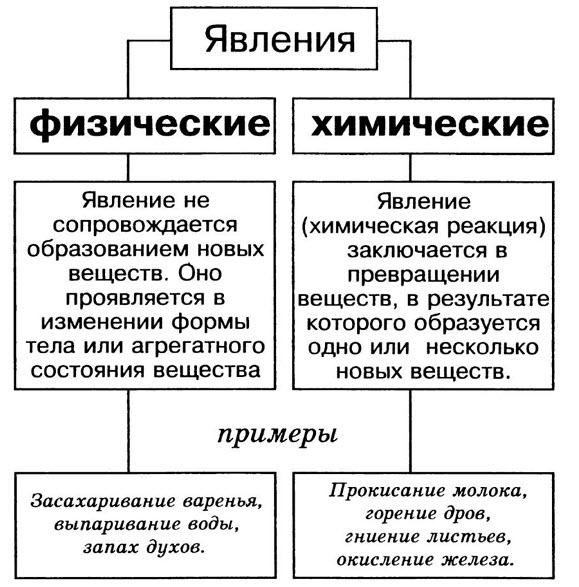
Химические явления иначе называют химическими реакциями.
Условия возникновения химических реакций
О том, что при химических реакциях одни вещества превращаются в другие, можно судить по внешним признакам: выделению теплоты (иногда света), изменению окраски, появлению запаха, образованию осадка, выделению газа.
Для начала многих химических реакций необходимо привести в тесное соприкосновение реагирующие вещества. Для этого их измельчают и перемешивают; площадь соприкосновения реагирующих веществ при этом увеличивается. Наиболее тонкое дробление веществ происходит при их растворении, поэтому многие реакции проводят в растворах.
Измельчение и перемешивание веществ — только одно из условий возникновения химической реакции. Например. при соприкосновении древесных опилок с воздухом при обычной температуре опилки не загораются. Для того чтобы началась химическая реакция, во многих случаях необходимо нагревание веществ до определённой температуры.

Следует различать понятия «условия возникновения» и «условия течения химических реакций». Так, например, чтобы началось горение, нагревание нужно только вначале, а затем реакция протекает с выделением теплоты и света, и дальнейшее нагревание не требуется. А в случае разложения воды приток электрической энергии необходим не только для начала реакции, но и для дальнейшего её протекания.
Важнейшие условия возникновения химических реакций — это:
- тщательное измельчение и перемешивание веществ;
- предварительное нагревание веществ до определённой температуры.
Значение физических и химических явлений
Большое значение имеют химические реакции. Они используются для получения металлов, пластмасс, минеральных удобрений, медикаментов и т. д., а также служат источником различных видов энергии. Так, при сгорании топлива выделяется теплота, которую используют в быту и в промышленности.
Все процессы жизнедеятельности (дыхание, пищеварение, фотосинтез и др.), протекающие в живых организмах, также связаны с различными химическими превращениями. Например, химические превращения веществ, содержащихся в пище (белков, жиров, углеводов), протекают с выделением энергии, которая используется организмом для обеспечения процессов жизнедеятельности.
Конспект урока «Физические и химические явления ( химические реакции)».
Следующая тема: «Атомы, молекулы и ионы».














