В каких состояниях вода встречается в природе?
Содержание:
- декларация
- Агрегатные состояния воды в природе
- Почему озера не испаряются?
- Параметры, испарение воды
- Вода — жидкость
- Лед в любом виде
- Жидкость — газ
- Физика процесса
- 9. Водяной пар в кипящем чайнике
- Диаграмма водяного пара
- Пробная идея и конструкция
- МКТ и немного жидкости
- Строение молекулы в различных агрегатных состояниях
- Что такое испарение?
- Факторы, влияющие на скорость испарения
- Испаряется ли вода?
- Какие существуют особенности в строении твердых тел?
- Конденсация с точки зрения физики
декларация
Отсоединение молекул воды от поверхности и переход в газообразное состояние вещества зависит от двух факторов:кинетической энергии молекулы и давления извне .Чем больше кинетической энергии имеет частица, тем быстрее она движется и тем легче ее растворить из соединения с соседними молекулами. Температура всей системы (в нашем случае, воды в стакане) — это среднее значение, которое является результатом кинетических энергий всех отдельных частиц. Например, частица уже может иметь энергию для растворения, в то время как остальная вода все еще остается жидкой. Этот эффект позволяет жидкостям испаряться при температурах, намного ниже их температуры кипения. Чтобы отделиться от жидкости, частица должна преодолеть не только связь с другими частицами жидкости, но и давление извне. Давление в газах — не более чем сила и частота, с которой частицы ударяются о граничную поверхность. Поэтому молекула воды постоянно бомбардируется молекулами воздуха и должна также преодолеть это давление, чтобы стать газообразной. Чем меньше внешнее давление, тем меньше энергии требуется. Зависимость температуры кипения от внешнего давления можно рассчитать и представить графически в виде кривой давления пара . Для воды это выглядит так:
Можно видеть, что при нормальном давлении воздуха (1 бар) температура кипения составляет 100 ° C (красная стрелка), а вода кипит при комнатной температуре около 30 мбар (зеленая стрелка). Это также подтверждается нашим экспериментом: между 30 мбар и 20 мбар вода начинает кипеть (начальная температура была ниже 20 ° C, поэтому давление немного ниже). Испаренная вода откачивается. Давление остается постоянным до тех пор, пока ничто не может испариться из охлажденной воды при этом давлении. Затем давление снова понижается, и оно снова может испарять воду. Чем холоднее становится вода, тем ниже будет давление.Но почему вода вообще остывает? Когда мы кипятим воду на плите, мы все время добавляем тепло. Это тепло обеспечивает тепло испарения, которое необходимо растворить молекулам воды. В вакуумной камере тепло не добавляется. Следовательно, испаряющиеся молекулы «берут» энергию (= тепло) у других молекул. Они теряют энергию, и вода остывает. Вода обладает особым свойством, известным как аномалия воды : она имеет самую высокую плотность при 4 ° С.Поскольку плотность жидкостей разной плотности (например, воды разных температур) всегда находится на самом дне, температура на дне сосуда по-прежнему составляет 4 ° C, когда поверхность уже достигла точки замерзания.Поскольку давление продолжает падать, все больше и больше воды испаряется и получает необходимую энергию из остальной воды. Он даже испаряется, когда оставшаяся вода достигает 0 ° C, и не может продолжать охлаждаться без замерзания. Замораживание также высвобождает энергию. Таким образом, вода замерзает, поэтому она может продолжать испаряться. Подобно тому, как частицы могут переходить из жидкого в газообразное состояние вещества (испаряться), они также могут переходить из твердого в газообразное состояние. Этот процесс называется сублимацией. Лед может возвышаться при давлениях менее 8 мбар. Так называемая кривая давления сублимации будет следовать кривой давления пара выше точно в точке замерзания (желтая стрелка). Здесь лед также остывает, чтобы обеспечить энергию для сублимации. Пузырьки в полученном льду изначально заполнены водяным паром низкого давления. В некоторых, вероятно, образуется вакуум, потому что водяной пар конденсируется и замерзает. Что ж, теперь мы объяснили и (надеюсь) поняли все наблюдения. Хорошая особенность этого эксперимента в том, что он совсем не сложный, и вы все равно можете сделать много интересных наблюдений. И, конечно же, кипящая вода и пенистое мороженое тоже отлично смотрятся!
Агрегатные состояния воды в природе
Агрегатные состояния воды ежедневно встречаются нам в окружающей нас природе. Они активно влияют на все аспекты жизнедеятельности человека.
В природе в естественных условиях вода может в изобилии существовать в 3-х основных агрегатных состояниях:
- Твердое состояние – лед, снег, град, иней … ;
- Жидкое – вода, дождь, туман, роса, радуга, облака …;
- Газообразное – пар …
К выше сказанному, важно уточнить, что туман и облака, на самом деле, не являются газообразным состоянием воды. Они являются результатом конденсации водяного пара, а не самим паром как таковым
Подробнее про Водяной пар читайте в статье ВОДЯНОЙ ПАР — ГАЗООБРАЗНОЕ СОСТОЯНИЕ ВОДЫ → .
Круговорот воды в природе
Уникальное свойство воды — возможность быть в природных условиях в трех разных базовых агрегатных состояниях, обеспечивает нашей планете жизненно важный процесс – гидрологический цикл или круговорот воды в природе. Если кратко круговорот воды состаит из таких процессов — осадков, испарения и конденсации. Круговорот воды в природе обеспечивает ее присутствие практически во всех уголках нашей планеты, а вода, как известно, источник жизни. Более подробно про него читайте в нашей статье КРУГОВОРОТ ВОДЫ В ПРИРОДЕ → .
Жидкое состояние воды в природе
Без воды в жидком состоянии большинство живых существ на нашей планете просто погибнет.
Химическая формула воды — H2O . Два атома водорода имеют положительный заряд, а один атом кислорода отрицательный. Связь между атомами «не сильная». Поэтому она легко разрывается, впрочем как и устанавливается.
Аккумулируется вода в жидком состоянии в хорошо всем нам известных формах — это океаны, моря, реки, озёра, пруды, ставки, каналы, атмосферных осадках …
Отметим интересный факт — вода в жидком состоянии при фиксированном объёме не имеет фиксированной формы.
Твердое состояние воды в природе
Вода из жидкого состояния переходит в твердое при температуре 0º C (плюс/минус в зависимости от давления). Процесс перехода воды из жидкого состояния в твердое имеет интересную аномалию. При понижении температуры молекулы воды, как и в других материях, сближаются друг с другом. Так происходит вплоть до температуры 4º C. При этой температуре у воды максимальная плотность. При дальнейшем понижении температуры плотность начинает уменьшаться. Благодаря именно этому удивительному свойству лёд плавает, а не тонет. Плотность льда составляет приблизительно 90% от плотности воды.
Вода в твердом состоянии имеет как фиксированный объём, так и фиксированную форму.
Газообразное состояние воды в природе
Из жидкого состояния в парообразное вода переходит при температуре 100º C (плюс/минус в зависимости от давления). Водяной пар не всегда можно увидеть, но его можно почувствовать. Количество пара в атмосфере определяется как влажность. При повышенной влажности можно сказать, что по ощущениям воздух становится «липким».
Почему озера не испаряются?
Как вы уже догадались, это происходит из-за жары солнца. То же самое происходит, когда речь идет о больших водоемах, и из них испаряется вода. Однако мы практически не замечаем различий в уровне воды в озерах.
Для этого есть две основные причины: во-первых, количество воды, присутствующей в озерах и крупных водоемах, огромно (по крайней мере, по сравнению с тем, что вы могли бы иметь в стакане / ванне). Поэтому процесс испарения довольно медленный, поэтому вы не замечаете разницы в их уровнях воды.
Сказав, что теоретически, озера и пруды должны (и делать) высыхать через определенный период, от пары недель до нескольких месяцев, в зависимости от того, насколько велик объем воды. К счастью, это происходит не так часто, благодаря водному циклу!

Водный цикл
Вы почти наверняка изучали водный цикл несколько раз в старшей школе. Также называемый гидрологическим циклом, это процесс, через который вода сначала испаряется из озер, рек и океанов, поднимается через атмосферу, а затем возвращается на поверхность в виде осадков (например, дождь, снег, град и т. Д.).
Это означает, что вода, которую пруды и озера теряют за счет испарения, естественно откладывается обратно в них через дождь и другие точки доступа к воде. Существует несколько методов (подзарядка через реки, ручьи, строительство плотин и т. Д.), Через которые вода в озерах может быть пополнена, что гарантирует, что озеро не просто исчезнет! Сказав это, существует множество пресноводных организмов, которые в течение определенного периода времени высыхают, если этот уровень пополнения сильно перекошен.
Параметры, испарение воды
Особенность испарения в том, что расчет поверхности может показать не только скорость остывания жидкости, но и то, насколько быстро напитается влагой что-то, расположенное над влагой. Кроме того, есть также один важный момент. Расчет поверхности жидкости, которая испаряется в помещении, показывает, как скоро можно получить определенную влажность. И хотя конечный результат состоит из нескольких параметров, основной (скорость испарения), можно получить только лишь произведя расчет поверхности.
Что еще может повлиять на испарение воды? Конечно же, влажность воздуха. Расчет поверхности воды, разность температур и численное значение влажности. Все эти параметры, умноженные на определенный коэффициент, дадут тот самый результат, при котором комната наполнится нужным количеством влаги без особых усилий. Чем больше разница в параметрах, тем быстрее будет происходить испарение. Если же влажность в помещении приближена к 100%, то и ждать испарения не стоит: молекулам воды в насыщенном воздухе деваться просто некуда.
Вода — жидкость
Если рассматривать воду более глобально, то это источник жизни, основной составляющий элемент человеческого организма. Она необходима всем: людям, животным, растениям.
Большая часть водных запасов нашей планеты представлена в жидком состоянии в виде морей и океанов. На них приходится около 97 процентов. Оставшиеся проценты относятся к рекам, озерам, небольшим прудам, а также подземным водам.
Пресная вода прозрачна, он отличается отсутствием запаха, безвкусием, податливостью формы. Несмотря на это, она имеет огромную силу, ей подвластно растворять многие вещества, ее потоки могут разрушить даже очень твердые горные породы, тем самым изменяя рельеф планеты.
В жидком состоянии вода нашла широкое применение у людей. Мы ее используем как питье, для поддержания чистоты и гигиены, ею поливаем растения.
В таком состоянии вода пребывает при температуре от 0 до 100 градусов.
Лед в любом виде
 Собственно, теперь можно перейти и к твердому. Это лед, который на полюсах покрывает нашу планету толстым слоем в несколько километров, который существует на горных вершинах и который временами спускается даже до 50-ых параллелей в виде айсбергов. Таким образом, несмотря на то, что лед в нормальном состоянии представляет собой твердое и плотное вещество, разрушается оно очень легко. Обладает оригинальным свойством частичного плавления при сильном нагревании, но в целом может храниться очень долго, понижая температуру окружающего воздуха. Обратное свойство также доступно, поскольку состояние воды часто зависит от температуры. Ведь появление града летом – это явление резкого понижения температуры в верхних слоях атмосферы.
Собственно, теперь можно перейти и к твердому. Это лед, который на полюсах покрывает нашу планету толстым слоем в несколько километров, который существует на горных вершинах и который временами спускается даже до 50-ых параллелей в виде айсбергов. Таким образом, несмотря на то, что лед в нормальном состоянии представляет собой твердое и плотное вещество, разрушается оно очень легко. Обладает оригинальным свойством частичного плавления при сильном нагревании, но в целом может храниться очень долго, понижая температуру окружающего воздуха. Обратное свойство также доступно, поскольку состояние воды часто зависит от температуры. Ведь появление града летом – это явление резкого понижения температуры в верхних слоях атмосферы.
Жидкость — газ
Нагревание жидкости вызывает большой рост температуры, который постоянно увеличивается при нагревании, пока не достигнет максимальной точки. Выделяется огромное количество тепла, чтобы произошел этот процесс. Если газ начинает охлаждаться, его температура постепенно понижается и при пиковой точке через теплоту парообразования газ возвращается в жидкое состояние. Пар может превратиться в воду только при потере тепла. Например, при кипении воды на кухне на стекле образуется пар, и окна запотевают, как только помещение начнет терять температуру, пар теряется в равновесии и капельками скапливается на подоконнике.
Даже тело человека более чем на 60% состоит из воды, она участвует в биохимических реакциях. Вода выводит из организма вредные вещества и яды, регулирует температуру тела человека. Вода относится к главному источнику энергетических ресурсов, используется в ГЭС и превращает механическую энергию воды в электричество. Ученые почти всех стран занимались исследованием воды, проводили опыты и лабораторные работы. Пар – жидкость в равновесии это такое состояние, когда два вещества находятся в фазе газовая, а испарение равно скорости образования конденсата. Одним словом, это система превращения пар-вода. Теория равновесия достигается даже в относительно замкнутом состоянии, когда происходит контакт воды и паров без вмешательства. В 2011 году было открыто гигантское облако пара, и ученые Гарвард-Смитсоновского центра сделали доклад по описанию явления. Однозначно вода есть и в других галактиках, так как главными ее составляющими являются водород и кислород.
Физика процесса
Переход вещества из жидкого состояния в парообразное в физике называется парообразованием.
Обратный процесс перехода из газообразного состояния в твёрдое или жидкое, называется конденсация. Например, скопление облаков или наступающий туман.
Выделяют два вида парообразования:
- испарение;
- кипение.
В первом случае необходимо достичь порога температуры плавления, преодолев его. А при кипении у каждого жидкого вещества своя определенная температура, до достижении которой образуется пар.
Область парообразования в этих случаях тоже отличается.
- При испарении пар образуется со свободной поверхности, которая граничит с окружающими ее газами – кислородом и др.
- При кипении образование пара происходит со всего объема жидкости.
Образование пара при кипении
Для наглядности посмотрим, как же образуется пар при кипении на рисунке № 1.
Пузырьки пара образуются во всем объеме жидкости, поднимаются на её поверхность и лопаются, высвобождая горячий пар в в воздух.
Когда вода кипятится, ей передается некоторое количество теплоты, благодаря чему у молекул воды увеличивается внутренняя энергия. Это приводит к тому, что эти молекулы беспорядочно движутся и сталкиваются друг с другом, за счет чего вода закипает.
Пар выделяется в растворенных газах, которые есть в воде. Именно пар как раз и находится в тех пузырьках, которые образуются при кипячении.
Пузырек лопается, чтобы высвободить постоянно увеличивающийся пар. Все это происходит под привыкший для всех нас звук бурления. Но многие пузырьки лопаются внутри воды, не успевая достичь свободной поверхности.
Формула
Физические процессы основаны на формулах. Не является исключением и парообразование.
Если величина будет показывать, сколько теплоты (дж) нужно для обращения жидкости (кг) в пар при испарении при указанной температуре в отсутствие ее изменения, тогда она будет называться удельной теплотой парообразования и конденсации. Обозначается она как L и при расчете используется формула:
Удельная теплота парообразования при различных температурах будет отличаться. Например, при достижении температуры кипения это значение будет самым низким.
Эта величина имеет особое значение во многих сферах производства, например при производстве металлов.
Выяснилось, что когда плавится железо, после его повторного затвердевания возникшая кристаллическая решетка оказывается намного прочнее предыдущей.
Определить удельную теплоту возможно только путем эксперимента, а ее основные значения уже давно установлены. Например, для спирта это 0,9*106, а для воды 2,3*106.
Изменяется удельная теплота парообразования воды и в зависимости от давления. Здесь наблюдается как раз обратная зависимость – когда давление воды увеличивается, снижается значение удельной теплоты парообразования.
При атмосферном давлении в 760 мм рт. ст. удельная теплота парообразования равна 2258 кДж/кг.
Характерным примером может явиться покорение альпинистами высоких гор.
На особых высотах (более 3000 м) из-за пониженного атмосферного давления, уменьшается и температура кипения воды (до 90°С), что усложняет процесс приготовления еды, поскольку требуется больше времени, чтобы произвести термическую обработку пищи.
А на более высоких местностях (около 7000 м.) готовить еду становится практически невозможно из-за падения температуры кипения до 50 °С.
При рассмотрении температуры воды необходимо упомянуть еще одну физическую величину – удельную теплоемкость. Она равняется количеству теплоты, необходимому для передачи единичной массе вещества, чтобы изменить его температуру на единицу.
Если теплота не сопровождается изменением температуры при изменении своего состояния, такая теплота называется скрытой. Скрытая теплота может наблюдаться как раз при парообразовании.
Она также отличается при разных жидкостях и изменяется в зависимости от давления.
При увеличении атмосферного давления и как следствие увеличении температуры жидкости, уменьшается скрытая теплота парообразования.
9. Водяной пар в кипящем чайнике
Знание этого свойства водяного пара позволило людям сконструировать паровые двигатели.

Рис. 17. Машина с паровым двигателем (Источник)
Часто, когда печется яблоко, его кожура лопается – это яблочный сок, превращаясь в пар, разрывает кожуру.

Рис. 18. Печеное яблоко (Источник)
Или можно услышать треск дров в печи – под воздействием высокой температуры вода в дровах превращается в водяной пар и разрывает древесину.

Рис. 19. Дровяная печь (Источник)
Как было сказано, водяной пар – невидим. Так почему же мы видим пар, когда кипит чайник? В холодном воздухе разогретый водяной пар конденсируется – превращается в мельчайшие капельки воды, которые мы видим как белый пар. А невидимый водяной пар находится возле носика чайника на границе белого облачка пара.

Рис. 20. Кипящий чайник (Источник)
Если поместить у носика кипящего чайника холодный металлический предмет, то очень скоро на нем появятся капельки осевшей воды. Этот опыт доказывает наличие водяного пара у носика чайника.
Рис. 21. Опыт по конденсации водяного пара у носика чайника (Источник)
источник конспекта:
http://interneturok.ru/ru/school/okruj-mir/3-klass/undefined/svoystva-vody-v-zhidkom-sostoyanii?seconds=0&chapter_id=826
http://interneturok.ru/ru/school/okruj-mir/3-klass/undefined/svoystva-vody-v-tverdom-sostoyanii
http://interneturok.ru/ru/school/okruj-mir/3-klass/undefined/svoystva-vody-v-gazoobraznom-sostoyanii
исчтоник презентации — http://prezentacii.com/biologiya/6000-tri-sostoyaniya-vody.html
источник видео:
https://www.youtube.com/watch?v=BsjlZH1kKbo
Диаграмма водяного пара
Чтобы отследить процесс наглядно, придумана диаграмма водяного пара, которая стала отличной заменой многочисленным таблицам и может определять величины в равновесии. Диаграмма составляется по таблице и не может быть точнее, ведь в таблице показатели идентичны, просто перенесены в виде определенного графика. Анализировать турбины лучше всего по T, s диаграмме, где осью абсцисс определена энтропия, а ординатой абсолютная температура. Линии по горизонтали на диаграмме обозначены изотермами, линии вертикальные называются изоэнтропами. Рассчитать анализ и работу турбины лучше всего подходит h, s –диаграмма. То, что в диаграмме выделено жирной линией обозначает сухой пар.
Пробная идея и конструкция
Как некоторые могли заметить во время приготовления чая или яиц, вода в горах кипит не при 100 ° C, а — в зависимости от высоты горы — при более низких температурах. Температура кипения тем ниже, чем меньше давление окружающей среды. Конечно, возникает вопрос: может ли вода кипеть при комнатной температуре даже при достаточном давлении? И какие интересные эффекты могут возникнуть? Экспериментальная установка на самом деле относительно проста, вам просто нужно добраться до необходимого оборудования:

Когда крышка и все вентиляционные клапаны закрыты, вы можете откачивать. Затем вы можете видеть через глазок, что происходит, и можете отслеживать давление в вакуумной камере и температуру на дне емкости для воды. Вид через глазок выглядит так:

Начальная температура воды составляет ° С. Это немного холоднее, чем комнатная температура, но это не имеет значения.
МКТ и немного жидкости
Конечно, все это несколько сложно для восприятия, ведь молекулярно-кинетическая теория была разработана уже в 19-м веке, когда физика дошла до составных частей элементарных веществ. Но все же, без этого никак нельзя понять, почему величина расстояния между молекулами, которые испаряются с поверхности воды, увеличивается. Причем увеличивается оно сразу же по нескольким причинам.
Первая причина очень простая и понятная всем и каждому: при переходе из одного агрегатного состояния в другое, молекулы раздвигаются вширь, промежутки между ними увеличиваются, а взаимодействие уменьшается. Вторая причина также не сложная: при нагревании молекулы двигаются быстрее, а потому они обретают большую энергию и получают за ее счет возможность оторваться от воздействия других молекул, расположенных поблизости. Если подумать, то ведь и переход в иное агрегатное состояние также возможен лишь при нагреве воды или иного вещества. Поэтому все сводится лишь к увеличению кинетической энергии.
Строение молекулы в различных агрегатных состояниях
Вода может быть в нескольких состояниях:
- Жидком. Это ее преимущественное состояние в нормальных условиях. Жидкая вода образует многочисленные реки, ручьи, озёра, Мировой океан.
- Твердом – это лед, а его кристаллы часто образуют иней или снег.
- Газообразном — водяной пар.
Существуют также и переходные состояния жидкости, которые возникают при замерзании или испарении.
Строение молекулы воды, водородная связь способствует расположению молекул воды. Рассмотрим особенности каждого агрегатного состояния по отдельности.
Лед
Представляет собой твердое состояние воды.
Молекулы воды образуют слои, причём каждая молекула связана с тремя молекулами в своём слое и с одной молекулой соседнего слоя. Расстояние между атомами кислорода ближайших молекул равно 0,276 нм.
Атом кислорода связан с четырьмя атомами водорода: с двумя, расположенными на расстоянии 0,096 — 0,102 нм посредством валентных связей, и с двумя другими, находящимися на расстоянии 0,174 — 0,180 нм посредством водородных связей.
Жидкая вода
В отличие от структуры льда структура жидкой воды исследована ещё недостаточно.
Предполагается, что жидкая вода по своему строению представляет нечто среднее между кристаллами льда и паром.
В результате изучения молекулы воды с помощью инфракрасных и рентгеновых лучей было видно, что при температуре близкой к точке замерзания, молекулы жидкой воды собираются в небольшие группы, практически так, как в кристаллах.
При температуре близкой к точке кипения они располагаются более свободно.
Водяной пар
Это газообразное агрегатное состояние воды.
При данном состоянии молекула воды не имеет структуры и состоит преимущественно из мономерных молекул воды, которые находятся на расстояние относительно друг друга.
Что такое испарение?
Классическое определение звучит так: испарение – это переход из жидкости в газ. При этом это термодинамический процесс, то есть такой, который происходит под воздействием температурных колебаний. Именно вследствие испарения количество любой жидкости в любой незакрытой емкости будет постепенно уменьшаться.
Какие же причины испарения? Физика объясняет это явление разницей температур на грани фазового перехода: жидкость обычно несколько холоднее окружающего воздуха. Если нет каких-то внешних влияний, испарение жидкостей происходит крайне медленно. Молекулы покидают жидкость вследствие диффузии, они переходят через полупроницаемую для жидкостей, но непроницаемую для газовых веществ поверхность раздела фаз массового потока.
Важно знать, что испарение всегда происходит только с поверхности жидкости, в этом основное отличие испарения от других форм парообразования. Атомы и молекулы испаряются не все сразу, а небольшими слоями, постепенно
Но, разумеется, со временем они могут испариться полностью.

Еще одной интересной особенностью испарения является тот факт, что оно может иметь разную направленность тепловых потоков. Они могут идти:
- из глубины жидкости к поверхности, а затем в воздух,
- только из жидкости к поверхности,
- к поверхности из воды и газовой среды одновременно,
- к площади поверхности только от воздуха.
Направленность тепловых потоков при испарении зависит от характера жидкости, температуры окружающего воздуха и фазового раздела. Эти три величины и их соотношение формируют формулу испарения.
Факторы, влияющие на скорость испарения
Учеными выделены такие основные факторы, которые имеют влияние на скорость испарения:
- Химические и физические свойства жидкости, характер связей между молекулами, плотность вещества. Чем ближе друг к другу расположены молекулы жидкости, тем им труднее набрать нужную скорость, чтобы вылететь и тем ниже скорость испарения, и тем больше температура кипения. К слову спирты и алкоголь улетучиваются гораздо быстрее, нежели просто вода.
- Температура. В отличии от явления кипения, испарение жидкости может происходить даже при минусовых температурах жидкости. Но все равно при понижении температуры скорость движения частиц уменьшается, и как следствие уменьшается скорость испарения.
- Размер поверхности. Тут все просто, чем больше площадь испарения, то есть площадь соприкосновения жидкости с воздухом, тем большей будет скорость испарения.
- Скорость ветра также может влиять на скорость испарения в природных условиях, так как быстрое движение воздуха «сдувает» молекулы с поверхности, увеличивая их скорость и кинетическую энергию.
- Атмосферное давление, чем оно ниже, тем быстрее испаряется любая жидкость.
Испаряется ли вода?
Вода испаряется. И испаряется она практически всегда. Представим себе Землю ледникового периода. Если бы влага не испарялась, абсолютно сухой воздух не дал бы шансов ни одному живому существу продержаться дольше нескольких дней. Но ведь этот период был пройден, хотя и длился несколько тысяч лет. Что же это означает? Это означает, что вода испаряется при температуре в ноль и ниже градусов. Если вы думаете, что это невероятно, то вы ошибаетесь, потому что современными учеными уже точно доказано: испаряется даже лед.
Многие представляют себе процесс испарения не более как кипение жидкости, которая нагрета до соответствующей температуры. Но как же тогда быть с туманом? С тем, что происходит с реками поздней осенью? Испарение происходит при любой температуре, начиная с самых низких, которые только могут быть на нашей планете, и заканчивая непосредственной температурой кипения воды. Достаточно лишь, чтобы условия были подходящими.
Какие существуют особенности в строении твердых тел?
Имеющиеся различия между основными агрегатными состояниями материи объясняются взаимодействием между атомами, ионами и молекулами. Например, почему твердое агрегатное состояние вещества приводит к способности тел сохранять объем и форму? В кристаллической решетке металла или соли структурные частицы притягиваются другу к другу. В металлах положительно заряженные ионы взаимодействуют с так называемым «электронным газом» — скоплением свободных электронов в куске металла. Кристаллы солей возникают благодаря притяжению разноименно заряженных частиц — ионов. Расстояние между вышеперечисленными структурными единицами твердых тел намного меньше, чем размеры самих частиц. В этом случае действует электростатическое притяжение, оно придает прочность, а отталкивание недостаточно сильное.
Чтобы разрушить твердое агрегатное состояние вещества, надо приложить усилия. Металлы, соли, атомные кристаллы плавятся при очень высоких температурах. К примеру, железо становится жидким при температуре выше 1538 °С. Тугоплавким является вольфрам, из него изготавливают нити накаливания для электрических лампочек. Есть сплавы, которые становятся жидкими при температурах свыше 3000 °С. Многие горные породы и минералы на Земле находятся в твердом состоянии. Добывают это сырье с помощью техники в шахтах и карьерах.

Для отрыва даже одного иона от кристалла необходимо затратить большое количество энергии. Но ведь достаточно растворить соль в воде, чтобы кристаллическая решетка распалась! Это явление объясняется удивительными свойствами воды как полярного растворителя. Молекулы Н2О взаимодействуют с ионами соли, разрушая химическую связь между ними. Таким образом, растворение — это не простое перемешивание разных веществ, а физико-химическое взаимодействие между ними.
Конденсация с точки зрения физики
Давайте более подробно рассмотрим процесс превращения отдельных молекул воды, которые представляют собой пар, в нормальную жидкость. Условия этого мы уже перечислили, поэтому ни для кого не секрет, что наличие охлажденных поверхностей – это основной фактор. Переход пара в жидкое состояние (поскольку его температура резко падает при соприкосновении молекул с поверхностью) обеспечивается соединением нескольких молекул H2O в единое целое. Как это происходит с точки зрения физики?
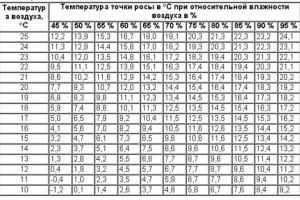 Допустим, что имеется насыщенный водой воздух. В нем постоянно движутся согласно теории броуновского движение несколько миллионов молекул, сталкиваются друг с другом и передают друг другу энергию. В том случае, если происходит столкновение с охлажденной поверхностью, то ей передается основная часть энергии и образуется небольшая молекулярная либо электрическая связь. Химических ионных связей не возникает, поэтому на металле, к примеру, остаются капли чистой воды. Рано или поздно некоторое количество молекул столкнется с холодным металлом, поэтому нет никаких сомнений, что определенная масса воды окажется именно водой, а не отдельными молекулами H2O. Температура, при которой появляется влага из пара, называется точкой росы.
Допустим, что имеется насыщенный водой воздух. В нем постоянно движутся согласно теории броуновского движение несколько миллионов молекул, сталкиваются друг с другом и передают друг другу энергию. В том случае, если происходит столкновение с охлажденной поверхностью, то ей передается основная часть энергии и образуется небольшая молекулярная либо электрическая связь. Химических ионных связей не возникает, поэтому на металле, к примеру, остаются капли чистой воды. Рано или поздно некоторое количество молекул столкнется с холодным металлом, поэтому нет никаких сомнений, что определенная масса воды окажется именно водой, а не отдельными молекулами H2O. Температура, при которой появляется влага из пара, называется точкой росы.
Может оказаться и так, что пар перейдет в снег. Здесь принцип абсолютно такой же, но здесь влага на молекулярном уровне собирается вокруг пылинок или мельчайших твердых объектов, замерзает и меняет свою форму. В итоге из нескольких сотен маленьких молекул можно получить приятную снежинку. Как в естественных, так и в искусственных условиях добиться этого не составляет никакого труда. Можно также добавить, что снежинка будет обладать различной формой при различной температуре замерзания, о чем мы уже говорили ранее
Так что обратите внимание на эти свойства, чтобы можно было впоследствии провести опыт самостоятельно