Вода и лед
Содержание:
- ПРИМЕНЕНИЕ
- Классификации
- Тяжелая вода.
- Гидраты.
- Последствия от наркотика
- Определение
- Названия льда
- Ледяные блины
- Молекулярные кристаллические решетки
- Давление порождает тяжёлые льды
- Получение[править | править код]
- Признаки употребления кристалла
- Фазы льда
- Ледовые карты
- СВОЙСТВА
- Свойства льда — свойства воды в твердом состоянии
- История появления вещества кристалл (лёд)
ПРИМЕНЕНИЕ

Иглу из льда
В конце 1980-х годов лаборатория Аргонн разработала технологию изготовления ледяной гидросмеси (Ice Slurry), способной свободно течь по трубам различного диаметра, не собираясь в ледяные наросты, не слипаясь и не забивая системы охлаждения. Солёная водяная суспензия состояла из множества очень мелких ледяных кристалликов округлой формы. Благодаря этому сохраняется подвижность воды и, одновременно, с точки зрения теплотехники она представляет собой лёд, который в 5—7 раз эффективнее простой холодной воды в системах охлаждения зданий. Кроме того, такие смеси перспективны для медицины. Опыты на животных показали, что микрокристаллы смеси льда прекрасно проходят в довольно мелкие кровеносные сосуды и не повреждают клетки. «Ледяная кровь» удлиняет время, в течение которого можно спасти пострадавшего. Скажем, при остановке сердца это время удлиняется, по осторожным оценкам, с 10—15 до 30—45 минут.
Использование льда в качестве конструкционного материала широко распространено в приполярных регионах для строительства жилищ — иглу. Лёд входит в состав предложенного Д. Пайком материала Пайкерит, из которого предлагалось сделать самый большой в мире авианосец.
Лед (англ. Ice) — H2O
| Молекулярный вес | 18.02 г/моль |
| Происхождение названия | от среднеанглийского «is» или «iis», относящийся к голландскому «ijs» и германскому «eis» |
| IMA статус | действителен |
Классификации
Морской лёд по своему местоположению и подвижности разделяется на три типа:
- припай,
- плавучие (дрейфующие) льды,
- паковые многолетние льды (пак).
Прогноз изменения толщины ледового покрова к 2050 году
По стадиям развития льда выделяют несколько так называемых начальных видов льда (в порядке времени образования):
- ледяные иглы,
- ледяное сало,
- снежура,
- шуга,
- внутриводный (в том числе донный или якорный), образующийся на некоторой глубине и находящихся в воде предметах в условиях турбулентного перемешивания воды.
Дальнейшие по времени образования виды льда — ниласовые льды:
- нилас, образующийся при спокойной поверхности моря из сала и снежуры (тёмный нилас до 5 см толщиной, светлый нилас до 10 см толщиной) — тонкая эластичная корка льда, легко прогибающаяся на воде или зыби и образующая при сжатии зубчатые наслоения;
- склянки, образующиеся в распреснённой воде при спокойном море (в основном, в заливах, около устьев рек) — хрупкая блестящая корка льда, которая легко ломается под действием волны и ветра;
- блинчатый лёд, образующийся при слабом волнении из ледяного сала, снежуры или шуги или вследствие разлома в результате волнения склянки, ниласа или так называемого молодого льда. Представляет собой пластины льда округлой формы от 30 см до 3 м в диаметре и толщиной 10—15 см с приподнятыми краями из-за обтирания и ударов льдин.
Дальнейшей стадией развития льдообразования являются молодые льды, которые подразделяются на серый (толщина 10—15 см) и серо-белый (толщиной 15—30 см) лёд.
Морской лёд, развивающийся из молодого льда и имеющий возраст не более одного зимнего периода, называется однолетним льдом. Этот однолетний лёд может быть:
- тонким однолетним льдом — белый лёд толщиной 30—70 см,
- средней толщины — 70—120 см,
- толстым однолетним льдом — толщиной более 120 см.
Если морской лёд подвергался таянию хотя бы в течение одного года, он относится к старым льдам. Старые льды подразделяются на:
- остаточный однолетний — не растаявший летом лёд, находящийся вновь в стадии замерзания,
- двухлетний — просуществовавший более одного года (толщина достигает 2 м),
- многолетний — старый лёд толщиной 3 м и более, переживший таяние не менее двух лет. Поверхность такого льда покрыта многочисленными неровностями, буграми, образовавшимися в результате неоднократного таяния. Нижняя поверхность многолетних льдов также отличается большой неровностью и разнообразием формы.
Исследование морского льда на Северном полюсе
Толщина многолетних льдов в Северном Ледовитом океане в некоторых районах достигает 4 м.
В антарктических водах в основном находится однолетний лёд толщиной до 1,5 м, который исчезает в летнее время.
По структуре морской лёд условно делится на игольчатый, губчатый и зернистый, хотя обычно он встречается смешанной структуры.
Тяжелая вода.
В 1931 Г.Юри показал, что при испарении жидкого водорода его последние фракции оказываются тяжелее обычного водорода вследствие содержания в них в два раза более тяжелого изотопа. Этот изотоп называется дейтерием и обозначается символом D. По своим свойствам вода, содержащая вместо обычного водорода его тяжелый изотоп, существенно отличается от обычной воды.
В природе на каждые 5000 массовых частей Н2О приходится одна часть D2O. Это соотношение одинаково для речной, дождевой, болотной воды, подземных вод или кристаллизационной воды. Тяжелая вода используется в качестве метки при исследовании физиологических процессов. Так, в моче человека соотношение между Н и D тоже равно 5000:1. Если дать пациенту выпить воду с большим содержанием D2O, то, последовательно измеряя долю этой воды в моче, можно определить скорость выведения воды из организма. Оказалось, что около половины выпитой воды остается в организме даже спустя 15 сут. Тяжелая вода, вернее, входящий в ее состав дейтерий – важный участник реакций ядерного синтеза.
Третий изотоп водорода – тритий, обозначаемый символом Т. В отличие от первых двух он радиоактивен и обнаружен в природе лишь в малых количествах. В пресноводных озерах соотношение между ним и обычным водородом равно 1:1018, в поверхностных водах – 1:1019, в глубинных водах он отсутствует. См. также ВОДОРОД.
Гидраты.
Многие соединения всегда содержат определенное число молекул воды и называются поэтому гидратами. Природа образующихся при этом связей может быть разной. Например, в пентагидрате сульфата меди, или медном купоросе CuSO4Ч5H2O, четыре молекулы воды образуют координационные связи с ионом сульфата, разрушающиеся при 125° С; пятая же молекула воды связана так прочно, что отрывается лишь при температуре 250° С. Еще один стабильный гидрат – серная кислота; она существует в двух гидратных формах, SO3ЧH2O и SO2(OH)2, между которыми устанавливается равновесие. Ионы в водных растворах тоже часто бывают гидратированы. Так, Н+ всегда находится в виде иона гидроксония Н3О+ или Н5О2+; ион лития – в виде Li (H2O)6+ и т.д. Элементы как таковые редко находятся в гидратированной форме. Исключение составляют бром и хлор, которые образуют гидраты Br2Ч10 H2O и Cl2Ч6H2О. Некоторые обычные гидраты содержат кристаллизационную воду, например хлорид бария BaCl2Ч2H2O, английская соль (сульфат магния) MgSO4Ч7H2O, питьевая сода (карбонат натрия) Na2CO3Ч10 H2O, глауберова соль (сульфат натрия) Na2SO4Ч10 H2O. Соли могут образовывать несколько гидратов; так, сульфат меди существует в виде CuSO4Ч5H2O, CuSO4Ч3H2O и CuSO4ЧH2O. Если давление насыщенного пара гидрата больше, чем атмосферное давление, то соль будет терять воду. Этот процесс называется выцветанием (выветриванием). Процесс, при котором соль поглощает воду, называется расплыванием.
Последствия от наркотика
Кристалл наносит непоправимый вред всему человеческому организму. Нарушаются функции всех жизненно важных систем.Происходит деградация психики, начинаются панические атаки и приступы шизофрении. Резко снижается иммунитет ,что неизбежно приводит к ускоренному старению. Появляется тромбоз вен и тромбофлебит. И безусловно все последствия,если их вовремя не предотвратить ,приводят к неизбежности- это мучение и смерть.
Отсутствие времени чтобы просто поговорить со своими близкими,уделить им внимание,протянуть руку помощи- все что нужно порой человеку, чтобы не ступить на этот скользкий путь наркотической зависимости. Если вы заметили какие либо изменение в поведении ваших близких, задумайтесь! Может им нужна ваша помощь? Самостоятельно справится с наркотической зависимостью удаётся единицам
Если вы столкнулись с такой проблемой,незамедлительно обратитесь к специалистам
Если вы заметили какие либо изменение в поведении ваших близких, задумайтесь! Может им нужна ваша помощь? Самостоятельно справится с наркотической зависимостью удаётся единицам. Если вы столкнулись с такой проблемой,незамедлительно обратитесь к специалистам.
Определение
 Кристаллическая решётка — особая структура твёрдого вещества, при которой частицы стоят в геометрически строгом порядке в пространстве. В ней можно обнаружить узлы — места, где расположены элементы: атомы, ионы и молекулы и межузловое пространство.
Кристаллическая решётка — особая структура твёрдого вещества, при которой частицы стоят в геометрически строгом порядке в пространстве. В ней можно обнаружить узлы — места, где расположены элементы: атомы, ионы и молекулы и межузловое пространство.
Твёрдые вещества
, в зависимости от диапазона высоких и низких температур, являются кристаллическими или аморфными — они характеризуются отсутствием определённой температуры плавления. При воздействии повышенных температур они размягчаются и постепенно переходят в жидкую форму. К такого рода веществам относятся: смола, пластилин.
В связи с этим можно поделить на несколько видов:
- атомную;
- ионную;
- молекулярную;
- металлическую.
Но при различных температурах одно вещество может иметь различные формы и проявлять многообразные свойства. Это явление называется аллотропной модификацией.
Названия льда
1. У льда есть множество разных названий.
Только у морского льда есть несколько названий, не говоря уже про лед в Арктике и Антарктике. Мелкобитый лёд, внутриводный лёд, нилас, и блинчатый лёд — это лишь часть того, что можно найти в Арктике и Антарктиде.
Если вы будете проплывать около северного или южного полюса, то вам лучше знать, где айсберг, а где подошва припая (лед, скреплённый с берегом или дном), в чем разница между подторосом и торосом, и между плавучей льдиной и флобергом (плавучая гора).
Но если вам кажется, что этих слов вам более, чем достаточно, то вы удивитесь, узнав, что народ Аляски инупиаты имеют 100 различных названии льда, что логично для народа, который живет в холодных местах.
Ледяные блины
Ученые провели ещё одно наблюдение. Если при низкой температуре продолжается волнение, то тончайшие пленки собираются в блины диаметром около 30 см. Далее они смерзаются в один слой, толщина которого не меньше 10 см. На ледяные блины сверху и снизу намерзает новый слой льда. Так образуется толстый и прочный ледяной покров. Его прочность зависит от видов: самый прозрачный лед будет в несколько раз прочнее белого льда. Экологи заметили, что 5-сантиметровый лёд выдерживает вес взрослого человека. Слой в 10 см способен выдержать легковую машину, но следует помнить, что выходить на лед в осеннее и весеннее время очень опасно.

Молекулярные кристаллические решетки
В узлах молекулярной кристаллической решетки находятся молекулы, связанные между собой силами Ван-дер-Ваальса. Такие решетки образуют водород, хлор, азот, оксид углерода (IV) и многие органические соедини. Вследствие небольшой энергии взаимодействия частиц молекулярные кристаллы плавятся при низких температурах и легко растворяются в различных жидкостях (табл. 10).
Молекулы, имеющие разветвленное строение, образуетболее компактную кристаллическую структуру. Силы Взаимодействия между ними оказываются при этом гораздо выше, чем для не разветвленных молекул. Поэтому соединения с близкой молекулярной массой, но неодинаковым строением имеют различные температуры плавления (сравним, например, «-гептан и 2, 2, 3-триметилбутанв таблице 10).
Взаимодействие между молекулами усиливается также с усложнением строения их электронных оболочек и увеличением полярности. Температуры плавления полярных веществ существенно выше температур плавления неполярных соединений. От полярности молекул сильно зависит растворимость молекулярных кристаллов. Большое значение при этом играет соотношение между размерами полярной и неполярной части молекул. Например, уксусная кислота Н3С—СООН смешивается с водой в любых отношениях, в то время как растворимость стеариновой кислоты составляет при 25°С всего лишь 0,03 г на 100 г Н2О.
Для соединений, молекулы которых имеют полярные группы О—Н, N—Н, S—Н, структура кристаллов определяется в основном энергией водородных связей и характером их расположения в пространстве. Наличием большого числа водородных связей
объясняется, в частности, своеобразная структура льда.
Поскольку каждая молекула воды имеет два атома водорода и две не поделенные пары электронов, она может образовать четыре водородные связи:
В изолированной молекуле воды расстояние между ядрами атомов водорода и кислорода составляет примерно 0, 096 нм, а угол между направлениями связей О — Н равен 105°. В твердом и жидком состояниях параметры молекул Н2О незначительно изменяются. В кристаллической решетке льда вследствие образования водородных связей угол НОН приближается к тетраэдрическому (109,5°), а расстояние между ядрами атомов водорода и кислорода увеличивается до 0,099 нм.
Кристаллы льда принадлежат к гексагональной системе. Каждая молекула воды связана водородными связями с четырьмя другими молекулами. Вследствие относительно большой длины этих связей упаковка молекул Н2О оказывается очень неплотной, в структуре льда на каждые 46 молекул воды приходится шесть пустот диаметром 0,59 нм и две пустоты диаметром 0,52 нм.
За счет включения в полости кристалла молекул хлора, аргона, ксенона и некоторых других газов возникают так называемые клатратные соединения или соединения включения. Их образование с последующим разрушением применяется для разделения углеводородов и некоторых других веществ. Клатраты используют также как удобную форму хранения газов.
Если внедряющиеся молекулы газа сравнительно невелики (Аr, Хе, СН4, СO2), то они занимают все восемь пустот. Образующиеся при этом клатраты имеют состав X•5,75Н2О (8:46= 1:5,75). Более крупные частицы занимает только шесть пустот. Предельное отношение числа внедренных молекул к числу молекул воды составляет в этом случае 6:46=1:7,67. Например, при охлаждении Хлорной воды выпадают кристаллы гидрата хлора, имеющие состав Сl2•8Н2O.
При атмосферном давлении лед плавится при 0°С. С точки зрения молекулярно-кинетической теории плавление льда происходит при такой температуре, когда энергия теплового движения молекул оказывается достаточной для разрыва большинства водородных связей. Тетраэдрическая структура льда разрушается, и вода переходит в жидкое состояние. В жидкой воде существует подвижное равновесие: действие водородных связей воссоздает в каждый момент времени в каждом элементе объема тетраэдрическую структуру льда, а тепловое движение молекул эту структуру разрушает.
Плавление льда сопровождается поглощением тепловой энергии в количестве 6,01 кдж/моль.Большая часть ее расходуется на разрыв водородных связей.
Давление порождает тяжёлые льды
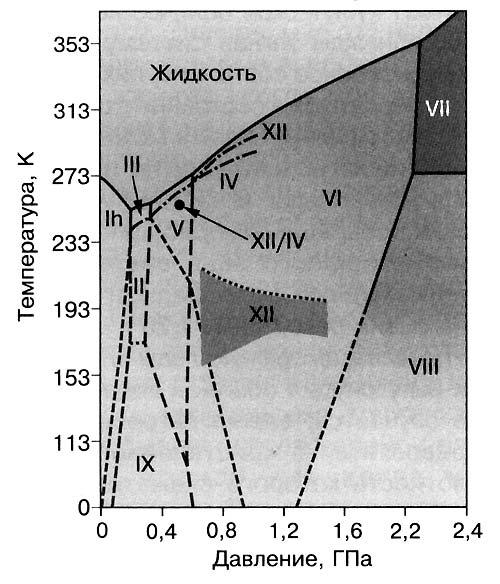 Рис. 3. Диаграмма состояния кристаллических льдов |
Читатель
уже, наверное, и сам догадался, что игры со льдами, как
правило, связаны с их охлаждением до температур сухого
льда, жидкого азота, а то и гелия, а также
со сжатием до давления в тысячи атмосфер. Общее
представление о результатах можно получить, глядя на рисунок 3, где показана диаграмма состояния кристаллических льдов. Детали же таковы.
Многие льды высокого давления можно сохранить
и при нормальном давлении. Для этого их охлаждают
в жидком азоте, а затем давление сбрасывают. Именно
на таких закалённых льдах и были проведены основные
исследования. Они показали, что их строение весьма
разнообразно.
Структуру первого льда высокого давления, льда II, определили
на заре исследований в этой области, когда появились первые
мощные приборы для рентгеноструктурного анализа, а именно
в 1964 году. Как оказалось, этот лёд состоит
из полых колонок, образованных шестизвенными гофрированными
циклами. Каждая колонка окружена шестью такими же колонками,
сдвинутыми друг относительно друга на треть периода. Структуру
этого льда можно получить, если часть сот льда Ih развалить и превратить их в ажурные каркасы, связывающие остальные соты (рис. 4).
При этом размер получившихся шестигранных каналов сильно
увеличивается — именно у льда II самые широкие каналы,
их диаметр составляет 3 Å. В таких каналах могут располагаться атомы гелия, неона и даже молекулы водорода.
|
Рис. 4. Лёд II |
Главная
странность, связанная с льдом II, состоит в том, что
в чистом виде его никто не получал —
он стабилизируется в присутствии следовых количеств газов.
Если, например, давление создают с помощью гелия, он неизбежно
растворится в замерзающей воде. Есть сведения, что аргон —
другой инертный газ, пригодный для использования в этой
установке, — тоже способен дать твёрдые растворы. А расположен
лёд II на диаграмме состояния между льдом III
и льдом IX. Они различаются между собой упорядочением
протонов, кислородный же каркас у них одинаков: спирали
из одних молекул воды, как будто нанизанные на оси
из других молекул воды (рис. 5).
|
Рис. 5. Льды III и IX обладают одинаковыми каркасами |
Исследования
льда III проводить сложно: нет никакой возможности его закалить.
При охлаждении до температуры жидкого азота, 78К,
он неизбежно упорядочивается и становится льдом IX.
Расположение льда II с его оригинальной структурой между двумя
столь похожими льдами представляется не совсем законным, однако
исследователи всё-таки считают его настоящим льдом.
Получить гидраты того же гелия на основе льда II можно двумя способами. Во-первых, приложить (в атмосфере гелия) к воде давление в 0,28–0,5 ГПа и охладить её до 250–270К. Хотя в этой области диаграммы стабильны льды III и V, получится гидрат на основе льда II. Что интересно, протоны в нём уже упорядочены. (Обычно они упорядочиваются только при сильном охлаждении уже получившегося льда.) Во-вторых, можно растворить гелий во льду Ih при низкой температуре и давлении 0,3 ГПа.
Появление гелия приводит к расширению кристаллической решётки,
и затем её нагрев до 180К помогает пройти структурному
превращению.
Относительная лёгкость получения твёрдых растворов
в льду II, а также его высокий потенциал в качестве
хранилища газообразного водорода (одна молекула газа на шесть молекул воды) привлекают к нему внимание учёных-практиков: сейчас активно обсуждается возможность его применения в водородной энергетике
Получение[править | править код]
Плотный лёд может быть добыт любым инструментом с чарами «Шёлковое касание». При разрушении чем-то другим из блока ничего не выпадает.
Разрушениеправить | править код
| Блок | Плотный лёд |
|---|---|
| Прочность | 0.5 |
| Инструмент | |
| Время разрушения | |
| Рука | 0.75 |
| Деревянная | 0.4 |
| Каменная | 0.2 |
| Железная | 0.15 |
| Алмазная | 0.1 |
| Незеритовая | 0.1 |
| Золотая | 0.1 |
- Время для незачарованных инструментов в секундах.
Естественное появлениеправить | править код
Плотный лёд генерируется в биоме с ледяными шипами. Также из него состоят айсберги в замёрзших океанах.
Плотный лёд генерируется в окнах иглу.[Только для Bedrock Edition]
Плотный лёд генерируется в деревнях биома снежной тундры.
Признаки употребления кристалла
Наркоманы старательно скрывают факт употребления, но сделать это чрезвычайно сложно. Синтетический наркотик лед влияет на состояние здоровья и психики, поведение наркозависимого. Изменения настолько очевидны, что даже далеки от наркологии люди понимают, что человек ведет себя неестественно и странно. Даже посторонние граждане отмечают нездоровое расширение зрачков наркомана, которое длится довольно долго. Взгляд потребителя наркотика выглядит бессмысленным и отрешенным.

Наркоман пьет из лужи после употребления
После приема дозы наркоман испытывает сильнейшую жажду, больной иногда пьет на глазах у изумленной публики прямо из лужи. Подобный симптом есть и у потребителей опиатов, но безумный взгляд характерен именно для любителей кристалла.
При регулярном употреблении развиваются следующие признаки наркомании.
- Длительная бессонница, иногда длящаяся по десять дней.
- Несвязная и нечеткая речь.
- Гримасничанье.
- Судороги челюсти.
- Сильная бледность лица.
- Потеря аппетита и стремительное похудение, проходящее незаметно от самого наркомана.
Родственникам следует обратить внимание на поведение близкого. Если он поначалу бодрый, радостный, уверенный в своих силах герой, чувствует свое превосходство над другими людьми, но вскоре преображается в пессимистичного, испуганного ребенка, то это косвенные признаки приема стимулирующих психику препаратов
Такие наркоманы часто в периоды подъема строят грандиозные планы, которые никогда не воплощают в жизнь.
Наркоманы скрытны, они не разговаривают по телефону в присутствии родственников, используют в своей речи непонятные слова. В периоды под действием соли наркозависимые любят выполнять однообразную кропотливую работу с повторяющимися монотонными действиями. Зависимые не следят за собой, что особенно заметно в отношении женщин, которые перестают пользоваться косметикой и расчесываться. На замечания по поводу неряшливости в одежде и комнате они просто отмахиваются, считая это несущественными мелочами.
Фазы льда
| Фаза | Характеристики |
|---|---|
| Аморфный лёд | Аморфный лёд не обладает кристаллической структурой. Он существует в трех формах: аморфный лёд низкой плотности (LDA), образующийся при атмосферном давлении и ниже, аморфный лёд высокой плотности (HDA) и аморфный лёд очень высокой плотности (VHDA), образующийся при высоких давлениях. Лёд LDA получают очень быстрым охлаждением жидкой воды («сверхохлаждённая стекловидная вода», HGW), или конденсацией водяного пара на очень холодной подложке («аморфная твёрдая вода», ASW), или путём нагрева высокоплотностных форм льда при нормальном давлении («LDA»). |
| Лёд Ih | Обычный гексагональный кристаллический лёд. Почти весь лёд на Земле относится ко льду Ih, и только очень малая часть — ко льду Ic. |
| Лёд Ic | Метастабильный кубический кристаллический лёд. Атомы кислорода расположены как в .Его получают при температуре в диапазоне от −133 °C до −123 °C, он остаётся устойчивым до −73 °C, а при дальнейшем нагреве переходит в лёд Ih. Он изредка встречается в верхних слоях атмосферы. |
| Лёд II | Тригональный кристаллический лёд с высокоупорядоченной структурой. Образуется изо льда Ih при сжатии и температурах от −83 °C до −63 °C. При нагреве он преобразуется в лёд III. |
| Лёд III | Тетрагональный кристаллический лёд, который возникает при охлаждении воды до −23 °C и давлении 300 МПа. Его плотность больше, чем у воды, но он наименее плотный из всех разновидностей льда в зоне высоких давлений. |
| Лёд IV | Метастабильный тригональный лёд. Его трудно получить без нуклеирующей затравки. |
| Лёд V | Моноклинный кристаллический лёд. Возникает при охлаждении воды до −20 °C и давлении 500 МПа. Обладает самой сложной структурой по сравнению со всеми другими модификациями. |
| Лёд VI | Тетрагональный кристаллический лёд. Образуется при охлаждении воды до −3 °C и давлении 1,1 ГПа. В нём проявляется дебаевская релаксация. |
| Лёд VII | Кубическая модификация. Нарушено расположение атомов водорода; в веществе проявляется дебаевская релаксация. Водородные связи образуют две взаимопроникающие решётки. |
| Лёд VIII | Более упорядоченный вариант льда VII, где атомы водорода занимают, очевидно, фиксированные положения. Образуется изо льда VII при его охлаждении ниже 5 °C. |
| Лёд IX | Тетрагональная метастабильная модификация. Постепенно образуется изо льда III при его охлаждении от −65 °C до −108 °C, стабилен при температуре ниже −133 °C и давлениях между 200 и 400 МПа. Его плотность 1,16 г/см³, то есть, несколько выше, чем у обычного льда. |
| Лёд X | Симметричный лёд с упорядоченным расположением протонов. Образуется при давлениях около 70 ГПа. |
| Лёд XI | Ромбическая низкотемпературная равновесная форма гексагонального льда. Является сегнетоэлектриком. |
| Лёд XII | Тетрагональная метастабильная плотная кристаллическая модификация. Наблюдается в фазовом пространстве льда V и льда VI. Можно получить нагреванием аморфного льда высокой плотности от −196 °C до примерно −90 °C и при давлении 810 МПа. |
| Лёд XIII | Моноклинная кристаллическая разновидность. Получается при охлаждении воды ниже −143 °C и давлении 500 МПа. Разновидность льда V с упорядоченным расположением протонов. |
| Лёд XIV | Ромбическая кристаллическая разновидность. Получается при температуре ниже −155 °C и давлении 1,2 ГПа. Разновидность льда XII с упорядоченным расположением протонов. |
| Лёд XV | Псевдоромбическая кристаллическая разновидность льда VI с упорядоченным расположением протонов. Можно получить путём медленного охлаждения льда VI примерно до −143 °C и давлении 0,8-1,5 ГПа. |
| Лёд XVI | Кристаллическая разновидность льда с наименьшей плотностью (0,81 г/см3) среди всех экспериментально полученных . Имеет строение топологически эквивалентное полостной структуре (англ. sII) газовых гидратов. |
| Лёд XVII | Кристаллическая разновидность льда с меньшей кристаллографической плотностью (0,85 г/см3), чем у других экспериментально полученных . Его структура, как и у льда XVI, сходна с клатратной структурой газовых гидратов. Получается при температуре 280 К и давлении ~ 400 МПа. Его номинальный состав (Н2О)2Н2 с тремя формульными единицами на элементарную ячейку. |
Новые исследования формирования водяного льда на ровной поверхности меди при температурах от −173 °C до −133 °C показали, что сначала на поверхности возникают цепочки молекул шириной около 1 нм не гексагональной, а пентагональной структуры.
Ледовые карты
Общее представление о распределении льда в районе плавания дает ледовая карта. Информацию о состоянии льда получают с помощью искусственных спутников Земли, самолетов и вертолетов ледовой разведки, судовых наблюдений, береговых пунктов наблюдений, автоматических дрейфующих ледовых станций. С использованием всей этой информации береговыми службами подготавливаются ледовые карты, которые передаются на суда.
Решение о движении судна во льдах принимается на основе анализа ледовых карт, на которых в виде символов отображаются характеристики ледового покрова. Главным условным знаком в этой системе символов является овал, в котором указываются основные навигационные характеристики льда (рис. 1), где буквой С обозначена общая сплоченность льда в баллах.
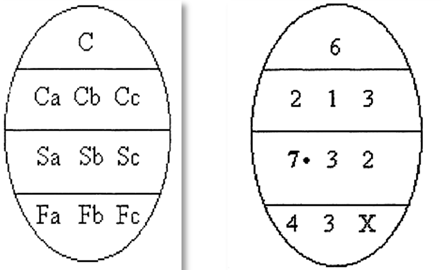 Рис. 1 Овальный символ морского льда
Рис. 1 Овальный символ морского льда
- Са, Сb, Сс — сплоченность льда самого толстого (Са), менее толстого (Сb) и третьего по толщине (Сс), баллы;
- Sa, Sb, Sc — возраст льда, сплоченность которого, соответственно, равна Са, Сb, Сс;
- Fa, Fb, Fc — преобладающие формы льда, возраст которого, соответственно, равен Sa, Sb, Sc.
Для возраста льда используются следующие основные цифровые символы:
- 1 — начальные виды льда;
- 2 — нилас, толщиной до 10 см;
- 3 — молодой лед, толщиной 10 – 30 см;
- 4 — молодой лед, толщиной 10 – 15 см;
- 5 — молодой лед, толщиной 15 – 30 см;
- 6 — однолетний лед, толщиной 30 -250 см;
- 7 — старый лед, толщиной более 250 см;
- Δ — материковый лед;
- X — возраст неизвестен.
Для обозначения формы ледяных образований применяются следующие цифровые символы:
- 1 — тертый лед или ледяная каша;
- 2 — мелкобитый лед;
- 3 — крупнобитый лед;
- 4 — обломки ледяных полей;
- 5 — большие ледяные поля;
- 6 — обширные ледяные поля;
- 7 — гигантские ледяные поля;
- 8 — припай;
- 9 — айсберги;
- X — форма неизвестна.
Пример применения овального символа морского льда, приведенного на рис. 1, означает, что в данном районе находится лед общей сплоченностью 6 баллов. Из них 2 балла — обломки полей старого льда, 1 балл — крупнобитый молодой лед, 3 балла — нилас, форма которого не определена.
Наряду с главным символом — овалом, на ледовой карте применяются и другие символы, дополняющие и конкретизирующие общую картину распределения льда:
| Дополнительные ледовые символы | |
|---|---|
| торосистость льда, в баллах; | |
| разрушенность льда, в баллах; | |
| заснеженность льда (С — площадь покрытого снегом льда в десятых долях от общей площади; S — заснеженность в баллах ← направление застругов); | |
| сжатие льда в баллах; | |
| рекомендованные маршруты движения. |
На ледовой карте каждая зона льда с примерно одинаковыми характеристиками выделяется по ее границе изолиниями (рис. 2). Для наглядности различные зоны могут быть заштрихованы.
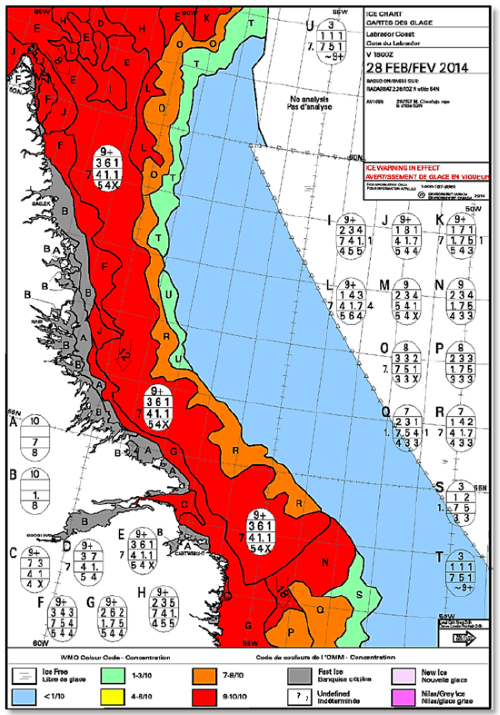 Рис. 2 Ледовая карта
Рис. 2 Ледовая карта
| Условные обозначения | |||
|---|---|---|---|
| Раскраска обзорных карт по возрасту (стадиям развития) льда: применяется в период образования, становления и частичного разрушения льда «зимняя раскраска по возрасту» | |||
| Возрастные характеристики льда: | |||
| условная раскраска по цвету: | применение графических символов: | ||
| * ** | начальные виды льда | ||
| ⊛ | нилас, склянка (толщина до 10 см) | ||
| серый лед (10-15 см) | |||
| серо-белый лед (15-30 см) | |||
| тонкий однолетний (белый) лед (30-70 см) | |||
| однолетний лед средней толщины (70-120 см) | |||
| толстый однолетний лед (более 120 см) | |||
| остаточный однолетний лед | |||
| двухлетний лед (до 2,5 м и более) | |||
| многолетний лед (около 3 м и более) | |||
| Формы плавучего льда: | Условные обозначения, возраст: | ||
| мелкобитый лед | нилас | ||
| крупнобитый лед | серый | ||
| обломки ледяных полей | серо-белый | ||
| большие поля | тонкий | ||
| обширные ледяные поля | средний | ||
| гигантские ледяные поля | толстый | ||
| ледяная каша | старый | ||
| блинчатый лед | припай | ||
| Возрастные характеристики неподвижного льда (припая) в см: | Обобщенные характеристики льда: | ||
| ниласовые льды (5-10 см) | возрастной состав дрейфующих льдов | ||
| молодые льды (10-30 см) | торосистость льда (в баллах) | ||
| тонкий однолетний лед (30-70 см) | показатель сжатия (в баллах) | ||
| однолетний лед средней толщины (70-120 см) | наслоеность льда | ||
| толстый однолетний лед (>120 см) | разрушеность льда |
| Раскраска обзорных карт по сплоченности:применяется в период разрушения и таяния льда«летняя раскраска по сплоченности» | |||
|---|---|---|---|
| Сплоченность льда: | Формы плавучего льда: | ||
| сплошной, смерзшийся спл. и очень спл. дрейф. лед (9-10/10) | мелкобитый лед | ||
| сплоченный лед (7-8/10) | крупнобитый лед | ||
| разряженный лед (4-6/10) | обломки ледяных полей | ||
| редкий лед (1-3/10) | большие поля | ||
| отдельные льдины (<1/10) | обширные ледяные поля | ||
| чистая вода | гигантские ледяные поля | ||
| айсберговые воды | ледяная каша | ||
| блинчатый лед | |||
| Условные обозначения | |||
| чисто | |||
| 1-3 | |||
| 4-6 | |||
| 7-8 | |||
| 9-10 | |||
| 10 | |||
| припай |
СВОЙСТВА

Текстура льда
Лёд бесцветен. В больших скоплениях он приобретает синеватый оттенок. Блеск стеклянный. Прозрачный. Спайности не имеет. Твердость 1,5. Хрупкий. Оптически положительный, показатель преломления очень низкий (n = 1,310, nm = 1,309). В природе известны 14 модификаций льда. Правда, все, кроме привычного нам льда, кристаллизующего в гексагональной сингонии и обозначающегося как лёд I , образуются в условиях экзотических — при очень низких температурах (порядка -110150 0С) и высоких давлениях, когда углы водородных связей в молекуле воды изменяются и образуются системы, отличные от гексагональной. Такие условия напоминают космические и не встречаются на Земле. Например, при температуре ниже –110 °С водяные пары выпадают на металлической пластине в виде октаэдров и кубиков размером в несколько нанометров — это так называемый кубический лед. Если температура чуть выше –110 °С, а концентрация пара очень мала, на пластине формируется слой исключительно плотного аморфного льда.
Свойства льда — свойства воды в твердом состоянии
Свойства воды в твёрдом состоянии как таковые мы уже рассматривали и в других наших материалах — ЛЕДНИК — ХРАНИТЕЛЬ ПРЕСНОЙ ВОДЫ → , БЕЛЫЕ СНЕЖИНКИ НА НОВЫЙ ГОД → , СНЕГ КРУЖИТСЯ → .
- Лёд образуется … или иначе говоря вода переходит в твердое состояние при температуре равной 0 °C (при условии атмосферного давления равного 760 мм рт.ст. / 1 атм).
- Замерзая вода увеличивается в объеме. Плотность льда меньше плотности жидкой воды, удельный вес льда при 0° = 0,917 и соответственно удельный вес воды при 0° = 0,9999. Именно поэтому лед и не тонет. Это свойство воды является аномальным.
- При дальнейшем понижении температуры, лёд сжимается, чем и объясняются трещины на больших лёдовых пространствах.
- Теплоемкость льда ниже, чем у воды практически в 2 раза.
- Температура замерзания морской воды выше чем пресной и равняется ~ 1,80С (при условии солености воды на уровне средне-взвешенного уровня по мировому океану) .
- Лёд – бесцветное вещество, при больших объемах с несколько синеватым оттенком.
- Лёд весьма скользкое и хрупкое вещество.
- В природе в естественных условиях плотность льда составляет 0,92 г/см3.
- Теплоёмкость естественного для природных условий льда — 2,09 кДж/(кг.К) при °C.
- Теплота плавления льда, встречающегося в природе — 324 кДж/кг. Если давление падает температура плавления льда растет.
- При давлении равном 0,006 атм, температуры таяния и кипения совпадают, происходит это при 0,01 °C.
- Лед обладает текучестью и пластичностью, которые возникают под действием собственного веса.
- При переходе воды в твердое состояние из нее частично выделяются соли и газы.
- Лед имеет структуру, напоминающую структуру алмаза – вокруг одной молекулы воды располагаются четыре ближайших в вершинах правильного тетраэдра.
- Теплоемкость воды в твердом состоянии в два раз меньше чем в жидком и равняется 0,504.
- Электропроводность воды в твердом состоянии невысока, так же как и в жидком.
- На температуру замерзания воды влияет количество растворенных в ней солей. Температура замерзания чистой воды всегда выше, чем температура замерзания «рассолов». Морская вода замерзает при температуре в районе -1,8 °С, а таяние льдов мирового океана начинается при температурах превышающих 2,3 °С.
История появления вещества кристалл (лёд)
Метамфетамин впервые синтезировали в начале XX века как препарат против депрессивных состояний. В Первой мировой войне препарат выдавался солдатам для воодушевления и снятия страха перед боевыми действиями. Особенно преуспела в этом Япония, которая раздавала метамфетамин своим летчикам-камикадзе перед последним полетом.
В тридцатые годы германские власти применяли препарат в армии и оборонной промышленности. Метамфетамин исследовали как вещество против усталости в концентрационных лагерях. Истощенных узников заставляли совершать изнурительные марш-броски, за сутки люди проходили около сотни километров. После окончания войны немецкие ученые были вывезены в США, где создавали аналогичные препараты уже для американских военных, которые применяли наркотик в войне против Кореи и Вьетнама.














