§ 9. твёрдое состояние вещества. жидкие кристаллы
Содержание:
Фазовый переход
Основная статья: Фазовый переход
Фазовый переход по фазовой диаграмме при изменении её интенсивных параметров (температуры, давления и тому подобное) происходит, когда система пересекает линию, разделяющую две фазы. Поскольку разные термодинамические фазы описываются различными уравнениями состояния, всегда можно найти величину, которая скачкообразно меняется при фазовом переходе.
При фазовом переходе первого рода скачкообразно изменяются самые главные, первичные экстенсивные параметры: удельный объём, количество запасённой внутренней энергии, концентрация компонентов и т. п. Фазовые переходы второго рода происходят в тех случаях, когда меняется симметрия строения вещества (симметрия может полностью исчезнуть или понизиться).
Фазовый переход
Фазовый переход по фазовой диаграмме при изменении её интенсивных параметров (температуры, давления и тому подобное) происходит, когда система пересекает линию, разделяющую две фазы. Поскольку разные термодинамические фазы описываются различными уравнениями состояния, всегда можно найти величину, которая скачкообразно меняется при фазовом переходе.
При фазовом переходе первого рода скачкообразно изменяются самые главные, первичные экстенсивные параметры: удельный объём, количество запасённой внутренней энергии, концентрация компонентов и т. п. Фазовые переходы второго рода происходят в тех случаях, когда меняется симметрия строения вещества (симметрия может полностью исчезнуть или понизиться).
Свойства[править]
Термин плазма используется для систем заряженных частиц, достаточно больших для возникновения коллективных эффектов. Микроскопические малые количества заряженных частиц (напр. пучки ионов в ионных ловушках) не являются плазмой. Плазма обладает следующими свойствами:
- длина дебаевского экранирования
\({r_D \over L} \ll 1; \,\)
мала по сравнению с характерным размером плазмы:
- внутри сферы с радиусом Дебая
\(r_D^3 N \gg 1 \,\), где \(N \,\) — концентрация заряженных частиц;
находится большое число заряженных частиц:
- среднее время между столкновениями частиц велико по сравнению с периодом плазменных колебаний
\(\tau \omega_{pl} \gg 1. \,\)
:
Классификацияправить
Плазма обычно разделяется на низкотемпературную и высокотемпературную, равновесную и неравновесную, при этом довольно часто холодная плазма бывает неравновесной, а горячая равновесной.
Температураправить
В неравновесных плазмах электронная температура существенно превышает температуру ионов. Это происходит из-за различия в массах иона и электрона, которое затрудняет процесс обмена энергией. Такая ситуация встречается в газовых разрядах, когда ионы имеют температуру около сотен, а электроны около десятков тысяч градусов.
В равновесных плазмах обе температуры равны. Поскольку для осуществления процесса ионизации необходимы температуры, сравнимые с потенциалом ионизации, равновесные плазмы обычно являются горячими (с температурой больше нескольких тысяч градусов).
Понятие высокотемпературная плазма употребляется обычно для плазмы термоядерного синтеза, который требует температур в миллионы градусов.
Степень ионизацииправить
Степень ионизации определяется как отношение числа ионизованных частиц к общему числу частиц. Для низкотемпературных плазм характерны малые степени ионизации (плазменных технологиях их иногда называют технологичными плазмами. Чаще всего их создают при помощи электрических полей, которые ускоряют электроны, которые в свою очередь ионизуют атомы. Электрические поля вводятся в газ посредством индуктивной или емкостной связи. Типичные применения низкотемпературных плазм включают плазменную модификацию свойств поверхности (алмазные пленки, нитридирование металлов, изменение смачиваемости), плазменное травление поверхностей (полупроводниковая промышленность), очистка газов и жидкостей (озонирование воды и сжигание частичек сажи в дизельных двигателях).
Горячие плазмы почти всегда полностью ионизованы (степень ионизации ~100 %). Обычно именно они понимаются под «четвертым агрегатным состоянием вещества». Примером может служить Солнце.
Плотностьправить
Помимо температуры, которая имеет фундаментальную важность для самого существования плазмы, вторым наиболее важным свойством плазмы является плотность. Слово плотность плазмы обычно обозначает плотность электронов, то есть число свободных электронов в единице объема (строго говоря, здесь, плотностью называют концентрацию — не массу единицы объема, а число частиц в единице объема)
Плотность ионов связана с ней посредством среднего зарядового числа ионов \(\langle Z\rangle\): \(n_e=\langle Z\rangle n_i\). Следующей важной величиной является плотность нейтральных атомов \(n_0\). В горячей плазме \(n_0\) мала, но может тем не менее быть важной для физики процессов в плазме.
Квазинейтральностьправить
Так как плазма является очень хорошим проводником, электрические свойства имеют важное значение. Потенциалом плазмы или потенциалом пространства называют среднее значение электрического потенциала в данной точке пространства
В случае если в плазму внесено какое-либо тело, его потенциал в общем случае будет меньше потенциала плазмы вследствие возникновения дебаевского слоя. Такой потенциал называют плавающим потенциалом. По причине хорошей электрической проводимости плазма стремится экранировать все электрические поля. Это приводит к явлению квазинейтральности — плотность отрицательных зарядов с хорошей точностью равна плотности положительных зарядов (\(n_e=\langle Z\rangle n_i\)). В силу хорошей электрической проводимости плазмы разделение положительных и отрицательных зарядов невозможно на расстояниях больших дебаевской длины и временах больших периода плазменных колебаний.
Примером неквазинейтральной плазмы является пучок электронов. Однако плотность не-нейтральных плазм должна быть очень мала, иначе они быстро распадутся за счет кулоновского отталкивания.
Низкотемпературные состояния
Сверхтекучесть
Способность вещества в особом состоянии (квантовой жидкости), возникающем при понижении температуры к абсолютному нулю (термодинамическая фаза), протекать через узкие щели и капилляры без трения. До недавнего времени сверхтекучесть была известна только у жидкого гелия, однако в последние годы сверхтекучесть была обнаружена и в других системах: в разреженных атомных бозе-конденсатах, твёрдом гелии.
Сверхтекучесть объясняется следующим образом. Поскольку атомы гелия являются бозонами, квантовая механика допускает нахождение в одном состоянии произвольного числа частиц. Вблизи абсолютного нуля температур все атомы гелия оказываются в основном энергетическом состоянии. Поскольку энергия состояний дискретна, атом может получить не любую энергию, а только такую, которая равна энергетическому зазору между соседними уровнями энергии. Но при низкой температуре энергия столкновений может оказаться меньше этой величины, в результате чего рассеяния энергии попросту не будет происходить. Жидкость будет течь без трения.
Конденсат Бозе — Эйнштейна
Получается в результате охлаждения бозе-газа до температур, близких к абсолютному нулю. В таком сильно охлаждённом состоянии достаточно большое число атомов оказывается в своих минимально возможных квантовых состояниях и квантовые эффекты начинают проявляться на макроскопическом уровне. Конденсат Бозе — Эйнштейна проявляет ряд квантовых свойств, таких как сверхтекучесть и .
Фермионный конденсат
Представляет собой Бозе-конденсацию в режиме БКШ «атомных куперовских пар» в газах состоящих из атомов-фермионов.
(В отличие от традиционного режима бозе-эйнштейновской конденсации составных бозонов).
Такие фермионные атомные конденсаты являются «родственниками» сверхпроводников, но с критической температурой порядка комнатной и выше.
Вырожденный газ
Газ, на свойства которого существенно влияют квантовомеханические эффекты, возникающие вследствие тождественности его частиц. Вырождение наступает в условиях, когда расстояния между частицами газа становятся соизмеримыми с длиной волны де Бройля; в зависимости от спина частиц выделяются два типа вырожденных газов — ферми-газ, образованный фермионами (частицами с полуцелым спином) и бозе-газ, образованный бозонами (частицами с целым спином).
Сверхтекучее твёрдое тело
Термодинамическая фаза квантовой жидкости, представляющей собой твёрдое тело со свойствами сверхтекучей жидкости.
Описание
Схематическое изображение атомной структуры неупорядоченного аморфного (слева) и упорядоченного кристаллического (справа) твёрдого тела.
Твёрдые тела могут быть в кристаллическом и аморфном состоянии. Кристаллы характеризуются пространственной периодичностью в расположении равновесных положений атомов, которая достигается наличием дальнего порядка и носит название кристаллической решётки. Естественная форма кристаллов — правильные многогранники. В аморфных телах атомы колеблются вокруг хаотически расположенных точек, у них отсутствует дальний порядок, но сохраняется ближний, при котором молекулы расположены согласованно на расстоянии, сравнимом с их размерами. Частным случаем аморфного состояния является стеклообразное состояние. Согласно классическим представлениям, устойчивым состоянием (с минимумом потенциальной энергии) твёрдого тела является кристаллическое. Аморфное тело находится в метастабильном состоянии и с течением времени должно перейти в кристаллическое состояние, однако время кристаллизации часто столь велико, что метастабильность вовсе не проявляется. Аморфное тело можно рассматривать как жидкость с очень большой (часто бесконечно большой) вязкостью.
- Атомы и молекулы, составляющие твёрдое тело, плотно упакованы вместе. Другими словами, молекулы твёрдого тела практически сохраняют своё взаимное положение относительно других молекул и удерживаются между собой межмолекулярным взаимодействием.
- Многие твёрдые тела содержат в себе кристаллические структуры. В минералогии и кристаллографии под кристаллической структурой подразумевается определённый порядок атомов в кристалле. Кристаллическая структура состоит из элементарных ячеек, набора атомов расположенных в особенном порядке, который периодически повторяется во всех направлениях пространственной решётки. Расстояния между элементами этой решётки в различных направлениях называют параметром этой решётки. Кристаллическая структура и симметричность играют роль в определении множества свойств, таких как спайность кристалла, электронная зонная структура и оптические
При применении достаточной силы любое из этих свойств может быть нарушено, вызывая остаточную деформацию.
свойства.
- Твёрдые тела обладают тепловой энергией, следовательно их атомы совершают колебательное движение. Тем не менее это движение незначительно и не может наблюдаться или быть почувствованным при нормальных условиях.
Свойства твёрдого тела и движение частиц в нём исследуются в разделе физики, который называется физикой твёрдого тела (подраздел физики конденсированных сред). Физика твёрдого тела является самостоятельной научной дисциплиной со специфическими методами исследования и математическим аппаратом. Её развитие диктуется практическими потребностями. В зависимости от объекта исследования физика твёрдого тела делится на физику металлов, полупроводников, магнетиков и других. По методам исследования различают рентгеновский структурный анализ, радиоспектроскопию и тому подобное. Кроме того, присутствует деление, связанное с изучением определённых свойств (механических, тепловых и так далее).
Материаловедение главным образом рассматривает вопросы, связанные со свойствами твёрдых тел, такими как твёрдость, предел прочности, сопротивление материала нагрузкам, а также фазовые превращения. Это значительным образом совпадает с вопросами, изучаемыми физикой твёрдого тела. Химия твёрдого состояния перекрывает вопросы, рассматриваемые обоими этими разделами знаний, но особенно затрагивает вопросы синтезирования новых материалов.
Вырожденная материя
- Ферми-газ — 1-я стадия: электронно-вырожденный газ, наблюдается в белых карликах, играет важную роль в эволюции звёзд.
- 2-я стадия — нейтронное состояние: в него вещество переходит при сверхвысоком давлении, недостижимом пока в лаборатории, но существующем внутри нейтронных звёзд. При переходе в нейтронное состояние электроны вещества взаимодействуют с протонами и превращаются в нейтроны. В результате вещество в нейтронном состоянии полностью состоит из нейтронов и обладает плотностью порядка ядерной. Температура вещества при этом должна быть ниже триллиона градусов (в энергетическом эквиваленте не более сотни МэВ).
- При повышении температуры выше сотни МэВ в нейтронном состоянии начинают рождаться и аннигилировать разнообразные мезоны. При дальнейшем повышении температуры происходит деконфайнмент, и вещество переходит в состояние кварк-глюонной плазмы. Оно состоит уже не из адронов, а из постоянно рождающихся и исчезающих кварков и глюонов. Возможно, деконфайнмент происходит в два этапа.
- При дальнейшем неограниченном повышении давления без повышения температуры вещество коллапсирует в чёрную дыру.
- При одновременном повышении и давления, и температуры к кваркам и глюонам добавляются иные частицы. Что происходит с веществом, пространством и временем при температурах, близких к планковской, пока неизвестно.
Газообразное агрегатное состояние
Газообразное вещество как и жидкость заполняет сосуд, только в отличии от жидкости — весь его объем. Прощу говоря, наполовину налитая жидкость в сосуд не может заполнить весь ее объем, а газ может. Это достигается благодаря очень высокой кинетической энергии молекул газа, которая в разы превосходит энергию их взаимного притяжения, а также гравитационную силу. Поэтому газ не скатывается как жидкость на дно сосуда. Газ, как и жидкость не имеет кристаллической решетки в отличии от твердого тела.
Молекулы газа расположены на значиельном расстояниии друг от друга. Они движутся с большой скоростью. Скорость около 300 км/ч, сталвикаясь при этом между собой и ударяяс о стенки сосуда, в котором находятся.
Взаимное расположения между молекулами газа свободно изменяется, что позволяет различным телам проходить сквозь его молекулы.
Точка кипения
Пожалуй, самое распространенное явление перехода жидкого состояния в газообразное в быту — это кипение воды. Заваривая чай каждый из нас мог наблюдать рождение процесса кипения воды. Маленькие пузырьки пара в толще подогревающейся воды постепенно растут и достигая критических размеров начинают подниматься на поверхность, где лопаясь превращаются в газообразное состояние — пар.
Как и в случае с плавлением существует граничная температура, называемая точкой кипения, при которой кинетическая энергия становится достаточной для того, чтобы преодолеть силы взаимного притяжения частиц, не дающие оторваться друг от друга и покинуть занимаемый объем. Любой элемент таблицы Менделеева или вещество из нескольких элементов имеет свою точку кипения. Чистая дистиллированная вода (H2O) имеет температуру кипения 100 С, этиловый спирт — (-79 С), а высококонцентрированная серная кислота кипит при температуре 338 С.
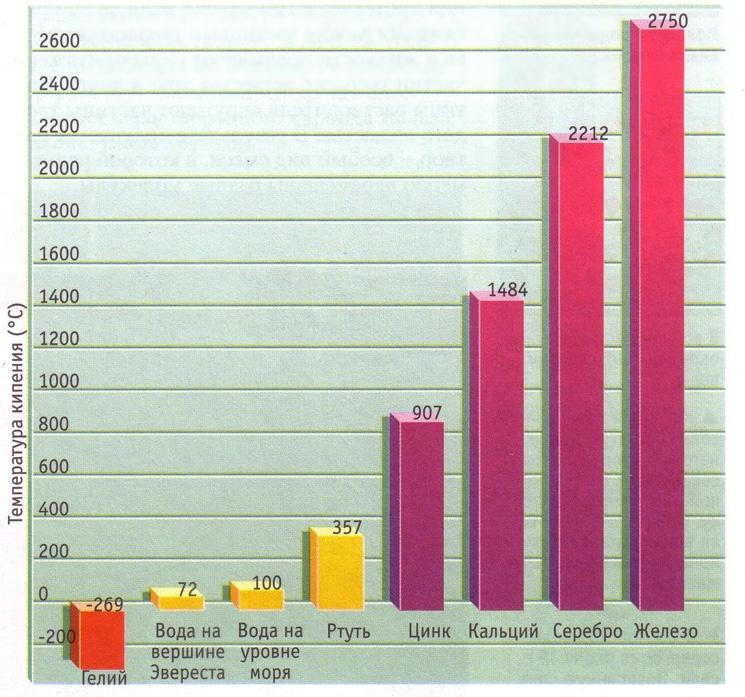
Температура кипения также зависит от давления и сил притяжения между частицами.
На вершине Эвереста температура кипения воды на 28 С ниже, чем внизу, над уровнем моря.
Однако, существуют исключения, при котором вещества могут миновать при переходе из одного агрегатного состояния в другую целую фазу превращения — переходя из твердого сразу в газообразную. Этот эффект называют сублимацией или возгонкой.
https://youtube.com/watch?v=9GU1dLJIfIM
Видео подборки опытов с сухим льдом
В качестве примера можно привести превращение сухого льда (диоксид углерода в твердом виде сразу в газообразное при температуре -78,5 С.
Газообразные вещества
Вещества, находящиеся в газообразном состоянии, не в состоянии сохранить ни форму, ни объем. Все доступное пространство имеющееся количество газа заполняет собой.
Если вещество переходит из жидкого состояние в газообразное, этот процесс называют испарением. Обратный процесс, при котором газ переходит в жидкость, называется конденсацией. Также возможна ситуации, когда твердое тело, минуя жидкую фазу, сразу переходит в газообразное состояние. Такой процесс называется сублимацией или возгонкой.
В газе молекулы вещества взаимодействуют друг с другом слабо и движутся хаотично, периодически сталкиваясь друг с другом.
Разные газы имеют разные химические свойства. Существуют как малоактивные инертные газы, так и взрывчатые газовые смеси.
Рис. 3. Таблица агрегатные состояния вещества.
Что мы узнали?
Жидкость, твердое тело, газ – три агрегатных состояния вещества. Отличаются они по расположению, взаимодействию и характеру движения молекул. Твердые тела сохраняют форму и объем, жидкие – только объем, но не форму, а газы не сохраняют ни форму, ни объем.
Получение
Существуют вещества, которые при нормальных условиях сохраняются в газообразном агрегатном состоянии. Их можно разделить на две группы:
- простые – азот, кислород, хлор;
- сложные – аммиак, метан, углекислый газ.
Газы выделяют из атмосферы или природного газа путём окисления и адсорбции примесей.
Образованию газообразного состояния веществ способствует изменение нормальных условий. Жидкие или твёрдые вещества нагревают, тем самым разрушая химические связи и высвобождая отдельные молекулы в воздух. Например, жидкая вода при нагревании легко превращается в водяной пар, а твёрдый йод выделяет фиолетовые пары.
Рис. 1. Фиолетовые пары йода.
В лабораториях газ получают путём разложения (сжигания) сложных веществ или реакцией жидких и твёрдых соединений. Способы получения некоторых газов:
- водорода:
Zn + 2HCl = ZnCl2 + H2↑; - кислорода:
2KMnO4 = K2MnO4 + MnO2 + О2↑; - углекислого газа:
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑; - аммиака:
NH4Cl + NaOH = NaCl + H2O + NH3↑.
Рис. 2. Получение кислорода.
Полученный газ обнаруживают разными способами. Например, пропускают через жидкость и наблюдают за изменением цвета, прозрачности (известковое молочко мутнеет в присутствии углекислого газа). Некоторые газы поддерживают горение или, наоборот, тушат тлеющую лучину.
Строение
Молекулы жидкости не имеют строго упорядоченной структуры как в твёрдом веществе и могут перескакивать с одного места на другое, что объясняет текучесть жидкости. Расстояние между молекулами жидкого вещества близкое, но не такое большое, как между молекулами газов. Частицы жидкости не отрываются и не перемещаются свободно и хаотично.
Рис. 1. Молекулярное строение жидкости.
Притяжение между молекулами достаточно сильное, чтобы сохранять межмолекулярное расстояние, но достаточно слабое, чтобы держать молекулы в статичном положении.
Жидкость держит объём, но не держит форму, совершая колебательные движения.
Физические свойства
Молекулы газообразного вещества постоянно движутся, а расстояние между ними значительно превышает их диаметр. Благодаря такому расположению частиц газы не имеют формы, легко смешиваются и сжимаются.
Газообразные соединения приобретают форму сосуда, в котором находятся. Ударяясь о стенки сосуда с определённой скоростью, газы создают давление. Чем интенсивнее молекулы воздействуют на сосуд, тем выше давление.
Различные газообразные соединения смешиваются между собой в любых пропорциях. Природный газ – это смесь метана, водорода, сероводорода, углекислого газа, азота, гелия. Атмосфера состоит из смесей простых и сложных газообразных веществ – азота, кислорода, водорода, углекислого газа, водяного пара.
Рис. 3. Соотношение газов в атмосфере.
При сжатии объём газов становится значительно меньше. Например, объём кислорода уменьшается в 200 раз.
Описание некоторых газообразных веществ представлено в таблице.
|
Газ |
Формула |
Физические свойства |
Нахождение в природе |
|
Водород |
Н2 |
Самый лёгкий газ, легче воздуха в 14,5 раз. Не имеет вкуса, запаха, цвета. Плохо растворяется в воде (18,8 мл/100 г), но хорошо растворяется в металлах, особенно в палладии. Сжижается при -252,76°C |
В земной коре – 1 %, незначительное количество в атмосфере. Большая часть водорода присутствует в виде соединений |
|
Кислород |
О2 |
Не имеет вкуса, цвета, запаха. Немного тяжелее воздуха. Плохо растворяется в воде (4,9 мл/100 г) и спирте (2,78 мл/100 г), но хорошо растворяется в жидком серебре. Сжижается при -182,98°C |
47 % земной коры состоит из кислорода. Моря и пресные водоёмы содержат 85 % кислорода. В атмосфере – 20 % |
|
Азот |
N2 |
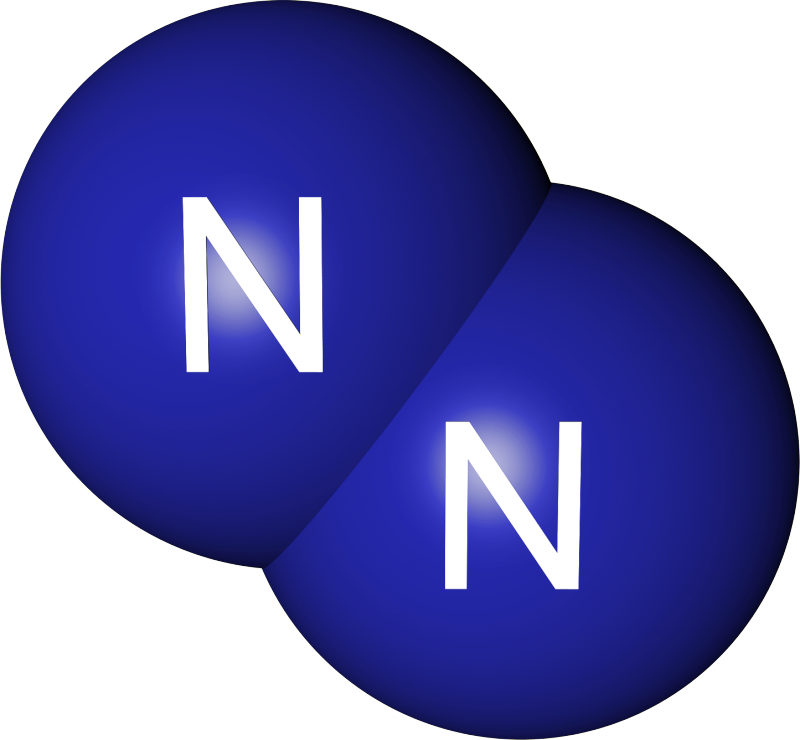
Бесцветный газ без запаха. Плохо растворим в воде (2,3 мл/100 г). Атомы азота связаны тройной трудно разрываемой связью. Сжижается при -195,8°C |
В атмосфере – 78 %. Один из наиболее распространённых элементов, найденных за пределами Земли. Входит в состав белков |
|
Хлор |
Cl2 |
Жёлто-зелёный газ с запахом. Легко сжижается уже при -34°C. При давлении в 0,8 МПа и комнатной температуре становится жидким. Плохо растворяется в воде (1,48 мл/100 г), хорошо растворяется в бензоле и хлороформе |
Наиболее распространённый галоген. В природе встречается только в составе минералов |
|
Углекислый газ |
CO2 |
Бесцветный газ, не имеющий запаха при малых концентрациях. В большом количестве имеет кислый запах. В 1,5 раза тяжелее воздуха. Кристаллизуется при -78,3°С. Жидкое состояние получают при комнатной температуре и давлении в 6 МПа |
В атмосфере содержится меньше 1 % |
|
Аммиак |
NH3 |
Бесцветный газ с резким запахом. В два раза тяжелее воздуха. Хорошо растворяется в воде |
Образуется путём разложения азотсодержащих веществ |
За счёт свободного движения молекул газ равномерно распространяется в ограниченном пространстве. Такое явление называется диффузией. Яркий пример диффузии – распространение запахов. При приготовлении пищи на кухне запах постепенно распространяется по всей квартире.
Что мы узнали?
Газ – вещество, состоящее из хаотично движущихся частиц – молекул или атомов. Газообразные соединения можно получить выделением из атмосферы путём адсорбции и окисления. Также газ получают из жидких и твёрдых веществ путём изменения условий или взаимодействием простых и сложных веществ. Газы не имеют формы, легко смешиваются между собой и равномерно распределяются в закрытом пространстве. Наиболее распространённый газ в атмосфере – азот. Самый лёгкий газ.
Вырожденная материя
- Ферми-газ 1-я стадия Электронно-вырожденный газ, наблюдается в белых карликах, играет важную роль в эволюции звёзд.
- 2-я стадия нейтронное состояние в него вещество переходит при сверхвысоком давлении, недостижимом пока в лаборатории, но существующем внутри нейтронных звёзд. При переходе в нейтронное состояние электроны вещества взаимодействуют с протонами и превращаются в нейтроны. В результате вещество в нейтронном состоянии полностью состоит из нейтронов и обладает плотностью порядка ядерной. Температура вещества при этом не должна быть слишком высока (в энергетическом эквиваленте не более сотни МэВ).
- при сильном повышении температуры (сотни МэВ и выше) в нейтронном состоянии начинают рождаться и аннигилировать разнообразные мезоны. При дальнейшем повышении температуры происходит деконфайнмент, и вещество переходит в состояние кварк-глюонной плазмы. Оно состоит уже не из адронов, а из постоянно рождающихся и исчезающих кварков и глюонов. Возможно, деконфайнмент происходит в два этапа.
- При дальнейшем неограниченном повышении давления без повышения температуры вещество коллапсирует в чёрную дыру.
- При одновременном повышении и давления, и температуры к кваркам и глюонам добавляются иные частицы. Что происходит с веществом, пространством и временем при температурах, близких к планковской, пока неизвестно.
Вывод
Итак, мы узнали, какие вещества относятся к жидким, выяснили, что жидкость является промежуточным состоянием вещества между газообразным и твердым. Поэтому у нее есть свойства, характерные для того и другого. Жидкие кристаллы, которые сегодня широко используются в технике и промышленности (например, жидкокристаллические дисплеи) являются ярким примером этого состояния вещества. В них объединены свойства твердых тел и жидкостей. Сложно представить, какие вещества жидкие изобретет в будущем наука. Однако ясно, что в этом состоянии вещества есть большой потенциал, который можно использовать во благо человечества.
Особый интерес к рассмотрению физико-химических процессов, протекающих в жидком состоянии, обусловлен тем, что сам человек состоит на 90% из воды, которая является самой распространенной на Земле жидкостью. Именно в ней происходят все жизненно важные процессы как в растительном, так и в животном мире. Поэтому для всех нас актуально изучать жидкое состояние вещества.