Особенности подготовки и технология использования аппарата искусственного кровообращения
Содержание:
- Принцип работы аппарата искусственного кровообращения. Как работает аппарат искусственного кровообращения?
- Венозные канюли
- Артериальная канюля
- Риски установки аппарата
- Искусственное кровообращение
- Аппараты для спасательных бригад
- Как защищают миокард?
- Подготовка АИК
- Конструкция АИК
- Транспортная упаковка
- Проведение искусственного кровообращения
- Теплообменник
- В каких случаях используется аппарат ЭКМО?
- Как устроены современные аппараты?
- Какими были первые аппараты для дыхания?
- Технология подключения к АИК
- Кровеносные магистрали и коннекторы
Принцип работы аппарата искусственного кровообращения. Как работает аппарат искусственного кровообращения?
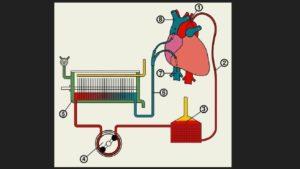
В основном аппарат искусственного кровообращения (АИК) применяется в кардиохирургии, при операциях на открытом сердце. Во время оперативного вмешательства сердце не может выполнять свою функцию насоса и ее заменяют механическим перекачиванием оксигенированной крови. Есть и другое применение аппарата искусственного кровообращения – это регионарная перфузия.
Существует несколько видов экстракорпорального кровоснабжения:
- общее, когда АИК выполняет функцию сердца и легкого во всем организме;
- регионарное, когда его применяют для перфузии одного органа или его части;
- вспомогательное, с различными вариантами.
Общее применяется в кардиохирургии.
Регионарное используют у онкологических, хирургических больных, когда нужно создать определенную концентрацию лекарственных препаратов в одном регионе, например, в злокачественной опухоли.
Нередко их используют в трансплантологии. Существуют также аппараты искусственного кровообращения для коронарной перфузии, которые обеспечивают кровоснабжение в миокарде при операциях на аорте.
Также рекомендуем почитать: Регуляция и значение кислотно-щелочного состояния организма
Транспортная упаковка
Комплект оборудования АВК-Н представлен на фотографии.
Для транспортировки АВК-Н используется кейс из сополимерного полипропилена. Корпус герметичный, характеризуется высокой стойкостью к ударным нагрузкам. В конструкцию встроен атмосферный клапан для выравнивания давления,5 замков ABS. Размер кейса 79.
50×51.80×31.00 см, вес около 25 кг.Для удобства перемещения системы в кейс встроены колеса и выдвижная ручка. Кейс состоит из трех уровней. Ложементы каждого уровня спроектированы с учётом удобства размещения всех компонент системы по назначению.
На первом уровне размещаются имплантируемые компоненты АВК-Н, на втором и третьем – экстракорпоральные.
В крышку кейса встроен органайзер с тремя карманами для размещения сумки пациента и комплекта эксплуатационной документации.
Что такое синдром пересаженного сердца
Несмотря на то, что после пересадки механического аналога сердца или замены его клапанов появляется шанс на жизнь, многие пациенты не ощущают облегчения. Это связано с такими причинами:
- возникает страх поломки устройства,
- шум от работы по ночам не дает возможности уснуть,
- больной постоянно фиксирован на ритме сердцебиений,
- нарастает депрессия и суицидальные наклонности.
Появляются жалобы на головную боль, онемение конечностей, обмороки и головокружения, сильную утомляемость. Это заставляет больных резко ограничивать физическую активность.
Одним из опасений является отсутствие боли при нарушении работы прибора, поэтому пациенты боятся утратить контроль за своим здоровьем. Подобная симптоматика лечится совместными усилиями кардиолога и психиатра.
Удачные примеры установки искусственного органа в разных странах
Долгое время самым известным механическим сердцем была модель Джарвик 7, рекордная продолжительность жизни больного составила 620 дней. Именно столько прожил со времени установки (в 1985 году) У. Шредер, доказав, что можно заменить биологический орган на рукотворный.
Модель искусственного сердца Джарвик 7
Следующей версией такого прибора был Симбион, а в настоящее время Синкардия является практически единственной успешной моделью искусственных сердец. Основная проблема подобных устройств – это вес зарядного устройства, которое нужно было возить с собой или носить в рюкзаке за спиной.
Пациенты с таким аппаратом не избавлены от необходимости пересадки донорского органа, но они могут ожидать трансплантацию не только в больнице, как было раньше, а зарядить аккумулятор от обычной розетки, находясь дома. Синкардии установлены 1600 больным, максимальный срок работы превысил 3,5 года. Поэтому у пациентов появился шанс дожить до того момента, когда будет найден подходящий донор.
Венозные канюли
Техника венозной канюляции описана здесь. Существует три основных типа венозных канюль: для канюляции полых вен (отдельная канюля для каждой полой вены), канюляции правого предсердия (двухуровневая канюля) и канюляции правого предсердия (канюля типа «Ross basket»). Канюля типа «Ross basket» представляет собой канюлю большого диаметра с металлическим наконечником, имеющим много боковых отверстий достаточно большого диаметра, предназначена для канюляции правого предсердия, фиксируется турникетом у края металлического наконечника. Двухуровневая канюля имеет коническую форму, как правило, корпус канюли усилен металлическим каркасом из проволоки для предотвращения перегиба корпуса канюли. Она устанавливается в правом предсердии, так чтобы ее носик находился в нижней полой вене, а проксимальное отверстие располагалось в полости правого предсердия (турникет фиксируется на уровне самого внешнего маркера канюли). Канюли для отдельной канюляции полых вен устанавливаются или прямо в полые вены (такие канюли, как правило, выбираются изогнутые под 90°, могут так же иметь изогнутый под 90° металлический носик), или через отдельные кисетные швы на правом предсердии (канюли могут быть как прямые, так и изгибаемые) проводятся в полые вены. Кроме того, канюли данного типа для избежания перегиба также могут иметь усиленный металлической проволокой корпус. Как правило, канюли установленные в верхнюю и нижнюю полые вены и обжимаются широкими турникетами (тесьмой) во время проведения искусственного кровообращения для полного дренажа крови пациента в контур ИК. Такое состояние может называться «полное искусственное кровообращение». Канюляция двухуровневой канюлей выполняется быстрее, может обеспечивать наилучшее дренирование крови из правых отделов сердца в определенных его положениях. При использовании бикавальной канюляции считается, что обеспечивается лучшее охлаждение миокарда, а значит, лучшая защита миокарда от ишемии, предотвращается попадание воздуха в венозную магистраль контура искусственного кровообращения. Этот метод широко используется при планируемом вскрытии «правых» отделов сердца или при вскрытии «левых» отделов и при наличии сообщения между «левыми» и «правыми» отделами (дефект междпредсердной перегородки, открытое овальное окно, дефект межжелудочковой перегородки). При использовании техники «полного ИК» предотвращается согревание миокарда, так как возврат венозной крови идет прямо в контур искусственного кровообращения. Использование канюляции типа «Ross basket» снижает риск повреждения нижней полой вены.
Артериальная канюля
Техника артериальной канюляции обсуждены здесь. Существуют различные варианты формы канюли, но всегда самым узким местом контура искусственного кровообращения будет артериальная канюля, установленная в аорту, которая ограничивает кровоток и должна быть настолько короткая, насколько это возможно. Высокий кровоток через узкую артериальную канюлю генерирует высокий градиент давления, турбуленцию и кавитацию. Носик канюли изготовлен так, чтобы снизить скорость потока струи крови на выходе из артериальной канюли, чтобы предотвратить смещение атероматозной бляшки, образование расслоения стенки аорты, снизить скорость кровотока в магистральных сосудах шеи, а также снизить уровень гемолиза крови. Артериальная канюля выбирается на основании лучшего соотношения внутреннего (ID) и внешнего диаметров (OD), а так же показателей ее гидродинамики (соотношение градиента давления на выходе из канюли и потока жидкости/крови).
Риски установки аппарата
Операция довольно сложная, она имеет прогнозируемые и внезапные осложнения. Так, например, ни один врач не может дать гарантию, что во время установки механического сердца не возникнет смерть.
К достаточно ожидаемым рискам относятся:
- аллергические реакции на медикаменты,
- формирование кровяных сгустков,
- интенсивное кровотечение,
- инфекция,
- поломки или помехи в работе механизма.
Все же большинство операций проходят успешно и без осложнений, а пациенты с искусственным сердцем способны даже пробежать марафонскую дистанцию. Все зависит как от заболевания, так и от стремления пациента к выздоровлению и соблюдения рекомендаций врача.
Смотрите на видео об установке искусственного сердца:
Искусственное кровообращение
Искусственное кровообращение (синоним: экстракорпоральное кровообращение, искусственная перфузия) — способ поддержания кровотока в организме, отдельном органе или отдельной области искусственным путем.
Впервые мысль о возможности «сохранить в живом состоянии любую часть человеческого организма» с помощью искусственного кровообращения высказал французский физиолог Легаллуа (С. J. J. Legallois, 1812). В дальнейшем многие физиологи пытались осуществить эту идею в эксперименте на изолированных органах животных или человека.
Ш. Броун-Секару (1858) впервые удалось восстановить признаки жизни отсеченной от туловища головы собаки при пропускании через ее сосуды артериальной крови с помощью шприца. Мартин и Гопкинс (Н. Martin, J. Hopkins, 1881), Фредерик (L. A. Fredericq, 1890), Э. Старлинг (1898) и другие осуществляли перфузию отдельных органов с помощью перекрестного кровообращения или изолированного сердечно-легочного препарата. Различные варианты искусственного кровообращения обычно предусматривают одновременно искусственную оксигенацию поступающей из организма в аппарат и возвращаемой в него крови. Искусственное кровообращение может быть осуществлено как с помощью сердца и легких другого организма, так и с помощью специальных механических устройств — аппаратов искусственного кровообращения (АИК).
Первый примитивный аппарат для искусственного кровообращения, включавший механические устройства для оксигенации и нагнетания крови, был создан Фреем и Грубером (М. Frey, M. Gruber, 1885).
Самым крупным вкладом в развитие искусственного кровообращения были фундаментальные исследования С. С. Брюхоненко и его последователей С. И. Чечулина, Н. Н. Тереванского и В. Д. Янковского. Эти исследования, начатые в начале 20-х гг. 20 в., явились основополагающими в решении проблем искусственного кровообращения, связанных с конструированием аппарата «сердце — легкие», разработкой способов стабилизации. Свертывающей системы крови, а также использованием искусственного кровообращения для целей оживления целого организма и кардиохирургии. Созданный С. С. Брюхоненко и С. И. Чечулиным прибор, названный ими «автожектор», и его дальнейшие модификации фактически были первыми аппаратами, пригодными для осуществления полного искусственного кровообращения в эксперименте на животных. Они послужили прототипом целой серии отечественных аппаратов искусственного кровообращения, нашедших в дальнейшем широкое применение в клинике.
Первые операции на открытом сердце с применением искусственного кровообращения в эксперименте осуществлены Н. Н. Теребинским в 1930 г., а в клинике — в 1953 гг. Гиббоном (J. H. Gibbon).
В СССР пионерами освоения метода искусственного кровообращения в клинике были коллективы, руководимые Н. М. Амосовым, А. А. Вишневским, А. Н. Бакулевым, С. А. Колесниковым, П. А. Куприяновым, Б. В. Петровским и другими. Первая успешная операция с искусственным кровообращением в СССР выполнена А. А. Вишневским в 1957 г.
Практическое применение в клинике нашли три основных метода искусственного кровообращения: общее искусственное кровообращение, регионарное искусственное кровообращение и различные варианты вспомогательного кровообращения.
Общее искусственное кровообращение — наиболее распространенный метод. Он предусматривает полную замену насосной функции сердца и газообменной функции легких механическими устройствами на непродолжительное время. Основной аспект его применения — кардиохирургия.
Регионарное искусственное кровообращение — перфузия отдельного органа или области организма, временно изолированной от остальной сосудистой системы. Применяется главным образом в онкологии и гнойной хирургии для подведения больших концентраций лекарственных веществ непосредственно к очагу поражения.
Один из вариантов регионарного искусственного кровообращения — коронарно-каротидная перфузия — используется некоторыми авторами для целей кардиохирургии. В сочетании с умеренной гипотермией (смотри Гипотермия искусственная) он позволяет выполнять операции на сердце длительностью до 30 минут. Искусственное кровообращение для целей кардиохирургии получило широкое распространение. Во многих клиниках мира практически все операции на сердце выполняются в условиях искусственного кровообращения.
Аппараты для спасательных бригад
Катастрофа, стихийное бедствие или несчастный случай могут произойти в любой момент и с кем угодно. Человека в критическом состоянии можно спасти, если будет в наличии оборудование для реанимации. В машинах спасательных бригад МЧС, медицины катастроф и кардиологических «скорых» обязательно есть аппарат ИВЛ портативный, позволяющий транспортировать пострадавших живыми до стационарных больниц.
Портативные аппараты отличаются от стационарных только размерами и количеством режимов. Чистый кислород находится в баллонах, количество которых может быть сколь угодно велико.
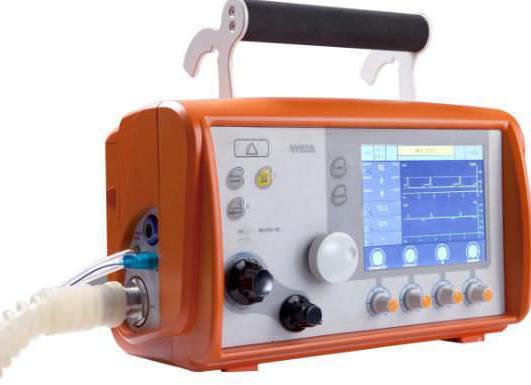
Режимы использования портативного аппарата обязательно включают принудительную и вспомогательную вентиляцию.
Как защищают миокард?
Процесс перфузии предусматривает пережимание аорты в пространстве между клапаном и ее корнем. Сердце изолировано от потока крови, искусственно обогащенной кислородом. Угроза появления патологии миокарда сердца сокращается путем охлаждения органа до +18 градусов. Находясь в таких температурных условиях, сердце выдержит ишемию на протяжении часа. Сокращению потребности миокарда в поступлении энергии способствует остановка органа – кардиоплегия. При этом обеспечивается полная асистолия сердца на время операции, поскольку фибрилляция желудочков увеличивает потребность миокарда в кислороде в два раза. Патологиям миокарда способствуют инотропные инъекции и хлористый кальций в высокой дозировке.
Подготовка АИК
Главное условие применения аппаратуры для перфузии – идеальная чистота поверхностей устройств, которые напрямую контактируют с кровью. Этого можно достичь путем обработки каждого элемента физиологического блока аппарата концентрированными щелочными растворами или детергентами с дальнейшим промыванием большим напором воды. Только после этих мероприятий аппарат отправляется на сборку и стерилизацию.
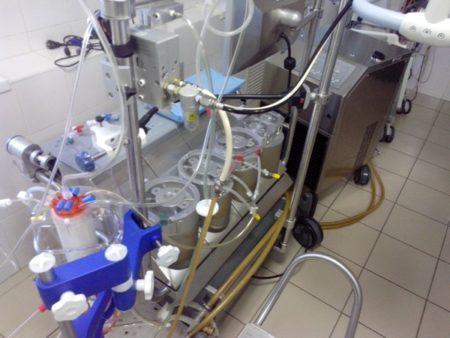
В зависимости от вещества, из которого состоят определенные части физиологического блока, для достижения стерильности может использоваться автоклавирование либо холодная методика стерилизации при помощи бактерицидного газа. Широко применяются апирогенные стерильные системы для перфузии, которые поставляются в готовом виде и предназначены для одноразового применения.
Когда аппарат полностью собран, в него впускают жидкости – заменители крови. И на требуемом этапе хирургической операции его подсоединяют к пациенту.
Конструкция АИК
Конструктивно аппарат представляет собой совокупность, состоящую из консоли с насосами и блоком управления с необходимым набором датчиков и вспомогательной оснастки (инфузионные стойки, полки из нержавеющей стали, венозный зажим). На подвижной консоли устанавливаются роликовые насосы с частотой вращения роликов до 250 об/мин, что позволяет получать потоки крови от 0 до 11,2 литров в минуту на трубках ½». Один из насосов (артериальный) перекачивает кровь из венозной системы в артериальную. Второй — предназначен для дренажа левого желудочка сердца, третий — для отсоса крови из раны и возвращения её в экстракорпоральный контур, четвёртый и пятый насосы используют для различных режимов кардиоплегии. Для уменьшения размеров аппарата и обеспечения согласованных режимов кровяной кардиоплегии насосы могут быть объединены в единый насосный модуль с 2 независимыми моторами в едином корпусе и с совместным электронным модулем контроля. Кроме насосов аппарат снабжён блоком контроля давления, электротермометром, смесителем газов, таймерами, детекторами уровня и пузырьков — объединёнными в блок управления.
Насосы для крови используют трёх типов: создающие отдельно систолу и диастолу (основаны на принципе изменения объёма камеры мембраной при помощи гидравлической или пневматической среды); создающие кровоток в гибких трубках расширением или сжатием (клапаны размещены в просвете трубки или вне её); создающие кровоток прерывистой волной (роликовые и пальчиковые). Все насосы для крови по механизму действия разделяются на насосы с постоянным и переменным ударным объёмом, а по характеру создаваемого ими тока крови на насосы с малой и большой пульсацией. Для реализации температурных режимов используют теплообменник с терморегулирующим устройством. Система управления обеспечивает заданные режимы работы как отдельных функциональных узлов, так и аппарата в целом.
Аппарат искусственного кровообращения приводят в действие при помощи гидравлического, пневматического или электромеханического приводов. При аварийном режиме применяют ручной привод. В мире создано множество различных по назначению аппаратов искусственного кровообращения: для изолированной химиотерапии злокачественных новообразований, воспалительных процессов и деструктивных поражений; для вспомогательного искусственного кровообращения при нарушениях сердечной и дыхательной функции; для реанимации больных, находящихся в состоянии клинической смерти; для поддержания жизнедеятельности изолированных органов, предназначенных для последующей пересадки. Все аппараты имеют общую структурную схему и отличаются друг от друга производительностью, особенностями систем управления или дополнительными специальными функциональными узлами.
Транспортная упаковка
Комплект оборудования АВК-Н представлен на фотографии.
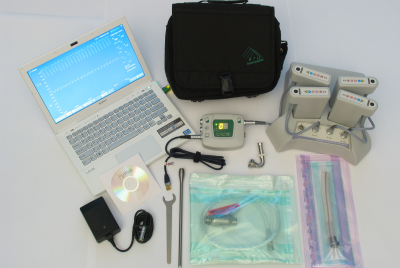
Для транспортировки АВК-Н используется кейс из сополимерного полипропилена. Корпус герметичный, характеризуется высокой стойкостью к ударным нагрузкам. В конструкцию встроен атмосферный клапан для выравнивания давления,5 замков ABS. Размер кейса 79.50×51.80×31.00 см, вес около 25 кг.Для удобства перемещения системы в кейс встроены колеса и выдвижная ручка. Кейс состоит из трех уровней. Ложементы каждого уровня спроектированы с учётом удобства размещения всех компонент системы по назначению.

На первом уровне размещаются имплантируемые компоненты АВК-Н, на втором и третьем – экстракорпоральные. Первый и второй уровни объединены в один бокс и содержат полный комплект оборудования, необходимый для проведения операции. Третий уровень содержит оборудование передаваемое пациенту для обслуживания АВК-Н.В крышку кейса встроен органайзер с тремя карманами для размещения сумки пациента и комплекта эксплуатационной документации.
Проведение искусственного кровообращения
Проведение искусственного кровообращения начинают с одновременного включения артериального насоса и снятия зажимов с венозной линии аппарата, не допуская полного оттока крови из организма. Синхронно увеличивая производительность насоса и величину венозного притока, доводят объёмную скорость перфузии до расчётной (2,2—2,4 л/мин на 1 м² поверхности тела). В дальнейшем руководствуются критериями адекватности перфузии.
Длительность искусственного кровообращения зависит от характера патологии и колеблется от нескольких минут (ушивание дефекта межпредсердной перегородки, ликвидация изолированного клапанного стеноза лёгочного ствола) до многих часов (одновременное протезирование нескольких клапанов сердца).
Переход на естественное кровообращение начинают с постепенного или одномоментного прекращения поступления крови в аппарат с одновременным уменьшением производительности артериального насоса. Нагнетание крови в артерии полностью прекращают по достижении оптимального объёма циркулирующей крови в сосудистом русле больного, о чём судят по величине центрального венозного давления, которая должна составлять в этот момент 150—180 мм водного столба.
В случае длительного искусственного кровообращения (свыше 1 часа) целесообразно сочетать его с искусственной гипотермией, которая сопровождается снижением потребности организма в кислороде, что позволяет уменьшить объёмную скорость перфузии, а тем самым и травму . В большинстве случаев достаточна умеренная гипотермия (температура в пищеводе не ниже 28°). Глубокая гипотермия до 15—10° применяется крайне редко, при необходимости временной полной остановки кровообращения.
При проведении искусственного кровообращения широко применяют метод управляемой гемодилюции, то есть разбавления циркулирующей крови замещающими жидкостями (например, низкомолекулярными растворами электролитов, сахаров или белков).
Теплообменник
Теплообменник может нагревать или охлаждать кровь пациента, таким образом, контролируя температуру тела пациента, а также температуру кардиоплегического раствора. Как правило, теплообменник интегрирован с оксигенатором и расположен проксимально от оксигенатора, для того чтобы предотвратить образование пузырьков газа в потоке крови при изменении ее температуры (например, если подогревать насыщенную кислородом кровь). Температура воды, циркулирующая через теплобменник, может быть составлять от 5 до 42”С (при повышении температуры до 42”С может начаться денатурация белков плазмы человека). Таким образом, кровь может охлаждаться быстрее (0,5-17”С/мин) и большим градиентом, чем согреваться (0,2-0,5”С/мин). Темп охлаждения при снижении температуры крови пациента также должен снижаться по тем же соображениям. Температура тела пациента и температура перфузата (кровь в контуре искусственного кровообращения) не должна отличаться более чем 15°С.
В каких случаях используется аппарат ЭКМО?
ЭКМО требуется пациентам с сердечной недостаточностью, легочной недостаточностью и тем, кто недавно перенес операцию на сердце. Также ЭКМО используют, чтобы оценить состояние других органов, таких как почки или мозг, прежде чем приступать к операции на сердце или легких. Помимо этого, аппарат применяют для поддержки организма пациентов, которые стоят в очереди на пересадку легких – метод экстракорпоральной оксигенации помогает поддерживать ткани хорошо насыщенными кислородом, что делает пациента лучшим кандидатом для трансплантации.
Сегодня, в условиях пандемии нового коронавируса SARS-CoV-2 (COVID-19), ЭКМО требуется большому количеству пациентов. В Китае экстракорпоральная оксигенация позволила существенно снизить смертность. Но сложность заключается в том, что далеко не во всех странах проводят эту процедуру, к тому же, ситуация с количеством аппаратов ЭКМО такая же, как и с количеством аппаратов искусственной вентиляции легких (ИВЛ). При этом очень часто пациентов подключают сразу и к ЭКМО и ИВЛ, так как это помогает заживлению главного органа дыхания — легких.
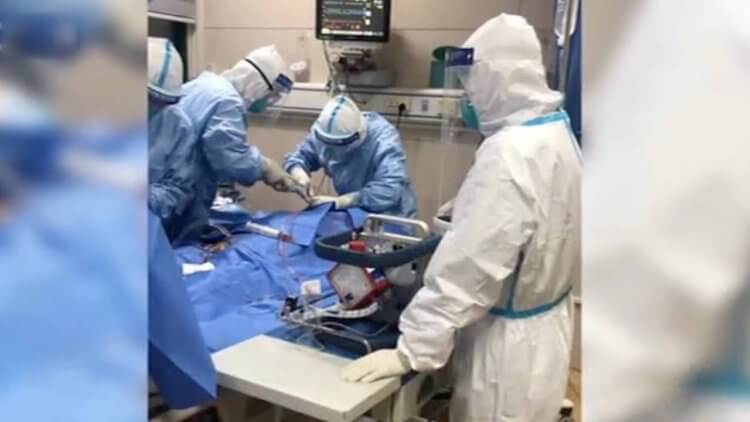
Врачи в Ухане, Китай, оперируют больного коронавирусом
Как устроены современные аппараты?
Каждый аппарат ИВЛ имеет блоки управления и исполнения. Блок управления – это клавиатура и экран, на котором видны все показатели. Аппараты более ранних моделей устроены проще, там есть простая прозрачная трубка, внутри которой движется канюля. Движения канюли отображают частоту дыхательных движений. Есть также манометр, на котором видно давление нагнетаемой смеси.
Исполнительный блок – это набор устройств. Прежде всего, это камера высокого давления для смешивания чистого кислорода с другими газами. В камеру кислород может подаваться из центрального газопровода или баллона. Централизованную подачу кислорода устраивают в больших клиниках, где есть кислородные станции. Все остальные довольствуются баллонами, но качество искусственного дыхания от этого никак не меняется.
Обязательно есть регулятор скорости подачи газовой смеси. Это винт, изменяющий диаметр трубки, подающей кислород.
В хороших аппаратах есть также камера смешения и согревания газов. Имеется также бактериальный фильтр и увлажнитель.
Для пациента предназначен дыхательный контур, подающий обогащенную кислородом газовую смесь и отводящий углекислый газ.
Какими были первые аппараты для дыхания?
Первый аппарат ИВЛ имитировал движения грудной клетки, поднимая ребра и расширяя грудную клетку. Назывался он «кираса» и надевался поверх грудной клетки. Создавалось отрицательное давление воздуха, то есть воздух поневоле засасывался в дыхательные пути. Статистических данных о том, насколько он был эффективен, не сохранилось.
Затем в течение веков использовали устройства, подобные кузнечным мехам. Вдували атмосферный воздух, давление регулировали «на глаз». Частыми были случаи разрыва легких из-за чрезмерного давления подаваемого воздуха.
Современные медицинские приборы работают по-другому.
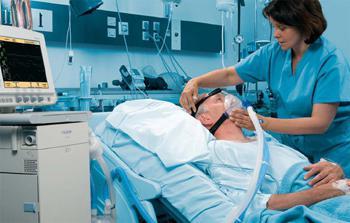
В легкие вдувается смесь кислорода и атмосферного воздуха. Давление смеси ненамного превышает легочное. Этот метод несколько противоречит физиологии, но действенность его очень высока: все люди, подключенные к аппарату, дышат – следовательно, живут.
Технология подключения к АИК
Вначале аппарат для перфузии заполняется перфузатом, из артериальных трубок выкачивают воздух. Больному делают инъекцию гепарина, затем подсоединяют устройство к полым венам и аортальному сосуду. Переключение на искусственное кровообращение проводится в две стадии. Сначала проводится параллельная перфузия. Сердце работает самостоятельно, и одновременно начинает функционировать аппарат. Такая мера необходима, чтобы получить правильный баланс между поступлением крови в искусственную систему и ее оттоком.
На протяжении трех минут постепенно растет производительность искусственной системы до 2,2 литра в минуту. И только после этого пациента переключают полностью на искусственное кровообращение. Перфузия провоцирует активацию различных гормональных систем в организме. В крови повышается содержание АДГ, катехоламинов, кортизола и прочих гормонов стресса. Общий наркоз способен только частично заблокировать реакцию сердца и всего организма на стресс. Улучшение малой циркуляции наступает благодаря использованию вазодилататоров.
Как только начинается перфузия, наблюдается падение давления в артериях, которое спустя 15 минут работы аппарата повышается, однако не соответствует первоначальному уровню. Среднее давление при перфузии поддерживается на уровне 60 мм ртутного столба. В случае повышения среднего показателя выше 100 мм ртутного столба врачи принимают решение о введении вазодилататоров.
Кровеносные магистрали и коннекторы
Кровеносные магистрали и коннекторы изготавливаются из нетоксических, неиммуногенных, неаллергических и немутагенных материалов. Они должны быть водонепроницаемы, прозрачные, достаточно гибкие и в то же время прочные, химически инертные, ровные и гладкие, а так же пригодные для производства в большом количестве. Самыми подходящими материалами для этого могут быть поливинилхлорид, тефлон, титан, силикон. Кровеносные магистрали часто покрываются гепаринсодержащими компонентами. Перед началом искусственного кровообращения для удаления воздуха кровеносные магистрали заполняются кровезамещающими растворами, компонентами крови или их комбинацией. Этот объем жидкости называется объемом первичного заполнения, и для него требуется от 1 000 до 2 000 мл вышеуказанных компонентов. Все эти компоненты первичного заполнения после начала искусственного кровообращения попадают в систему кровообращения пациента
Очень важно для снижения градиента давления в кровеносных магистралях подобрать баланс между диаметром магистралей и получаемым объемом первичного заполнения, чтобы снизить степень гемодилюции. Одним из решением данной проблемы может быть уменьшение длины кровеносных магистралей