Уроки по неорганической химии для подготовки к егэ
Содержание:
- Температурные показатели
- Что такое пламя и почему огонь бывает разного цвета
- Часто задаваемые вопросы
- Цвет пламени [ править | править код ]
- Правильный цвет горения газа – синий
- Тонкости окраски свечей
- Кровельные покрытия из меди
- Окислительная и восстановительная область
- Цветовая характеристика
- Цвет пламени
- Происхождение
- Цвет пламени и химический состав
- Цвета соединений, знание которых необходимо для сдачи ЕГЭ
- Прозрачные и цветные свечи
- Цвет пламени и химический состав
- Секрет производства греческого огня
- Горение металлов
- Фазы горения
Температурные показатели
Каждая зона огня свечи или горелки имеет свои значения, обусловленные поступлением кислородным молекул. Температура открытого пламени в разных его частях колеблется от 300 °C до 1600 °C.
Примером служит пламя диффузионное и ламинарное, которое образовано тремя оболочками. Конус его состоит из темного участка с температурой до 360 °C и недостатком окисляющего вещества. Над ним располагается зона свечения. Ее температурный показатель колеблется от 550 до 850 °C, что способствует разложению термическому горючей смеси и ее горению.
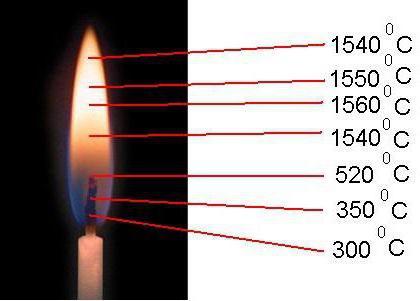
Внешняя область едва заметная. В ней температура пламени доходит до 1560 °C, что обусловлено природными характеристиками топливных молекул и быстротой поступления окисляющего вещества. Здесь горение наиболее энергичное.
Вещества воспламеняются при разных температурных условиях. Так, металлический магний горит только при 2210 °С. Для многих твердых веществ температура пламени около 350 °С. Возгорание спичек и керосина возможно при 800 °С, тогда как древесины – от 850 °С до 950 °С.
Сигарета горит пламенем, температура которого варьируется от 690 до 790 °С, а в пропан-бутановой смеси – от 790 °С до 1960 °С. Бензин воспламеняется при 1350 °С. Пламя горения спирта имеет температуру не более 900 °С.
Что такое пламя и почему огонь бывает разного цвета
Языки пламени представлены в виде раскаленных газов, иногда содержащих плазму и твердые элементы, в которых совершаются физико-химические перевоплощения реагентных элементов, вызывающие свечение, выделение тепла, самостоятельный нагрев.
Газообразная среда пламени состоит из заряженных ионов и радикалов, что объясняет возможность электропроводности пламени и его взаимодействие с электромагнитными полями. По такому принципу производятся приборы, обладающие способностью при помощи электромагнитного излучения приглушать пламя, оторвать его от горючих материалов и даже изменить форму.
Причины разноцветности пламени
Почему включив газовую конфорку и поджигая выходящий газ, мы видим голубоватый огонь? В процессе горения газ распадается на кислород и углерод, выделяя при этом угарный газ, который и является причиной голубого цвета.
 Почему подожженная простая пищевая соль – в огне выдает желтые и красные цвета? В состав соли входит хлорид натрия, при горении создающий желто-оранжевые языки пламени. Любой деревянный предмет или костер из дров будут гореть таким же цветом, так как в составе древесного материала находится большое количество подобных солей.
Почему подожженная простая пищевая соль – в огне выдает желтые и красные цвета? В состав соли входит хлорид натрия, при горении создающий желто-оранжевые языки пламени. Любой деревянный предмет или костер из дров будут гореть таким же цветом, так как в составе древесного материала находится большое количество подобных солей.

Есть у огня и зеленые оттенки, почему? Их появление означает то, что в горящих предметах содержатся фосфор или медь. Причем медное пламя будет ярким и слепящим, близким к белому. Причиной зеленого пламени может стать наличие в предметах горения бария, молибдена, фосфора, сурьмы. Синий цвет зависит от селена или бора.

Огонь без признаков цвета можно увидеть только в лабораторных условиях. Понять, что что-то горит, возможно только по легкому колебанию воздуха и выделяемому теплу.
Помните! Огонь очень опасен. Распространяется молниеносно. Никогда не играйте с огнем. Находиться рядом с огнем можно только в присутствии взрослых!
Полезно знать
- Все газовые приборы представляют собой повышенную опасность. По этой причине не помешает узнать некоторые признаки поломок, способы их устранения. Определять неисправности будем по цвету пламени.
- Если ваша горелка при работе издает желтое пламя или оранжевое – это признак того, что не хватает воздушной смеси. Чтобы горение газа проходило правильно, максимально выдавала тепло, необходимо достаточное количество воздуха, который перемешивается с газом в главной горелке.
- Нарушение баланса в смеси топлива и воздуха может произойти по разным причинам. Воздушные отверстия засорились пылью, не давая проходить воздушным потокам. Пылевые накопления, сгорая, создают желтоватый или оранжевый цвет пламени.
- Желтизна пламени возможна и в том случае, газовое оборудование приобретено неправильно. При сгорании любого топлива выделяется угарный газ. Колонки, выдающие при работе синее пламя, выдают низкий уровень СО. Наличие оранжевого или красного огня говорят об обратном.
- При отравлении угарными газами наблюдаются симптомы, как при гриппе – головные боли, тошнота, головокружения. Угарный газ опасен тем, что его присутствие зачастую остается незамеченным людьми, так как он не отличается наличием цвета или запаха.

Теперь вы знаете, почему огонь бывает разного цвета, от чего зависит цвет пламени
Обратите внимание: если мы наблюдаем на газовом приборе желтое, красное или оранжевое пламя – это можно считать сигналом опасности. Обнаружив это, необходимо вызвать квалифицированных специалистов, которые определят причину и устранят неисправность газового оборудования
Часто задаваемые вопросы
У меня не получается вставить носик в баночку.
Попробуйте с другим носиком. Постарайтесь вставить его в баночку так, чтобы он в ней плотно сидел. Разумеется, вы можете попросить помощи у взрослого.
А я могу использовать обычную фольгу для проведения опыта?
Если вы внимательно посмотрите, то увидите, что фольга в наборе несколько плотнее, чем обычная фольга. По этой причине ее не стоит заменять на какую-либо другую. Фольги в наборе должно быть достаточно для проведения опыта несколько раз.
У меня не получается высыпать сухое горючее из баночки.
Перемешайте сухое горючее в баночке при помощи деревянной палочки. Так вы сможете разбить комочки и насыпать на фольгу требуемое количество горючего.
Как лучше высыпать металлические порошки в пламя?
Направьте носик баночки на пламя под углом 30–40 градусов. Легонько постучите по баночке, чтобы порошок начал высыпаться. Если это не помогает, сделайте угол наклона поострее и постучите по баночке посильнее.
Цвет пламени [ править | править код ]
Цвет пламени определяется излучением электронных переходов (например, тепловым излучением) различных возбужденных (как заряженных, так и незаряженных) частиц, образующихся в результате химической реакции между молекулами горючего и кислородом воздуха, а также в результате термической диссоциации. В частности, при горении углеродного горючего в воздухе, синяя часть цвета пламени обусловлена излучением частиц CN ±n , красно-оранжевая — излучением частиц С2 ±n и микрочастиц сажи. Излучение прочих образующихся в процессе горения частиц (CHx ±n , H2O ±n , HO ±n , CO2 ±n , CO ±n ) и основных газов (N2, O2, Ar) лежит в невидимой для человеческого глаза УФ и ИК части спектра. Кроме того, на окраску пламени сильно влияет присутствие в самом топливе, деталях конструкции горелок, сопел и так далее соединений различных металлов, в первую очередь натрия. В видимой части спектра излучение натрия крайне интенсивно и ответственно за оранжево-желтый цвет пламени, при этом излучение чуть менее распространенного калия оказывается на его фоне практически не различимым (поскольку большинство организмов имеют в составе клеток K+/Na+ каналы, то в углеродном горючем растительного или животного происхождения на 3 атома натрия приходится в среднем 2 атома калия).
Правильный цвет горения газа – синий
Если не избавиться от исправности еда и вода будет накапливать серу, что также негативно скажется на здоровье пользователя. Правильный цвет – синий
Достигает он при правильном соотношении газа и воздуха.
Выделить можно несколько причин, почему стоит обращать внимание на этот показатель
Правильный цвет – синий. Достигает он при правильном соотношении газа и воздуха.
1. Если горелка коптит – огонь не может полноценно нагревать воду или еду. Следовательно, увеличивается расход использования природного топлива.
2. Угарный газ, о чем свидетельствует красный огонек, приводит к огромному количеству несчастных случаев.
Красный огонь в отечественной газовой плите первый тревожный звонок.
Тонкости окраски свечей
Не пытайтесь окрасить свечи акварельными красками или пищевыми красителями. Если вы решили серьезно подойти к процессу изготовления свечей, воспользуйтесь порошкообразными красками, анилиновыми красками на масляной основе или натуральными окрашивающими веществами. Иногда применяют карандаши для воска, красители «Тинтекс» и «Рит». Легче всего пользоваться карандашами для воска, но у них есть свои недостатки. Основной из них состоит в том, что может возникнуть химическая реакция, в результате которой будет уничтожен фитиль.
Другие красители часто окрашивают воск неравномерно. Лучше всего пользоваться красителями, растворимыми в воске. Поищите красители для свечей в магазинах, где предлагаются товары для досуга. Для окрашивания свечей идеально подходят порошкообразные краски. Не забывайте, что большинство красителей для воска светлеют при его застывании, поэтому поэкспериментируйте, чтобы выяснить, сколько красителя надо добавлять.
Рекомендуется попробовать натуральные красители. За исключением окрашивания с помощью индиго, основной метод окрашивания свечей прост: надо поместить краситель (цветы, листья) в нейлоновый мешочек и положить его в растопленный воск. Для изготовления мешочка идеально подойдет нижняя часть старых нейлоновых колготок.
Большинство свежих растительных красителей придают воску насыщенный цвет примерно за час. Если по прошествии этого времени воск окрасился недостаточно, выньте мешочек и замените его другим, со свежим красителем. Нагревайте воск вместе с мешочком, пока воск не приобретет нужную окраску. Если оттенок получился чересчур насыщенный, добавьте еще немного воска, и он станет светлее.
При окрашивании воска с помощью индиго сначала добавьте в горячий воск стеариновую кислоту, а затем поместите в него маленький мешочек со столовой ложкой порошка индиго.
Стеариновая кислота необходима для извлечения цвета.
Кровельные покрытия из меди
Красивый цвет, который характерен для меди (см. фото), а также ее исключительная коррозионная устойчивость послужили причиной того, что много лет назад ее начали использовать как кровельный материал
Долгое время медь в этом качестве уступала свои позиции более дешевым стали и алюминию, но сейчас архитекторы и дизайнеры вновь обратили внимание на этот уникальный во всех отношениях металл
Отличающаяся роскошным цветом кровля из меди не только выглядит привлекательно с эстетической точки зрения и способна прослужить своим владельцам не один десяток лет, но и способна успешно противостоять значительным механическим, температурным и любым другим воздействиям. Дома, покрытые кровлей из этого металла, выглядят стильно и презентабельно.

Кровельное покрытие из меди
Окислительная и восстановительная область
Процесс окисления протекает в слабозаметной зоне. Она самая горячая и располагается вверху. В ней топливные частицы подвергаются полному сгоранию. А наличие в кислородного избытка и горючего недостатка приводит к интенсивному процессу окисления. Этой особенностью следует пользоваться при нагревании предметов над горелкой. Именно поэтому вещество погружают в верхнюю часть пламени. Такое горение протекает намного быстрее.
Восстановительные реакции проходят в центральной и нижней части пламени. Здесь содержится большой запас горючих веществ и малое количество O2 молекул, осуществляющих горение. При внесении в эти области кислородсодержащих соединений осуществляется отщепление O элемента.
В качестве примера восстановительного пламени используют процесс расщепления железа двухвалентного сульфата. При попадании FeSO4 в центральную часть факела горелки, происходит вначале его нагревание, а затем разложение на оксид трехвалентного железа, ангидрид и двуокись серы. В данной реакции наблюдается восстановление S с зарядом от +6 до +4.
Цветовая характеристика
Излучения различных цветов пламени, вызывается электронными переходами. Их еще называют тепловыми. Так, в результате горения углеводородного компонента в воздушной среде, синее пламя обусловлено выделением соединения H-C. А при излучении частичек C-C, факел окрашивается в оранжево-красный цвет.
Трудно рассмотреть строение пламени, химия которого включает соединения воды, углекислого и угарного газа, связь OH. Его языки практически бесцветны, так как вышеуказанные частички при горении выделяют излучения ультрафиолетового и инфракрасного спектра.
Окраска пламени взаимосвязана с температурными показателями, с наличием в нем ионных частиц, которые относятся к определенному эмиссионному или оптическому спектру. Так, горение некоторых элементов приводит к изменению цвета огня в горелке. Отличия в окрашивании факела связаны с расположением элементов в разных группах системы периодической.
Огонь на наличие излучений, относящихся к видимому спектру, изучают спектроскопом. При этом было установлено, что простые вещества из общей подгруппы оказывают и подобное окрашивание пламени. Для наглядности используют горение натрия в качестве теста на данный металл. При внесении его в пламя, языки становятся ярко-желтыми. На основании цветовых характеристик выделяют натриевую линию в эмиссионном спектре.
Для щелочных металлов характерно свойство быстрого возбуждения светового излучения атомарных частиц. При внесении труднолетучих соединений таких элементов в огонь горелки Бунзена происходит его окрашивание.
Спектроскопическое исследование показывает характерные линии в области, видимой для глаза человека. Быстрота возбуждения светового излучения и простое спектральное строение тесно взаимосвязаны с высокой электроположительной характеристикой данных металлов.
Цвет пламени
различный вид горелки Бунзена зависит от притока кислорода:1. богатая топливная смесь без предварительного смешивания с кислородом (подача кислорода закрыта) горит жёлтым коптящим рассеянным пламенем2. подача воздуха снизу почти перекрыта3. открыта в средней мере: смесь близка к стехиометрической4. подача воздуха максимальная: бедная смесь
Цвет пламени определяется излучением электронных переходов (например, тепловым излучением) различных возбужденных (как заряженных, так и незаряженных) частиц, образующихся в результате химической реакции между молекулами горючего и кислородом воздуха, а также в результате термической диссоциации. В частности, при горении углеродного горючего в воздухе, синяя часть цвета пламени обусловлена излучением частиц CN±n, красно-оранжевая — излучением частиц С2±n и микрочастиц сажи. Излучение прочих образующихся в процессе горения частиц (CHx±n, H2O±n, HO±n, CO2±n, CO±n) и основных газов (N2, O2, Ar) лежит в невидимой для человеческого глаза УФ и ИК части спектра. Кроме того, на окраску пламени сильно влияет присутствие в самом топливе, деталях конструкции горелок, сопел и так далее соединений различных металлов, в первую очередь натрия. В видимой части спектра излучение натрия крайне интенсивно и ответственно за оранжево-желтый цвет пламени, при этом излучение чуть менее распространенного калия оказывается на его фоне практически не различимым (поскольку большинство организмов имеют в составе клеток K+/Na+ каналы, то в углеродном горючем растительного или животного происхождения на 3 атома натрия приходится в среднем 2 атома калия).
Происхождение
Цветовой тон побежалостей относится к интерференционным цветам. Визуально они изменяются при различном освещении и угле обзора. Также на изменение расцветки материала влияют физические и химические свойства металла.
Физика процесса
После начала нагревания стальной поверхности появляются побежалости, которые быстро изменяют окрас, начиная от желтого и заканчивая серым. В зависимости от температуры (более 500 градусов) появляются первые тона каления, заметные только при полной темноте.
Если температура превышает 650 градусов, металл раскаляется до темно-красного оттенка. При высокой температуре окрас оксидной пленки может изменяться с вишневого до белого (при 1100–1200 градусах). При дальнейшем нагревании белый будет становиться только ярче, но не изменится. Как говорилось выше, окрас нагрева поверхности металла не является точным индикатором температуры.
Оптические эффекты
Цветовой тон зависит от толщины оксидной пленки. Когда она увеличивается, гасятся цвета с коротким диапазоном волны. При увеличении градуса нагрева нарастает толщина пленки. Таким образом начинают исчезать определенные оттенки оксидов. Сначала пропадает фиолетовый, затем желтый, после них исчезает зеленый, красный. Это так называемая интерференция света.

Цветовой тон от нагрева
Цвет пламени и химический состав
Цвет пламени может меняться в зависимости от химических примесей, содержащихся в поленьях или другом горючем веществе. В пламени может находиться, например, примесь натрия.
Еще в древние времена ученые и алхимики пытались понять, что за вещества сгорают в огне, в зависимости от того, в какой цвет окрашивался огонь.
- Натрий — это составная часть поваренной соли. Если натрий раскалить, он окрашивается в ярко — желтый цвет.
- В огонь может попасть кальций. Мы все знаем, что кальция много в молоке. Это металл. Раскаленный кальций окрашивается в яркий красный цвет.
- Если в огне горит фосфор, то пламя окрасится в зеленоватый цвет. Все эти элементы или содержатся в дереве, или попадают в огонь с другими веществами.
- Практически у всех дома есть газовые плиты или колонки, пламя в которых окрашено в голубой оттенок. Это обусловлено сгораемым углеродом, угарным газом, который и дает этот оттенок.
Смешение цветов пламени, как и смешение цветов радуги, может дать белый цвет, поэтому в пламени костра или камина видны белые участки.
Температура пламени при горении некоторых веществ:
Цвета соединений, знание которых необходимо для сдачи ЕГЭ
1. Медь – мягкий пластичный металл розового цвета. Степени окисления: +1, +2.
Cu2O – кристаллическое, нерастворимое в воде вещество кирпично-красного цвета.
CuO – кристаллы чёрного цвета, практически нерастворимые в воде.
Cu(OH)2 – голубое аморфное или кристаллическое вещество; практически не растворимо в воде.
CuSO4 – кристаллическое вещество белого цвета, хорошо растворяется в воде. Из водных растворов кристаллизуется пентагидрат CuSO4·5H2O – медный купоро́с, кристаллы голубого цвета (при нагревании снова теряет воду и становится белым). Водный раствор CuSO4 также голубого цвета.
2. Цинк – металл голубовато-белого цвета, мягкий, хрупкий. Степень окисления: +2.
ZnO, Zn(OH)2, ZnS – белые твердые вещества, нерастворимые в воде.
3. Алюминий – легкий металл серебристо-белого цвета. Степень окисления: +3.
Al2O3, Al(OH)3 – белые твердые вещества, нерастворимые в воде.
AlPO4 — твёрдое, белое кристаллическое вещество, нерастворимое в воде.
4. Серебро – блестящий белый мягкий пластичный металл. Степень окисления: +1.
AgCl – белое твердое нерастворимое в воде вещество.
AgBr – светло-желтое твердое нерастворимое в воде вещество.
AgI – твердое нерастворимое в воде вещество желтого цвета.
Ag2O — твердое нерастворимое в воде вещество черного цвета.
Ag3PO4 — твердое нерастворимое в воде вещество желтого цвета.
5. Железо – серебристо-серый мягкий ковкий металл. Степени окисления: +2, +3, +6.
FeO – твердое нерастворимое в воде вещество черного цвета.
Fe(OH)2 – серо-зеленый осадок, студенистый осадок зеленого цвета. Не растворяется в воде.
Fe2O3, Fe(OH)3 – твердые красно-коричневые (бурые), нерастворимые в воде соединения.
Fe3O4 – твердое черное вещество. Не растворяется в воде.
FeCl3 – раствор желтого цвета.
6. Сера – желтое нерастворимое в воде вещество. Степени окисления: -2, +4, +6.
SO2 – бесцветный газ с неприятным запахом; газ, образующийся в момент зажигания спички
H2SO4 – тяжелая бесцветная жидкость, растворяется в воде с сильным разогреванием раствора.
7. Хром — твёрдый металл голубовато-белого цвета.
CrO — твердое вещество ченого цвета.
Cr2O3 — твердое вещество темно-зеленого цвета.
CrO3 — твердое вещество красного цвета.
Na2Cr2O7 и другие дихроматы — соединения оранжевого цвета.
Na2CrO4 и другие хроматы — соединения желтого цвета.
Cr2(SO4)3 — в растворе сине-фиолетового цвета (кислотная среда).
K3[Cr(OH)6] — в растворе зеленого цвета (щелочная среда).
8. Марганец — металл серебристо-белого цвета.
MnO2 — твердое нерастворимое в воде вещество бурого цвета.
Mn(OH)2 — белый осадок.
KMnO4 — пурпурные кристаллы, растворяется в воде с образованием фиолетового раствора.
K2MnO4 — растворимая соль темно-зеленого цвета.
Mn(NO3)2, MnCl2, MnBr2 и некоторые другие соли Mn+2 — как правило, розовые растворимые в воде соединения.
9. Фосфор — неметалл. Основные модификации: белый, красный и черный фосфор.
Ag3PO4 — твердое нерастворимое в воде вещество желтого цвета.
AlPO4 — твердое нерастворимое в воде вещество белого цвета.
Li3PO4 — твердое нерастворимое в воде вещество белого цвета.
Ba3(PO4)2 — осадок белого цвета
10. Свинец — ковкий, тяжёлый металл серебристо-белого цвета.
PbS — осадок черного цвета.
PbSO4 — осадок белого цвета.
PbI2 – осадок ярко-желтого цвета.
11. Соединения бария:
BaSO4 – белый осадок растворимый в кислотах
BaSO3 – белый осадок растворимый в кислотах
Ba3(PO4)2 — осадок белого цвета
BaCrO4 — осадок желтого цвета
12. Другие соединения:
CaCO3 – осадок белого цвета
NH3 – аммиак, бесцветный газ с резким запахом
CO2 – газ тяжелее воздуха, без цвета и запаха, играющий важную роль в процессе фотосинтеза.
NO2 – газ бурого цвета (лисий хвост)
H2SiO3 – бесцветный студенистый осадок
Прозрачные и цветные свечи
Совершенно прозрачные и бесцветные, как вода, свечи можно получить следующим образом: 5 частей бесцветного желатина распускают в 20 частях воды, затем прибавляют 25 частей глицерина и нагревают смесь до тех пор, пока не получится прозрачный раствор. К нему добавляют 2 части танина, растворенного при нагревании в 10 частях глицерина. Муть, образующаяся при соединении растворов, скоро исчезает при дальнейшем кипячении смеси. Готовую массу отливают в обыкновенные свечные формы. Получающиеся таким образом свечи горят спокойно, не распространяя никакого неприятного запаха.
Кстати, в глицерине хорошо растворяются многие красители, например, анилиновые, пищевые, чернила для струйных принтеров и даже паста от авторучки. Если не переборщить с краской, получатся свечи с нежными оттенками — морской волны, светло-розовые, лимонно-жёлтые и т.д.
Можно свечи сделать разноцветными, последовательно вливая в форму порции массы различных цветов. Если форму наклонять и поворачивать, пока не застынет очередная порция, получится неповторимое буйство красок.
Ещё больший эффект даёт вливание подкрашенной массы с помощью шприца. Внутри свечи получаются цветные шары или фигуры другой формы, в зависимости от движения иглы шприца.
Так как свечи прозрачны, фитиль также становится элементом дизайна. Можно сплести его из разноцветных нитей, завязать бантиками, макраме, связать миниатюрную варежку или колпак Санта Клауса. Затем подвесить так, чтобы полученная художественная композиция находилась примерно в нижней трети свечи.
В качестве простой формы для свечей можно использовать баночки из-под фотоплёнки — они имеют необходимую коническую форму. После застывания массы нужно взять свечу за фитиль и окунуть в горячую воду. Вдоль стенок масса размягчается, и форма легко сходит со свечи.
Учитывая необычную форму и вид этих свечек, легко предсказать их коммерческий успех. Старайтесь выпустить большие партии к Новому году, партии на фольклорные темы в расчете на туристов. Не забывайте рестораны и кафе, где в качестве освещения или интерьера используются свечи, разработайте для каждого из кафе свою фирменную свечу.
Если вы хотите изготовлять тонкие свечи, то для этого достаточно привязать фитили (кстати, фитили делают из ниток х/б) к дощечке и опустить их в расплавленную массу. Затем поднять, дать застыть массе на фитилях и опять опустить, наращивая на фитили необходимую толщину. Если же будете работать с формами, то изготовляйте свечи самых необычных форм и фигур. Постарайтесь ввести в фитиль ароматические добавки, чтобы при горении от свечи исходили благовонные запахи.
Цвет пламени и химический состав
Цвет пламени может меняться в зависимости от химических примесей, содержащихся в поленьях или другом горючем веществе. В пламени может находиться, например, примесь натрия.

Горение натрия
Еще в древние времена ученые и алхимики пытались понять, что за вещества сгорают в огне, в зависимости от того, в какой цвет окрашивался огонь.
- Натрий — это составная часть поваренной соли. Если натрий раскалить, он окрашивается в ярко — желтый цвет.
- В огонь может попасть кальций. Мы все знаем, что кальция много в молоке. Это металл. Раскаленный кальций окрашивается в яркий красный цвет.
- Если в огне горит фосфор, то пламя окрасится в зеленоватый цвет. Все эти элементы или содержатся в дереве, или попадают в огонь с другими веществами.
- Практически у всех дома есть газовые плиты или колонки, пламя в которых окрашено в голубой оттенок. Это обусловлено сгораемым углеродом, угарным газом, который и дает этот оттенок.

Смешение цветов пламени, как и смешение цветов радуги, может дать белый цвет, поэтому в пламени костра или камина видны белые участки.
Температура пламени при горении некоторых веществ:
| Спичка | 750-1200°С | |
| Природный газ | 400-800°С | |
| Спирт | 900°С | |
| Керосин | 1100°С | |
| Бензин | 1300-1400°С | |
| Магний | 2200°С |
Секрет производства греческого огня

Точный состав греческого огня остается неизвестным, посей день. Перед первым использованием в седьмом веке, другие зажигательные материалы были использованы в войне и их историки часто путают с термином греческого огня. Среди них:
- Сжиженная нефть, из нефтяных скважин в Ираке или Керкут (в долине Тигра, древней Ассирии). Вероятно, нефть использовалась вместе с горящей серой у древних ассирийцев. Для греческих и поздних времен народов, нефтяные скважины Артемиды и берегов Каспийского моря были доступны.
- Жидкость, используемая греками около 430 года до нашей эры, с огневых кораблей применяя зажигательные стрелы.
- Огневые смеси из смолы и серы, используемые греками из 424 году до нашей эры.
- Смесь негашеной извести и серы, разжигаемой при контакте с водой (186 год до нашей эры).
- Смесь негашеной извести и серы с другими легковоспламеняющимися материалами, такими как битум, смолы, нефть и другие. Разжигаемые при контакте с водой.
Джордж Партингтон вывел центральный тезис в отношении греческого огня (в его книге об истории греческого огня и пороха), что основным его ингредиентом является нефть, так как греческий огонь всегда описывается как жидкость или полужидкость. Жидким огнем также называли зажигательное масло.
«Ромокки понял, что бензин будет очень эффективным зажигательным составом, если применять с помощью насосов, и, поскольку Юлий Африкан говорил о «природной нефти» должен был искусственный (дистиллированная) вид, но он думал, что это было, вероятно, смешивая бензин с твердыми материалами. Рецепт дающейся Анной Комниной показывает, что твердые частицы были сосновой смолой и серой, но важный компонент, которым являлся бензин, она намеренно опускает. Негашеная известь не будет подходящим материалом и никогда не упоминается в качестве компонента греческого огня.
Бензин, полученный путем перегонки, может быть спроецирован на сжигание, либо распылялся, а также мог применяться в качестве зажигательной стрелы и для освещения. Несмотря на то, что он будет плавать на поверхности воды, но он по-прежнему будет гореть на воде. Увеличении эффективной дальности и стабильность пламени может быть достигнуто путем утолщения исходящей струи жидкости, даже не обязательно в той степени, чтобы производить пасту путем растворения в бензине смолы или иного твердого горючего».
Короче говоря, все свойства и эффекты греческого огня и всех прочих огней, а также описания всех методов их получения и использования, согласуются с тезисом Партингтоном в: «Дистилляция описываемая испано-арабским врачом Aбу-аль-Касимом (1013 и 1107)». И это описание можно было бы легко адаптировать к созданию бензина. До этого, знание это пришло из Египта в Сирию и, возможно, стало известно там Каллиником. И от туда же стало известно в Константинополе.
Очень вероятно, то, что в основе первой греческого огня был жидкая исправленная нефть или летучий бензин. Бензин ведет себя не очень эффективно в пламени проекторов (описываемых выше в виде насосов), так как его струи рассеивается слишком быстро. Но желе, путем растворения в нем смолистых веществ или серы, получало особую смесь, в сочетании с механическими средствами применения его, вместе составляли большое достижение химической инженерии.
Оман, в попытке собрать воедино пестрые воспоминания византийских писателей, пришел к выводу, что греческий огонь был: «полужидким веществом, состоящим из серы, растворенной селитры и вываренной нефти. Вместе с добавленными и смешанными с некоторыми менее важными и более неясными веществами». Если в этом описании опустить селитру, то получится не плохое описание греческого огня.
Вывод
История, возможно, сохранит в тайне греческий огонь для различных точек зрения. Общий мировой историк может рассматривать его в качестве изобретения, влиявшего на само существование наций или группы стран. Историк науки может рассматривать его чисто как одну из мелочей древности, изобретение с небольшим использованием сегодня, но не более чем, как в сноске по тексту.
Историк технологий может рассматривать его в свете его применения и изобретения устройства, помогающие ему произвести необходимый эффект. И, наконец, военный историк может его рассматривать, как элемент взрывного устройства и топлива, артиллерийского оружия используемого для защиты и нападения, которое благодаря тщательной безопасности и эффективной защите от разведки противника, отошло на второй план времени и остается предметом догадок и чудом для сегодняшнего дня.
Горение металлов
По характеру горения металлов их делят на две группы: летучие и нелетучие. Летучие металлы обладают относительно низкими температурами фазового перехода — температура плавления менее 1000 К, температура кипения не превышает 1500 К. К этой группе относятся щелочные металлы (литии, натрий, калий и др.) и щелочноземельные (магний, кальций). Температуры фазового перехода нелетучих металлов значительно выше. Температура плавления, как правило, выше 1000 К. а температура кипения — больше 2500 К (табл. 1).
Механизм горения металлов во многом определяется состоянием их окисла. Температура плавления летучих металлов значительно ниже температуры плавления их окислов. При этом последние представляют собой достаточно пористые образования.
При поднесении источника зажигания к поверхности металла происходит его испарение и окисление. При достижении концентрации паров, равной нижнему концентрационному пределу, происходит их воспламенение. Зона диффузионного горения устанавливается у поверхности, большая доля тепла перелается металлу, и он нагревается до температуры кипения. Образующиеся пары, свободно диффундируя через пористую окисную пленку, поступают в зону горения. Кипение металла вызывает периодическое разрушение окисной пленки, что интенсифицирует горение. Продукты горения (окислы металлов) диффундируют не только к поверхности металла, способствуя образованию корки окисла, но и в окружающее пространство, где, конденсируясь, образуют твердые частички в виде белого дыма. Образование белого плотного дыма является визуальным признаком горения летучих металлов.
У нелетучих металлов, обладающих высокими температурами фазового перехода, при горении на поверхности образуется весьма плотная окисная пленка, которая хорошо сцепляется с поверхностью металла. В результате этого скорость диффузии паров металла через пленку резко снижается и крупные частицы, например, алюминия и бериллия, гореть не способны. Как правило, пожары таких металлов имеют место в том случае, когда они находятся в виде стружки, порошков и аэрозолей. Их горение происходит без образования плотного дыма. Образование плотной окисной пленки на поверхности металла приводит к взрыву частицы. Это явление особенно часто наблюдается при движении частицы в высокотемпературной окислительной среде, связывают с накоплением паров металлов под окисной пленкой с последующим внезапным ее разрывом. Это, естественно, приводит к резкой интенсификации горения.
Основными параметрами их горения являются время воспламенения и сгорания. Из теории диффузионного горения следует, что время сгорания частицы металла tг пропорционально квадрату ее диаметра do. Экспериментальные данные показывают, что фактическая зависимость несколько отличается от теоретической. Так, для алюминия tг
Повышение концентрации кислорода в атмосфере интенсифицирует горение металла. Частички алюминия диаметром (53 ÷ 66) 10 -3 мм в атмосфере, содержащей 23% кислорода, сгорают за 12,7·10 -3 с, а при повышении концентрации окислителя до 60% — за 4,5·10 -3 с.
Однако для пожарно-технических расчетов большой интерес представляет не время сгорания частицы металла, а скорость распространения пламени по потоку взвеси частиц металла в окислителе. В табл.2 приведены экспериментальные данные по скорости распространения пламени и массовой скорости выгорания взвеси частиц диаметрами менее 10 -2 мм и 3·10 -2 мм алюминия в воздухе при различном коэффициенте избытка воздуха.
Фазы горения
По сути, деревья — концентрат энергии излучения Солнца. Листья растений работают как небольшие солнечные панели, поглощающие световую энергию, чтобы с её помощью преобразовать воду, углекислый газ и минералы в органические вещества. Горение можно рассматривать как процесс обратный фотосинтезу. Поджигание дров освобождает накопленную за время жизни растения энергию, реализуя её в виде высокой температуры огня в костре. Горение древесины проходит три фазы:
- Испарение влаги под воздействием температуры открытого пламени. Любая древесина содержит влагу, после поджигания вода в ней закипает и испаряется через трещины. Поскольку значительная часть подводимого тепла затрачивается на испарение, успешное поджигание либо требует сухих дров, либо большого количества тепла. Первая фаза завершается при достижении древесиной 100°C.
- Повышение температуры и газификация древесины. При 150 °C дерево начинает разлагаться на угли и летучие горючие вещества, оптимальная температура для этого процесса — от 280°C. Воспламенение газов происходит при температурах между 260 и 315°C с дальнейшим заметным пламенным горением. При 700°C и выше начинается процесс выделения и сжигания газов с высокой теплотворной способностью. Фаза заканчивается с прекращением образования летучих горючих веществ.
- Углеродное горение. После выделения первичных и вторичных газов остаются углеродные цепи и несгораемые вещества. Углерод, или древесный уголь, горит долго и без видимого пламени. Стадия заканчивается полным сгоранием твёрдых веществ в древесине до негорючей золы.