Кислоты, щелочи и основания с точки зрения химии
Содержание:
- Что такое щелочь?
- Таблица щелочных продуктов по степени ощелачивания
- Кислоты
- Серная кислота
- Показатель кислотности растворов рН, механизм действия
- Очищение организма ощелачивающими продуктами
- Щелочные продукты и пищевая сода при онкологии
- Кислота или щелочь?
- Физические свойства щелочей
- Кислоты, щелочи и основания с точки зрения химии
- Основные свойства кислот
- Основания и щелочи
- Каковы преимущества уксуса?
- Буферные системы обеспечивают кислотно-щелочной баланс
Что такое щелочь?
Щелочи — это соединения, в состав которых входят ион металла и гидроксид-ион (ОН-). К щелочам химики относят гидроксиды щелочных и щелочноземельных металлов. Щелочи представляют собой вещества белого цвета, которые хорошо растворяются в воде. Более того, растворение всегда сопровождается очень активным выделением тепла. Щелочи вступают в реакцию с кислотами, образуя соль и воду.

Такая щелочь, как гидроксид натрия, используется для производства твердого мыла
Щелочи очень активны! Они способны поглощать из воздуха не только водяные пары, но и молекулы углекислого газа, сероводорода и т.д. Поэтому хранят щелочи в очень герметичной таре. Концентрированные щелочи разрушают стекло, а иногда даже фарфор. Если сравнивать щелочи с кислотами, то щелочи могут вызвать более сильные ожоги, так как они очень быстро проникают в ткань, и их практически невозможно смыть водой.

Почему одни жидкости — кислоты, а другие — щелочи? Оказывается, все дело в типе ионов. Если в жидкости больше концентрация ионов водорода, такая жидкость является кислотой, а если гидроксид-ионов, то щелочью.
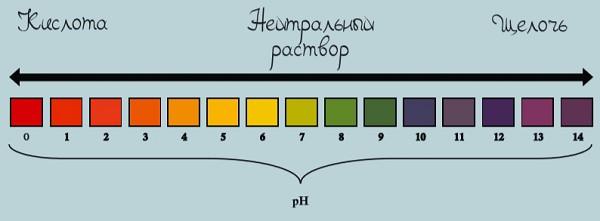
Шкала pH используется для измерения кислотности или щелочности раствора от 0 до 14.
Если pH раствора находится в пределах 0-7, то такой раствор считается кислотным, при этом раствор с pH = 0 — самый кислый. Растворы с pH в пределах 7-14 являются щелочами, при этом раствор с pH = 14 считается самым едким и опасным.
Если pH раствора равен 7, то такой раствор является нейтральным, так как концентрация ионов водорода равна концентрации гидроксид-ионов. Пример нейтрального раствора — чистая вода.
Что такое показатель pH?
В переводе с латинского pH (potentia hydrogeny) означает «сила водорода», т.е. активность ионов водорода в водном растворе.
Как химики определяют наличие воды в веществе?
Они берут бесцветный сульфат меди (CuSO 4) и добавляют его в вещество. Если воды нет, то порошок остается бесцветным, однако даже при минимальном количестве воды он становится синим.
Таблица щелочных продуктов по степени ощелачивания

Таблица дает возможность наглядно посмотреть, что должно первостепенно присутствовать на столе:
- ++++ — высокое содержание щелочи;
- +++ — умеренное;
- ++ — низкое;
- + — очень низкое.
| Продукт | Содержание щелочи |
| Лимон | ++++ |
| Грейпфрут | ++++ |
| Лайм | ++++ |
| Манго | ++++ |
| Сушеный инжир | ++++ |
| Хурма | ++++ |
| Помидоры | ++++ |
| Свежая свёкла | ++++ |
| Огурцы | ++++ |
| Тыква | ++++ |
| Водоросли | ++++ |
| Сода пищевая | ++++ |
| Абрикос | +++ |
| Авокадо | +++ |
| Киви | +++ |
| Смородина | +++ |
| Малина | +++ |
| Персик | +++ |
| Цветная капуста | +++ |
| Брокколи | +++ |
| Шпинат | +++ |
| Редис | +++ |
| Чеснок | +++ |
| Имбирь | +++ |
| Зелень | +++ |
| Перец | +++ |
| Оливки | +++ |
| Картофель с кожурой | +++ |
| Бобы | +++ |
| Сок из овощей | +++ |
| Травяной чай | +++ |
| Яблоки | ++ |
| Бананы | ++ |
| Вишня | ++ |
| Виноград | ++ |
| Сухофрукты | ++ |
| Изюм | ++ |
| Миндаль | ++ |
| Лук | ++ |
| Соя | ++ |
| Ежевика | ++ |
| Баклажаны | ++ |
| Грибы | ++ |
| Груши | ++ |
| Оливковое масло | ++ |
| Зеленый чай | ++ |
| Клюква | + |
| Просо | + |
| Киноа | + |
| Кефир | + |
| Молоко | + |
| Кинза | + |
| Квашеная капуста | + |
| Репа | + |
| Сельдерей | + |
При термической обработке ощелачивающие продукты питания из таблицы теряют полезные свойства. Поэтому употреблять их нужно в сыром виде.
Кислоты
(кислота хлористоводородная разведенная
и 0,1 Н раствор, кислота борная, салициловая
и др.)
Биологическое действие кислот
зависит, главным образом, от водородных
ионов, следовательно, их активность
определяется степенью диссоциации. При
диссоциации большинства кислот анион
существенного значения в действии
кислоты не играет. Исключение — синильная
кислота (НС), токсические свойства
которой зависят от аниона С.
Местное действие.
Кислоты, взаимодействуя с белами
кожи и слизистых оболочек, образуют
плотные нерастворимые в воде, не
проникающие вглубь ткани альбуминаты.
В малых концентрациях кислота
оказывает вяжущее действие
(противовоспалительное), а в более
высоких – раздражающее и прижигающее
действие. Вяжущий эффект более выражен
у слабых кислот; прижигающий – у сильных.
Слабо диссоциируют, например, борная
и салициловая кислоты, они обладают
противовоспалительным действием,
антибактериальным, противогрибковым
действием, используются как антисептики,
в зависимости от концентрации салициловая
кислота обладает кератопластическим
(стимулирует эпителизацию) 1-2%, или
кератолитическим (шелушащим) 10-20%
действием.
Местное действие кислот сопровождается
рефлекторными реакциями, их величина
и характер зависит от интенсивности
действия кислоты.
Сильные неорганические кислоты
(серная, соляная, азотная) вызывают
коагуляционный некроз; они отнимают
воду и на поверхности ткани образуют
плотный альбуминат – сухой струп.
Особый интерес представляет действие
кислот на секрецию и моторику ЖКТ. Это
действие было изучено школой И. П.
Павлова. Кислоты необходимы для
пищеварения (например, кислота
хлористоводородная разведенная), они
способствуют действию пепсина, усиливают
секрецию желудочного и панкреатического
соков, задерживают переход содержимого
желудков в 12-прстную кишку, т. к. попадая
в нее вызывает сокращение пилорической
части желудка, которая расслабляется
только после нейтрализации поступившей
кислоты.
Резорбтивное действие.
После всасывания в кровь или
парентерального введения, кислоты
немедленно нейтрализуются буферными
системами и резорбтивного действия не
оказывают.
При поступлении в кровь большого
количества кислот наступает истощение
щелочных резервов и развивается сначала
компенсированный, затем некомпенсированный
ацидоз (рН
Таким образом, клиника отравления
кислотами складывается из симптомов
их местного действия и явлений
некомпенсированного ацидоза (кома,
угнетенное дыхание, падение АД).
Меры помощи:
Удалить кислоту с
поверхности кожи водой или слабым
раствором щелочи (соды-гидрокарбонатаNа). Если кислота принята
внутрь ее нейтрализуют слабой щелочью
– окисью магния. Для предупреждения
шока вводят наркотические анальгетики
(промедол, омнопон), спазмолитики
(атропин, но-шпа). Средства специфической
терапии ацидоза (гидрокарбонатNа,
трисамин), проводят симптоматическую
и дозинтоксикационную терапию.
Щелочи – это едкие, твердые и легкорастворимые основания. Кислоты, как правило, кислые жидкости.
Серная кислота
Серная кислота играет важную роль в промышленности, прежде всего в производстве удобрений на основе суперфосфатов и сульфата аммония. Она также используется в производстве синтетических волокон, красителей, пластмасс, лекарств, взрывчатых веществ, моющих средств, автомобильных аккумуляторов. Когда-то серную кислоту называли минеральной кислотой
, так как ее получали из серы — вещества, встречающегося в земной коре в виде минерала. Серная кислота очень активна и агрессивна. При растворении в воде она выделяет много тепла, поэтому ее нужно вливать в воду, но не наоборот — тогда кислота растворится, а вода поглотит тепло. Она — мощный окислитель, т.е. при реакциях окисления она отдает кислород другим веществам. Серная кислота также является осушителем, т.е. забирает воду, связанную с другим веществом. Когда сахар (C 12 H 22 O 11) растворяется в концентрированной серной кислоте, кислота забирает у сахара воду, и от сахара остается пенящаяся масса черного угля.
Показатель кислотности растворов рН, механизм действия
Именно для этой шкалы разработаны специальные индикаторы — лакмусы
.
Это обычная полоска, которая реагирует на среду. В кислотной среде она окрашивается в красный цвет,
а в щелочной среде – в синий цвет.
Она необходима не только в химии, но и в быту.
Например, если у Вас есть аквариум, то немаловажную роль играет кислотность воды. От неё зависит вся жизнь аквариума. К примеру, показатель кислотности воды для аквариумных рыбок колеблется от 5 до 9 рН. Если будет больше или меньше, то рыбка будет чувствовать себя не комфортно, а может и вовсе умереть. Всё тоже самое и с растениями для аквариумов…
Работа с кислотами и щёлочами требует большой внимательности и осторожности. Ведь при попадании на кожу они вызывают сильные ожоги
Старайтесь работать в проветриваемом помещении. Вдыхать пары щёлочей и кислот также не рекомендуется. Для личной безопасности стоит воспользоваться очками, перчатками и специальной одеждой, чтобы не повредить глаза, руки и любимую одёжку)))При работе с кислотами
следует помнить, что сначала вливают кислоту в раствор (воду), а не наоборот. В противном случае произойдёт бурная реакция, которая сопровождается брызгами. А сам процесс добавления кислоты в раствор следует делать очень медленно, при этом контролировать степень нагрева сосуда и обязательно добавлять кислоту по стенкам сосуда. При работе со щёлочами
первым следует добавлять понемногу щёлочь (т.е. щелочь в воду — правильно!). К тому же запрещено пользоваться стеклянной посудой, рекомендуют фарфоровую или специальную посуду.
При химической обработке металлов (оксидирование, анодирование, травление и др.) погружать в раствор и вынимать из раствора изделие следует с помощью специальных приспособлений или инструментов, но никак не руками, даже если они в резиновых перчатках. Кстати, щёлочь входит в состав некоторых
Из неорганических лекарственных
веществ наибольшее значение для организма
имеют кислоты, щелочи, соли щелочных и
щелочноземельных металлов. Эти соединения
являются электролитами, т.е. в растворах
диссоциируют на ионы.
Очищение организма ощелачивающими продуктами
Вывести из организма токсины и шлаки поможет введение в рацион ощелачивающих продуктов. Капуста, морковь, огурцы, свекла, авокадо, хурма, цитрусовые и ягоды, зелень в свежем виде влияют на очищение всех внутренних органов, положительно влияя на перильстатику кишечника, кровеносную систему, борются с вредоносными микроорганизмами, улучшают метаболизм.
Чеснок – лучший помощник в очищении организма. Он способствует защите печени от пагубного влияния, выводит токсины и тяжелые металлы, поднимает иммунитет. Для очистки организма нужно проводить несколько раз в неделю разгрузочные дни, основанные на потреблении ощелачивающих продуктов.
И следовать нескольким простым правилам:
- Кушать часто, но небольшими порциями.
- Интервал между приемом пищи и питьем должен составлять: до еды – 30 минут, после – 2 часа.
- Пить в течение дня не менее 2 л жидкости;
- Ввести в ежедневный рацион чаи на траве – шиповнике, мяте, мелиссе.
- Отказаться от хлебобулочных изделий из пшеничной муки в пользу ржаной.
Соблюдение правильного сбалансированного питания, физические нагрузки и отказ от вредных привычек помогут организму помолодеть, повысить тонус, вывести паразитов.
Щелочные продукты и пищевая сода при онкологии
В нетрадиционной медицине все большее распространение получает способ борьбы с онкологическими заболеваниями обычной пищевой содой. Открыл этот метод выходец из Италии – Тулио Симончини – специалист в области иммунологии и онкологии.
Он считает, что рак развивается в организме из-за процессов его закисления. А сода, вступая в реакцию с кислотой способна уравновесить pH и создать щелоченную среду в организме, которая становится пагубной для патогенных клеток. В итоге раковая опухоль может не только остановиться, но и полностью исчезнуть из организма.
Лечение не заключается только в приеме соды, есть определенные правила, которые должен соблюдать больной:
- отказ от вредных привычек;
- прием дополнительных витаминов;
- исключить сладкое;
- сократить употребление молочных и мясных продуктов;
- В 1, 2 и 3 день лечения начинают пить содовой раствор в такой концентрации: на 100 мл теплой воды берется 1/5 ч.л. пищевой соды. Пить нужно за полчаса до первого приема пищи.
- С 4 по 7 день количество соды увеличивается. К 7 дню оно достигает 1/2 ч.л.;
- С 8 по 14 день количество приемов содового раствора увеличивается до 2-х раз в день перед завтраком и перед ужином;
- С 15 дня содовый раствор начинают принимать трижды в день.
Содовая терапия имеет ряд противопоказаний и эффективна на начальных этапах заболевания. В трудных случаях лечение содой следует использовать как дополнение к традиционным способам.
Кислота или щелочь?
Пробовать неизвестную жидкость на ощупь или на вкус, чтобы определить, это кислота или щелочь, чрезвычайно опасно и может оказаться даже смертельным. Обычно такое проделывают с помощью индикатора. Индикатор — это вещество, меняющее цвет при добавлении его в кислоту или щелочь. Самым известным индикатором является лакмус. Его используют в виде раствора или сухой полоски бумаги, пропитанной этим веществом. В обычном виде лакмус розового цвета. При добавлении его к кислоте цвет меняется на красный, а к щелочи— на синий. Если окраска лакмуса не меняется, то вещество, к которому его добавили, не является ни кислотой, ни щелочью, оно нейтрально.
 В средние века ужасная болезнь чума убивала миллионы людей. Тела покойников обливали известью, сильной едкой щелочью. Известь убивала микробы и способствовала быстрому разложению тел.
В средние века ужасная болезнь чума убивала миллионы людей. Тела покойников обливали известью, сильной едкой щелочью. Известь убивала микробы и способствовала быстрому разложению тел.
Кислоты и щелочи широко используют в промышленности. Каждый год производят миллионы тонн серной кислоты. Ее используют в автомобильных аккумуляторах, в производстве моющих средств, взрывчатых веществ, удобрений и красителей.
Кислоты и щелочи очень важны для земледелия и лесного хозяйства. Любое растение лучше всего растет на почве определенного типа: кислой, нейтральной либо щелочной. Тип почвы можно изменить с помощью добавок. Так, внесение извести в кислую почву превращает ее в нейтральную.
(едкий натр), KOH (едкий калий), Ba(OH) 2 (едкий барий). В качестве исключения можно отнести к щелочам гидроксид одновалентного таллия TlOH , который хорошо растворим в воде и является сильным основанием. Едкие щёлочи — тривиальное название гидроксидов лития LiOH , натрия NaOH , калия КОН , рубидия RbOH , и цезия CsOH .
Физические свойства щелочей
Помимо этого, щелочи также хорошо растворяются в этаноле. Концентрированные и умеренные растворы имеют pH от 7.1 и выше. Растворы щелочей мыльные на ощупь
Концентрированные составы — довольно едкие химические соединения, контакт с которыми вызывает химические ожоги кожи, глаз, любых слизистых оболочек, поэтому работать с ними следует осторожно. Воздействие едкого вещества можно нейтрализовать раствором кислоты
Щелочи могут находиться как в твердом, так и в жидком состоянии. Гидроксид натрия — самая распространенная щелочь (формула NaOH), которая в твердом состоянии представляет собой вещество белого света.

Гидроксид кальция при нормальных условиях — белый порошок. Гидроксиды радия и бария в твердом агрегатном состоянии — бесцветные кристаллы. Гидроксиды стронция и лития также бесцветны. Все твердые щелочи поглощают воду из воздуха. Гидроксид цезия — самая сильная щелочь (формула CsOH). Щелочные свойства металлов 1-ой группы основной подгруппы возрастают сверху вниз. Эти вещества нашли применение в химической промышленности. В основном их используют в щелочных аккумуляторах в качестве электролитов. Чаще всего применяют гидроксиды калия и натрия.
Кислоты, щелочи и основания с точки зрения химии

Что же представляют собой кислоты, щелочи и основания с химической точки зрения? Читай внимательно и запоминай. Смотри не запутайся!
Что такое основание?
Основание — это соединение, химически противоположное кислоте. В состав основания входят ионы металлов и связанные с ними гидроксид-ионы. Эти вещества способны присоединять ионы водорода (Н+) из кислоты. Когда основание смешивается с кислотой, оно полностью нейтрализует его свойства, а в результате реакции образуется соль.
Например, с точки зрения химии хорошо знакомая тебе зубная паста — это основание, которое нейтрализует кислоту, оставшуюся во рту после приема пищи.
ЗАПОМНИ! В связи с тем, что ионы существуют только в растворах, свои свойства кислоты проявляют также лишь в растворах.
Шкала pH
Почему одни жидкости — кислоты, а другие — щелочи? Оказывается, все дело в типе ионов. Если в жидкости больше концентрация ионов водорода, такая жидкость является кислотой, а если гидроксид-ионов, то щелочью.
Шкала pH используется для измерения кислотности или щелочности раствора от 0 до 14.
Если pH раствора находится в пределах 0—7, то такой раствор считается кислотным, при этом раствор с pH = 0 — самый кислый. Растворы с pH в пределах 7—14 являются щелочами, при этом раствор с pH = 14 считается самым едким и опасным.
Если pH раствора равен 7, то такой раствор является нейтральным, так как концентрация ионов водорода равна концентрации гидроксид-ионов. Пример нейтрального раствора — чистая вода.
Что такое показатель pH?
В переводе с латинского pH (potentia hydrogeny) означает «сила водорода», т.е. активность ионов водорода в водном растворе.
Как химики определяют наличие воды в веществе?
Они берут бесцветный сульфат меди (CuSO4) и добавляют его в вещество. Если воды нет, то порошок остается бесцветным, однако даже при минимальном количестве воды он становится синим.
Концентрированные кислоты и щелочи
Ядовитые жидкости находятся не только в школьных лабораториях, они и вокруг нас. Это различные средства бытовой химии (стиральные порошки и пятновыводители), цветочные удобрения и ядохимикаты, лаки и краски, клеи и растворители, бензин и дизельное топливо, аккумуляторные, тормозные и прочие технические жидкости, а на кухне — уксус и уксусная кислота.
Совершенно очевидно, что все вышеупомянутые вещества должны использоваться строго по назначению и в соответствии с определенными правилами, указанными на этикетке каждого средства. К сожалению, несоблюдение мер безопасности при работе с ядовитыми средствами может привести к серьезным проблемам со здоровьем: отравлению, различным повреждениям кожи и слизистых оболочек.
ВНИМАНИЕ! Обязательно запомни следующую информацию: кислоты с очень низким показателем pH (менее 2) и щелочи, pH которых выше 13, являются чрезвычайно опасными!
Кислоты и щелочи в природе
Ты уже успел убедиться в том, что вокруг нас — огромное количество кислот и щелочей. Молочные продукты, овощи и фрукты содержат лимонную, яблочную, щавелевую, уксусную, молочную, аскорбиновую и другие кислоты.
Трудно поверить, но в косточках вишен и миндаля содержится (хоть и в минимальных количествах) такой сильный яд, как синильная кислота! Известно, что многие насекомые предпочитают защищаться разными кислотами.
Никогда не задумывался, почему укусы обыкновенного крошечного муравья бывают такими болезненными? А все потому, что он вспрыскивает в ранку капельки муравьиной кислоты. Эту же кислоту выделяют и кое-какие виды гусениц, а тропические пауки и некоторые жуки защищаются от врагов при помощи уксусной и серной кислот.
ОСТОРОЖНО! Как правило, концентрированные кислоты и щелочи есть во всех школьных каби нетаххимии, и пользоваться ими можно только под руководством учителя
Применение щелочей
Щелочи широко применяются в различных отраслях промышленности, медицине и быту. Например, каустическая сода используется для растворения жиров и входит в состав многих моющих средств, применяется при производстве целлюлозы, масел, дизельного топлива. Также щелочи используют для изготовления мыла, искусственных волокон, различных красителей и т.д.
Кислоты и щелочи в нашем организме
Для переваривания пищи организм использует желудочный сок, в состав которого входят соляная кислота и различные ферменты. Иногда, особенно после переедания, мы можем почувствовать боль в желудке.
Чаще всего для снятия неприятных ощущений достаточно принять антацидный, или противокислотный, препарат, основное действие которого направлено на нейтрализацию соляной кислоты в желудке.
Как правило, все антациды — щелочи, и именно они нейтрализуют повышенную активность кислот.
Действие антацидных препаратов
ссылкой
Основные свойства кислот
Действие растворов кислот на индикаторы
. Практически все кислоты (кроме кремниевой) хорошо растворимы в воде. Растворы кислот в воде изменяют окраску специальных веществ — индикаторов. Именно по окраске индикаторов определяют присутствие кислоты. Индикатор лакмус окрашивается растворами кислот в красный цвет, индикатор метиловый оранжевый — тоже в красный цвет.
Взаимодействие кислот с основаниями.
Эта реакция, называется реакцией нейтрализации. Кислота реагируют с основанием с образованием соли, в которой всегда в неизменном виде обнаруживается кислотный остаток. Вторым продуктом реакции нейтрализации обязательно является вода.
Взаимодействие кислот с основными оксидами.
Поскольку основные оксиды — ближайшие родственники оснований — с ними кислоты также вступают в реакции нейтрализации. Как и в случае реакций с основаниями, с основными оксидами кислоты образуют соль и воду. Соль содержит кислотный остаток той кислоты, которая использовалась в реакции нейтрализации. В реакции с основными оксидами кислоты образуют соль и воду. Соль содержит кислотный остаток той кислоты, которая использовалась в реакции нейтрализации.
Например, фосфорную кислоту используют для очистки железа от ржавчины (оксидов железа). Фосфорная кислота, убирая с поверхности металла его оксид, с самим железом реагирует очень медленно. Оксид железа превращается в растворимую соль FePO4, которую смывают водой вместе с остатками кислоты.
Взаимодействие кислот с металлами.
Металл должен быть достаточно активным (реакционноспособным) по отношению к кислотам. Например, золото, серебро, медь, ртуть и некоторые другие металлы с выделением водорода с кислотами не реагируют. Такие металлы как натрий, кальций, цинк — напротив — реагируют очень активно с выделением газообразного водорода и большого количества тепла.
Основания и щелочи
Основание — это соединение, химически противоположное кислоте. Щелочью называется основание, растворимое в воде. Смешиваясь с кислотой, основание нейтрализует её свойства, и продуктом реакции является соль. Зубная паста — основание, нейтрализующее кислоту, оставшуюся во рту после приема пищи. Бытовые жидкие очистители содержат щелочи растворяющие грязь. Желудочные таблетки содержат щелочи, нейтрализующие обращающуюся при несварении желудка кислоту. С точки зрения химии основания — это вещества, способные присоединять ионы водорода (Н+) из кислоты. Ион оксида (О2-) и ион гидроксида (ОН—) могут соединяться с ионами водорода в кислоте. Значит, оксиды металлов, например оксид магния, и гидроксиды металлов, например гидроксид натрия (едкий натр), являются основаниями. Гидроксид натрия (NаОН) состоит из натрия, кислорода и водорода. Гидроксид магния (Мg(ОН)2) состоит из магния, кислорода и водорода.
Многие основания и щёлочи — очень едкие вещества и потому опасны: они разъедают живые ткани. Жидкие очистители содержат щелочи, растворяющие грязь. В бумажной промышленности гидроксид натрия растворяет древесную смолу и освобождает волокна целлюлозы, из которых производится бумага. Гидроксид натрия (едкий натр) используется в чистящих жидкостях, а также (как и гидроксид калия) для производства мыла. Мыло — это соль, образующаяся при реакции щелочей с кислотами растительных жиров. Жало осы выпускает щелочь, которую можно нейтрализовать кислотой, например уксусом.
Каковы преимущества уксуса?
Хотя уксус не повлияет на ваш рН, регулярное употребление может принести пользу.
Вот некоторые преимущества уксуса:
- Он может убивать вредные бактерии: кислотные свойства уксуса делают его отличным средством для чистки и дезинфекции. Он также используется в качестве натурального пищевого консерванта для предотвращения порчи пищи бактериями, такими как E.coli ().
- Болезни сердца могут снизить факторы риска: некоторые исследования на животных показали, что уксус может снизить кровяное давление, холестерин, триглицериды и другие факторы риска сердечных заболеваний (, ).
- Это может повысить чувствительность к инсулину: было показано, что уксус повышает чувствительность к инсулину и снижает уровень сахара в крови у людей с диабетом 2 типа (, ).
- Может способствовать потере веса: исследования показали, что уксус, включая яблочный уксус, может помочь в потере веса, уменьшая голод и потребление калорий (, ).
Уксус уменьшает потребление калорий и голод, облегчая тем, кто хочет похудеть. «Так что еще я могу сделать, чтобы похудеть?» Если вы считаете, что, возможно, захотите взглянуть на онлайн-списки диет, составленные нашими онлайн-диетологами. Если вы считаете, что различные диеты и средства для похудения не работают, вы можете получить доступ к онлайн-списку диет, составленному онлайн-диетологами с соответствующей платой онлайн-диеты (Давай Худеть!).
Буферные системы обеспечивают кислотно-щелочной баланс
Внутри большинства клеток и в окружающей клетки и ткани жидкостях многоклеточных организмов pH достаточно близки к нейтральным т.е. равны приблизительно 7. Большинство ферментов очень чувствительны к показателю pH среды
Даже небольшое изменение водородной концентрации может нарушить форму и изменить деятельность ферментов, поэтому важно, чтобы кислотность и щёлочность внутренней среды организма постоянно поддерживалась на одном уровне
Однако химические реакции постоянно производят внутри клетки кислоты и основания. Кислоты:
- соляная – секретируется клетками желудка;
- серная – образуется при окислении белков;
- угольная – конечный продукт окисления углеводов, липидов и белков;
- молочная – образуется в мышечных клетках во время выполнения тяжёлой работы.
Основания: мочевина, аммиак, креатин и др.
Кроме того, многие животные и люди питаются продуктами с кислой или щелочной реакцией. Напиток «кола» даже в разбавленном виде – сильно кислое вещество. Несмотря на это, в нашем теле концентрация ионов H+ и OH – постоянно поддерживается на одном уровне. Кислотность и щёлочность среды регулируют буферные системы.
Буферные растворы – это вещества, которые сопротивляются изменению pH. Их работа заключается в высвобождении ионов водорода, когда их недостаточно, и их поглощении при повышении кислотности. Внутри организмов буферные системы обычно состоят из пары субстанций – кислоты и щёлочи.
Особенно чувствительна к изменению кислотности наша кровь, в норме её рН = 7,4±0,05. При ацидозе человеческая рН крови падает до 7,1. Если кислотность не восстановится сразу, это может стать причиной гибели. Так же опасен и обратный процесс – увеличение водородного показателя крови, называемый алкалозом.
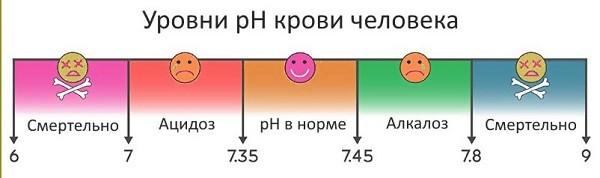
Кровь включает в себя все буферные системы, встречающиеся в организме человека:
- гидрокарбонатную (бикарбонатную),
- фосфатную,
- белковую, (включая гемоглобиновую и оксигемоглобиновую, т.е. эритроцитную).
Бикарбонатная буферная система регулирует кислотность и щёлочность среды
Рассмотрим действие этих систем на примере бикарбонатной буферной системы. Она состоит из угольной кислоты (H2CO3) и гидрокарбоната натрия (NaHCO3). Эти вещества взаимодействуют в паре обратимой реакции. Во-первых, двуокись углерода (CO2) и H2O соединяются с образованием углекислоты (H2O3), которая во второй реакции диссоциирует с выходом бикарбонат-иона (HCO3 –) и H +.
Если какая-то кислота или другое вещество добавляет H + в кровь, НСО3 – выступает в качестве базы и удаляет избыток Н+, образуя Н2СО3. Аналогично, если основное вещество удаляет H + из крови, H2CO3 диссоциирует, высвобождая больше ионов H + в кровь. Таким образом, эта система стабилизирует рН крови.
H2O + CO2 H2CO3 HCO3— + H+
Реакция воды с углекислым газом важна для организмов, обитающих в воде, так как в результате углерод из воздуха попадает в воду.