Теломеры
Содержание:
- Методы детекции хромосомных перестроек
- Как вырастить мышь-долгожителя
- Функции концевых участков хромосом
- Страж генома
- Строение
- Теломеры: какие факторы определяют их длину
- Гены
- Тренируйте свои теломеры
- Роль теломер в старении
- Возможно ли защитить или удлинить теломеры и продлить жизнь?
- О молекулярных механизмах старения клеток
- Теломеры на диете
- Вечно молодые
Методы детекции хромосомных перестроек
Хромосомные перестройки впервые были обнаружены у дрозофил при помощи генетического анализа. В некоторых скрещиваниях соотношение числа потомков в разных классах сильно отличалось от ожидаемого, и это объяснили наличием перестроек в хромосомах родителей. Делеции, дупликации и транслокации обнаружил К. Бриджес в 1916, 1919 и 1923 годах, соответственно. Первую инверсию описал Алфред Стёртевант в 1921 году, сравнивая порядок генов в хромосоме 3 у D. melanogaster и D. simulans.
Первые цитологические наблюдения хромосомных перестроек были сделаны на политенных хромосомах слюнных желез дрозофилы. Лишь спустя некоторое время хромосомные перестройки были показаны на митотических хромосомах.
Цитологически хромосомные перестройки могут быть выявлены также в профазе первого деления мейоза на стадии пахитены благодаря синапсису гомологичных участков хромосом. Подобный анализ был впервые проведён Барбарой Мак-Клинток в 1930 году при изучении транслокации у кукурузы.
В медицинской генетике хромосомные перестройки выявляют и анализируют при помощи цитогенетических методов, наиболее часто анализ хромосомных перестроек проводят цитологически на стадии метафазы. Самым распространенным и доступным цитогенетическим методом является метод дифференциальной G-окраски хромосом (G-бэндинг). С конца 1980-х годов для выявления хромосомных перестроек применяют метод флуоресцентной гибридизации in situ с использованием ДНК-проб к отдельным хромосомам или хромосомным локусам.
Одним из наиболее точных методов обнаружения небольших дупликаций и делеций в настоящее время является метод сравнительной геномной гибридизации на препаратах метафазных хромосом или ДНК-микрочипах. Дупликации и делеции могут быть выявлены и при полногеномном SNP-генотипировании. Следует отметить, что два последних метода не позволяют выявлять сбалансированные хромосомные перестройки и, в отличие от других цитогенетических методов, не позволяют проводить анализ хромосомных аберраций на уровне отдельной клетки, то есть являются нечувствительными для случаев мозаицизма.
Как вырастить мышь-долгожителя
В конце 1990-х биологи вывели генетически модифицированные породы мышей, чтобы детально изучить свойства теломеразы. Грызуны, у которых она от рождения не работала, имели множество проблем с внутренними органами и старели значительно раньше обычных животных. С другой стороны, у них возникало меньше злокачественных опухолей. Другие мыши, которые от рождения имели чрезмерно активную теломеразу, чаще болели раком. И тоже жили меньше обычного. Почему? Дело в том, что раковые клетки научились включать ген теломеразы гораздо раньше учёных и пользуются этим для того, чтобы делиться бесконечно. Таким образом, в организме мыши с выключенной теломеразой раковой опухоли гораздо сложнее появиться, чем у животного с активно работающим ферментом.
 Основой будущей технологической революции станут нейронные сети
Основой будущей технологической революции станут нейронные сети
Ещё один интересный эксперимент провели на породе мышей, от рождения склонных к раку: опухоли вырастают у них очень легко, почти не встречая сопротивления со стороны организма. Биологи отключили у этих мышек теломеразу в надежде, что они будут меньше болеть раком. Результат оказался противоположным: без фермента грызуны покрылись опухолями значительно раньше, чем их сородичи.
Не совсем понятно, почему это происходит. Одна из версий заключается в том, что, если теломераза не работает, стволовые клетки теряют свои теломеры и стареют. А ведь из стволовых клеток получаются клетки иммунной системы, наши главные защитники от опухолей. Из старых стволовых клеток борцы с раком выходят так себе. Другая версия состоит в том, что, как только молекулы ДНК лишаются теломер и оголяют свои концы, клетка хочет как-нибудь их соединить. Но склеивать случайные молекулы ДНК — не самая лучшая идея, это приводит к мутациям и повышает вероятность рака.
Что будет с человеком, если отключить его теломеразу? Такой эксперимент, понятное дело, не поставишь, но можно изучить болезни, связанные с неправильной работой фермента. Одна из них называется врождённый дискератоз. Он проявляется в преждевременном старении: у больных рано седеют волосы и выпадают зубы, они часто болеют раком и редко доживают до 50 лет.
Функции концевых участков хромосом
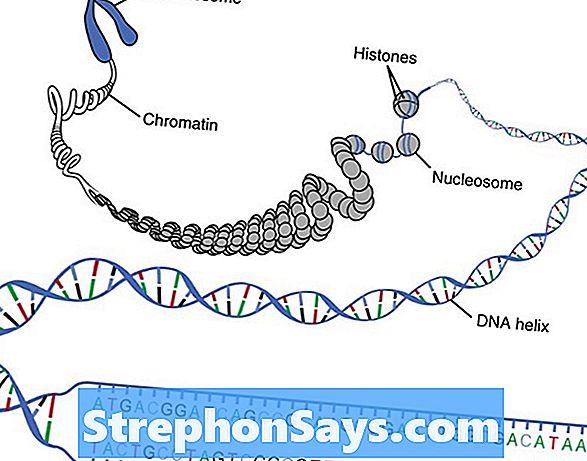
В каждую клетку человеческого организма встроен счетчик, который отсчитывает срок ее жизни – теломер. Это маленький кусочек ДНК, который крепится «колпачком» на конце хромосомы и не несет никакой генетической информации. У теломера единственная функция: защищать хромосому от «изнашивания».
Фермент теломераза в организме
С каждым делением клетки «колпачок» становится меньше, концевой участок хромосомы укорачивается и организм начинает проявлять признаки старения.
Но у теломера есть возможность надстраиваться и удлиняться и стабилизировать хромосому. Это происходит за счет выработки особого фермента – теломеразы, который «пришивает колпачок».
Современная физиология доказала, что стимулировать концевые участки хромосомы и предупредить деградацию клеток возможно.
Например, при введении рибонуклеиновой кислоты теломераза вступает в активную фазу, и «достраивает», цепочку нуклеотидов – следовательно, предупреждает деградацию и удлиняет человеку жизнь на несколько лет.
Длина теломер и продолжительность жизни
Теломер – своеобразный индикатор долголетия, и чем он короче, тем клетка «дряхлее» и ближе к репликативному старению, т. е. к такому процессу, когда деление становится невозможным. Учеными уже доказано, что длинные теломеры у людей старше 60 лет обеспечивают хорошую работу иммунной системы и миокарда, чего нельзя сказать об их сверстниках с более короткими «колпачками».
Стареющая клетка не приводит непосредственно к какому-нибудь заболеванию. Незащищенная от износа хромосома становится слишком уязвимой, и рано или поздно наступает такой момент, когда «спящий» ген заявляет о себе.
Вывод один: если человек имеет наследственную предрасположенность к каким-либо заболеваниям, а особенно к раку, инсульту, деменции, сердечно-сосудистым патологиям или диабету, то с короткими теломерами риск болезни вступить в силу крайне высок.
Влияние на старение клеток
Исследователи в области физиологии, не упрощая научный подход и опираясь на конкретные факты, говорят, что удлинить теломер можно коррекцией образа жизни, физическими упражнениями, некоторыми продуктами и хорошим сном. Неправильное питание, вредные привычки укорачивают теломер, и следовательно, сокращают жизнь.
Также исследователи говорят о том, что искусственное, медикаментозное «удлинение» на современном этапе развития науки крайне опасно, поэтому лучший способ омоложения организма – изменение образа жизни.
Страж генома
Дисфункция теломер, которая происходит при их укорачивании либо нарушении работы шелтерина, активирует белок р53 . Этот транскрипционный фактор приводит клетку в состояние сенесценции, либо вызывает апоптоз . При отсутствии р53 развивается нестабильность хромосом, характерная для карцином человека. Мутации в белке р53 обнаруживаются в 50% аденокарцином груди и в 40–60% случаев колоректальной аденокарциномы. Поэтому p53 зачастую называют «стражем генома».
Теломераза реактивируется в большинстве опухолей эпителиального происхождения, которые характерны для пожилых людей. Считается, что реактивация теломеразы — важный этап злокачественных процессов, поскольку это позволяет раковым клеткам «не обращать внимания» на лимит Хейфлика. Дисфункция теломер способствует хромосомным слияниям и аберрациям, что в отсутствии p53 чаще всего приводит к злокачественным новообразованиям.
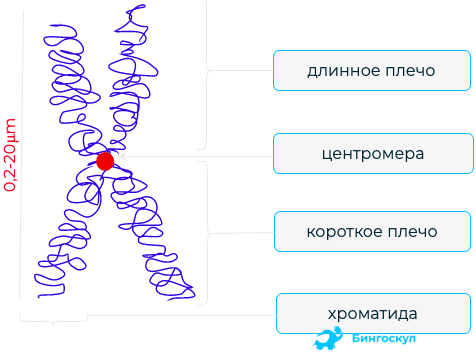
Строение
Строение человеческой теломеразы было выяснено Скоттом Коэном и его исследовательской группой в австралийском Исследовательском институте детской медицины. Теломераза состоит из теломеразной обратной транскриптазы (TERT), теломеразной РНК (hTR или TERC), и дискерина (по две молекулы каждого из этих веществ). Две субъединицы фермента кодируются двумя различными генами. Кодирующий регион для TERT имеет длину 3396 пар, TERT, таким образом, содержит 1132 аминокислоты. Этот белок сворачивается и захватывает TERC (имеющую длину 451 нуклеотид), которая не транслируется, оставаясь РНК. TERT имеет форму рукавицы, что позволяет ему закрепляться на хромосоме и добавлять в неё одноцепочечные теломерные участки.
TERT — это обратная транскриптаза, то есть фермент, создающий одноцепочечную ДНК на основе шаблонной одноцепочечной РНК. Такие ферменты (а именно — образцы, полученные из вирусов) используются исследователями в лабораторном процессе полимеразной цепной реакции обратной транскрипции (RT-PCR), при помощи которого создаются копии ДНК на основе заданного РНК-шаблона. TERT же удерживает свой собственный шаблон — TERC.
Профессор Скордалакес и его коллеги первыми выявили полный набор и строение критически важных белков в молекуле теломеразы.
Теломеры: какие факторы определяют их длину
Теломеры могут укорачиваться быстрее или медленнее. Исследования показали, какие факторы влияют на длину хромосомных наконечников.
- Стресс уменьшает размеры теломер (Элисса С. Эпель, Jue Lin, Frank H. Wilhelm и другие, 2006 г.).
- Различные недуги: ожирение (сокращает длину теломер на 240 пар нуклеотидов), резкие скачки веса из-за увлечения диетами (S. Kim, C. G. Parks, L. A. DeRoo и другие, 2009 г.), сахарный диабет, разрушение хрящевой ткани, гипертензия, ишемическая болезнь, инфекционные заболевания (в частности, заражение инфекцией Salmonella enteric), воспалительные процессы (например, язвенный колит).
- Некоторые модели мышления, отличающиеся повышенной озлобленностью, назойливыми мыслями о том, что людям нельзя доверять (L. Brydon, J. Lin, L. Butcher, M. Hamer и другие, 2012 г.), пессимизмом (A. O´Donovan, J. Lin, F. S. Dhabhar и другие), постоянным мысленным проговариванием своих проблем и подавлением нежелательных мыслей и эмоций (M. Alda, M. Puebla-Guedea, B. Rodero и другие, 2009 г.) ускоряют старение. У жизнерадостных людей теломеры длиннее. Причём, согласно исследованиям, эта разница может достигать 30 %.
- Социальный статус. Чем он ниже, тем концевые участки хромосом короче (исследователи под руководством профессора T. D. Spector из Отделения исследований близнецов и генетической эпидемиологии Больницы Святого Фомы, г. Лондон).
- Брак. Люди, не состоящие в браке и не имеющие постоянного партнёра, имеют теломеры меньших размеров. Правда, если брак сопряжён с регулярным семейным насилием, наконечники также будут короткими из-за влияния стресса (Элизабет Блэкберн).
- Физическая активность (специалисты Колорадского университета, 2010 г.). Теломеры у активных людей на 200 пар нуклеотидов длиннее, чем у тех, кто ведёт сидячий образ жизни.
- Курение. Одна пачка сигарет, выкуриваемая изо дня в день в течение года, укорачивает хромосомные наконечники на 5 пар нуклеотидов. Степень их повреждения соответствует 11 годам клеточного старения (A. R. Zota, B. L. Needham, E. H. Blackburn и другие, 1999–2002 гг.).
- Сладкая газированная вода. Ежедневное употребление 2 банок напитка ускоряет старение на 4,6 лет (C. W. Leung, B. A. Laraia, B. L. Needham, 2014 г.).
- Уровень липидов в крови. Чем их меньше, тем теломеры длиннее.
- Присутствие в организме большого количества свободных радикалов (Packer, Fuehr, 1977 г., Zglinicki и другие, 1995 г., Chen, Ames, 1994 г.).
- Скудный рацион питания. Дефицит омега-3 жирных кислот (R. Farzaneh-Far, J. Lin, E. S. Epel и другие, 2010 г.), минералов и витаминов в организме, особенно фолиевой кислоты, магния, цинка, витаминов С, Е, К, В6, В12, D укорачивает длину концевых участков хромосом на 5 % (это составляет 350 пар нуклеотидов). Аналогичным действием обладает употребление технологически переработанного мяса – копчёного, вяленого, солёного, а также колбас, сосисок, ветчины, солонины (J. A. Nettleton, A. Diez-Roux, N. S. Jenny и другие, 2008 г.).
- Грудное вскармливание. Дети, которые в первые 4-6 недель своей жизни питаются исключительно молоком матери, имеют теломеры на 5 % длиннее, чем у сверстников-искусственников (Wojcicki и другие, 2016 г.).
- Роды. Исследователи из Университета Джоржа Мэйсона (США) под руководством Анны Поллак установили: чем большее количество раз женщина рожала, тем короче защитные колпачки на её хромосомах. Рождение одного ребёнка сокращает длину теломер на 4,2 % (это равноценно 11 годам клеточного старения), пятерых – на 12,7 %.
- Солнечные лучи. Теломеры открытых участков кожи значительно короче своих «коллег» с защищённых от ультрафиолета мест (Петра Букамп из Гейдельбергского центра исследования рака).
- Продолжительность сна. Чем дольше человек спит, тем длиннее защитные колпачки на его хромосомах. Минимальное время сна, согласно исследованиям, должно быть 7 часов (K. A. Lee, C. Gay, J. Humphreys и другие, 2014 г.).
- Некоторые компоненты краски и бытовой химии (S. Pavanello, A. C. Pesatori, L. Dioni и другие, 2010 г.).
Гены
Ниже перечислены некоторые гены, расположенные на 2-й хромосоме:
- ABCA12 — АТФ-связывающая кассета (англ. ATP-binding cassette), член 12 подсемейства A;
- ABCG5 — АТФ-связывающая кассета, член 5 подсемейства G (стеролин 1);
- ABCG8 — АТФ-связывающая кассета, член 8 подсемейства G (стеролин 2);
- AGXT — аланин-глиоксилат-аминотрансфераза;
- ALMS1 — ассоциированный с синдромом Альстрёма ген 1;
- ALS2 — ассоциированный с амиотрофическим латеральным склерозом ген 2;
- BMPR2 — рецептор костного морфогенетического белка типа II;
- CLQTL2 — холестерин уровень;
- COL3A1 — коллаген, тип III, альфа 1;
- COL4A3 — коллаген, тип IV, альфа 3;
- COL4A4 — коллаген, тип IV, альфа 4;
- COL5A2 — коллаген, тип V, альфа 2;
- GCG — глюкагон;
- HADHA — α-субъединица митохондриального трифункционального белка (англ. mitochondrial trifunctional protein);
- HADHB — β-субъединица митохондриального трифункционального белка;
- MSH2 — гомолог mutS 2 (E. coli);
- MSH6 — гомолог mutS 6 (E. coli);
- NR4A2 — ядерный рецептор (англ. nuclear receptor), член 2 группы A подсемейства 4;
- NRP2 — нейропилин 2;
- OTOF — отоферлин;
- — содержащий парный домен фактор транскрипции (англ. Pax genes) 3;
- — содержащий парный домен фактор транскрипции 8;
- PELI1 — гомолог Pellino 1 (Drosophila);
- SLC40A1 — член 1 семейства транспортеров растворённых веществ (англ. solute carrier family) 40 (ферропортин).
Плечо p
- CD8 — трансмембранный гликопротеин;
- JAGN1 — обеспечивает формирование и нормальное функционирование нейтрофильных гранулоцитов;
- LRRTM1;
- NLRC4 — содержащий нуклеотид-связывающий домен олигомеризации белок 4;
- NRXN1 — нейрексин 1, ассоциация с аутизмом;
- SDC1 — мембранный белок, протеогликан семейства синдеканов (CD138);
- SRD5A2 — 5-альфа-редуктаза 2;
- TPO — тиреоидная пероксидаза.
Плечо q
- ALPI — кишечная щелочная фосфатаза;
- AQP12A — водный канал из группы аквапоринов;
- AQP12B — водный канал из группы аквапоринов;
- DPP4 — мембранная гидролаза (CD26);
- GAD1 — ГАМК-производящий фермент глутаматдекарбоксилаза 1;
- ErbB4 — мембранный белок семейства рецептора эпидермального фактора роста EGFR/ErbB;
- IL1A, IL1B — интерлейкин 1: альфа и бета;
- IL1RN — антагонист рецептора интерлейкина 1;
- ITGA4 — гликопротеин из надсемейства интегринов;
- ITGAV — гликопротеин из надсемейства интегринов;
- ITGB6 — гликопротеин из надсемейства интегринов (β6);
- MDA5 — рецептор группы RIG-I-подобных рецепторов;
- SCN9A — ген, отвечающий за болевую чувствительность;
- SP3 — фактор транскрипции Sp3;
- TBR1 — член 1 семейства T-box (англ. T-box family);
- TTN — титин;
- VIL1 — виллин 1;
- ZNF804A — цинк-пальцевый белок 804A, ассоциированный с шизофренией.
Тренируйте свои теломеры
Внешние факторы, такие как курение, ультрафиолетовое излучение, а также глубокая депрессия приводят к накоплению излишков свободных радикалов. Когда их становится больше, чем антиоксидантов, развивается опасное состояние окислительного стресса. Но есть радостная новость, регулярные умеренные физические нагрузки улучшают баланс между свободными радикалами и антиоксидантами, способствуя здоровью клеток и удлинению наших теломер. Благодаря тренировкам повышается чувствительность организма к инсулину и поддерживается более стабильный уровень сахара в крови. Многочисленные исследования доказывают, что физкультура помогает нейтрализовать негативные последствия стресса, мы начинаем чувствовать себя гораздо спокойнее, настроение улучшается. Это происходит, потому что во время тренировки клетки надпочечников вырабатывают меньше кортизола. Если в вашей жизни много стресса, то физические упражнения не просто полезны — они вам необходимы. Не ищите отговорок, найдите время на себя. Исследования показали, что регулярные кардио и интенсивные интервальные тренировки способствуют восстановлению теломер и увеличению выработки теломеразы вдвое. Йога, пробежки на свежем воздухе и плавание также положительно сказываются на теломерах. Часто люди тренируются раз в неделю, но зато интенсивно. К сожалению, изнурительные и нерегулярные тренировки на сопротивление, наоборот, могут навредить, поскольку усиливают окислительный стресс.
View on Instagram
Роль теломер в старении
Одна теория предполагает, что процесс старения хотя бы частично связан с нашими теломерами. Теломеры — это маленькие защитные колпачки на концах молекул ДНК. Их работа заключается в том, чтобы не допустить износа концов хромосом или прилипания друг к другу, подобно пластиковым наконечникам на концах шнурков.
Теломеры также играют важную роль в обеспечении правильного копирования нашей ДНК при делении клеток, но благодаря причуде механизма репликации ДНК, несколько нуклеотидов (строительные блоки ДНК) на самом конце цепи не передаются в новую копию ДНК, что приводит к потере некоторой генетической информации; это как если бы вы ксерокопировали один и тот же документ, каждый раз отрезая последнюю строчку текста на странице. Таким образом, нити ДНК становятся короче и короче с каждым делением клетки.
Но потеря этой генетической информации не критична, ведь теломеры состоят из одной и той же последовательности шести нуклеотидов, повторяющихся снова и снова, которые при делении клетки становятся короче; это защищает важную часть ДНК, которая несет генетический код.
В яйцеклетках и сперматозоидах есть фермент, называемый теломеразой, который добавляет эти повторяющиеся последовательности в конец цепей ДНК, поэтому, теломеры в этих клетках не укорачиваются. В других клетках теломераза менее активна, что приводит к постепенному укорочению теломер со временем.
Возможно ли защитить или удлинить теломеры и продлить жизнь?
В 1998 году американские исследователи смогли преодолеть предел Хейфлика. Значение максимального укорочения теломер различно для разных типов клеток и организмов. Предел Хейфлика для большинства клеток человеческого организма составляет 52 деления. Увеличить это значение в процессе экспериментов стало возможным путем активации такого особого фермента, воздействующего на ДНК, как теломераза.
В 2009 году ученые из Стэнфордского университета были удостоены Нобелевской премии за разработку метода стимуляции теломер. Эта методика основана на применении особой молекулы РНК, несущей в себе ген TERT (обратной теломеразной транскриптазы). Она является матрицей для удлинения теломер и распадается после выполнения своей функции. Полученные клетки «омолаживаются» и начинают делиться более интенсивно, чем ранее. При этом их малигнизация, то есть превращение в злокачественные, не наступает.
Благодаря этому открытию стало возможным удлинять концы хромосом более чем на 1000 нуклеотидов (структурных единиц ДНК). Если пересчитать этот показатель на годы жизни человека, то он составит несколько лет. Такой процесс воздействия на теломеры абсолютно безопасен и не вызывает мутаций, приводящих к бесконтрольному делению и малигнизации клеток. Это объясняется тем фактом, что после введения особая молекула РНК быстро распадается и иммунитет не успевает реагировать на нее.
Ученые сделали выводы о том, что теломераза:
- защищает клетки от старения;
- продлевает жизнь клетки;
- предупреждает уменьшение длины теломер;
- создает матрицу для «достраивания» теломер;
- омолаживает клетки, возвращая их к молодому фенотипу.
Пока научные эксперименты, проводящиеся на основе теории ученых из Стэнфордского университета, выполнялись только на лабораторных мышах. В их итоге специалисты смогли затормозить старение кожи животных.
За это открытие работающая в США австралийка Элизабет Блекберн, американка Кэрол Грейдер и ее соотечественник Джек Шостак были удостоены Нобелевской премии. Ученые из Стэнфорда надеются, что созданная ими методика даст возможность в будущем лечить тяжелые заболевания (в том числе и нейродегенеративные), которые провоцируются укорочением теломер.
Питер Лэндсдорп, научный директор Европейского института биологии возраста рассказывает о роли теломер в процессах старения и образования опухолей:
О молекулярных механизмах старения клеток
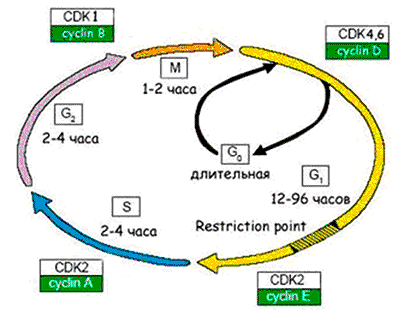
Рисунок 6. Схема клеточного цикла.
Клеточный цикл подразделяют на четыре стадии: 1. G1
(предсинтетическая) — период, когда клетка готовится к репликации ДНК. В этой стадии может произойти остановка клеточного цикла в случае обнаружения повреждений ДНК (на время репарации). Если обнаруживаются ошибки в репликации ДНК, и они не могут быть исправлены репарацией, клетка не переходит на стадию S. 2. S
(cинтетическая) — когда происходит репликация ДНК. 3. G2
(постсинтетическая) — подготовка клетки к митозу, когда происходит проверка точности репликации ДНК; если обнаружены недореплицированные фрагменты или другие нарушения в синтезе, переход на следующую стадию (митоз) не происходит. 4. М
(митоз) — формирование клеточного веретена, сегрегация (расхождение хромосом) и формирование двух дочерних клеток (собственно деление).
Чтобы были понятны молекулярные механизмы перехода клетки в состояние сенесцентности, я напомню вам, как происходит деление клетки.
Процесс размножения клеток называют пролиферацией . Время существования клетки от деления до деления именуют клеточным циклом . Процесс пролиферации регулируется как самой клеткой — аутокринными ростовыми факторами, — так и ее микроокружением — паракринными сигналами.
Активация пролиферации происходит через клеточную мембрану, в которой присутствуют рецепторы, воспринимающие митогенные сигналы — это в основном ростовые факторы и межклеточные контактные сигналы. Ростовые факторы обычно имеют пептидную природу (к настоящему времени их известно около 100). Это, например, фактор роста тромбоцитов, который участвует в тромбообразовании и заживлении ран, эпителиальный фактор роста, различные цитокины — интерлейкины, фактор некроза опухолей, колониестимулирующие факторы и т.д. После активации пролиферации клетка выходит из фазы покоя G0 и начинается клеточный цикл (рис. 6).
Клеточный цикл регулируется циклин-зависимыми киназами , разными для каждой стадии клеточного цикла. Они активируются циклинами и инактивируются рядом ингибиторов. Цель такой сложной регуляции — обеспечить синтез ДНК с как можно меньшим числом ошибок, чтобы и дочерние клетки имели абсолютно идентичный наследственный материал. Проверка правильности копирования ДНК осуществляется в четырех «контрольных точках» цикла: если обнаруживаются ошибки, то клеточный цикл останавливается, и включается репарация ДНК . Если нарушения структуры ДНК удается исправить — клеточный цикл продолжается. Если нет — клетке лучше «покончить с собой» (путем апоптоза), чтобы избежать вероятности превращения в раковую.
Молекулярные механизмы, приводящие к необратимой остановке клеточного цикла, контролируются генами-супрессорами опухолей, среди которых p53 и pRB, связанные с ингибиторами циклин-зависимых киназ. Супрессию клеточного цикла в фазе G1 осуществляет белок p53, действующий через ингибитор циклин-зависимой киназы р21. Транскрипционный фактор р53 активируется при повреждениях ДНК, и функция его заключается в удалении из пула реплицирующихся клеток тех, которые являются потенциально онкогенными (отсюда и прозвище р53 — «страж генома»). Данное представление подтверждается тем фактом, что мутации р53 обнаруживают в ~50% случаев злокачественных опохолей. Другое проявление активности р53 связано с апоптозом наиболее поврежденных клеток.
Теломеры на диете
На длину теломер влияет не то, сколько мы весим, а состояние нашего обмена веществ. В ходе исследований ученые пришли к выводу, что наши настоящие враги не показания весов, а инсулинорезистентность и брюшной жир, который повреждает клетки иммунной системы, раньше времени делая их дряхлыми. У людей, чья талия шире бедер, риск сокращения теломер в следующие пять лет возрастает на сорок процентов. Сколько бы вы ни весили, большой живот означает наличие проблем с обменом веществ. Диеты здесь не только не помогают, они способны нанести организму серьезный удар. Все мы знаем, что периодически сидя на диетах, можно сбросить вес, но потом очень быстро набрать снова. Есть исследования, утверждающие, что из тех, кто стремиться похудеть, менее чем пяти процентам удается закрепить достигнутый результат хотя бы на 5 лет. Оставшиеся 95 процентов либо вообще бросают попытки похудеть, либо то и дело продолжают их, периодически садясь на диету, худея, а потом опять поправляясь. А ведь для многих из нас такой подход стал частью образа жизни. Резкие переключения между режимами ограничения и переедания крайне серьезно вредят нашим теломерам. Люди, злоупотребляющие диетами, склонны к компульсивному перееданию, что обусловлено нарушением в работе центра удовольствия. Помешательство на калориях перегружает наш мозг, повышая уровень стресса. Люди, которые едят беззаботно, — ох, везет же им — не тратя жизнь на борьбу с желанием поесть, имеют более длинные теломеры, клетки их организма стареют гораздо медленнее. Вместо того чтобы ограничивать себя в калориях, нужно сосредоточиться на активном образе жизни и натуральных питательных продуктах.
View on Instagram
Вечно молодые
Некоторым клеткам позарез необходимо быть бессмертными. Например, стволовым — своеобразным поставщикам клеток для всего тела. Стволовая клетка может превратиться в какую угодно. Иными словами, это команда запасных, которые всегда готовы заменить выбывших из строя по причине болезни или травмы. Половым клеткам тоже надо быть бессмертными, ведь они дают начало новому человеку. Во взрослом человеке 37 200 000 000 000 клеток. Чтобы получить такое количество, самой первой оплодотворённой яйцеклетке необходимо поделиться как минимум 45 раз. В принципе, длины теломер должно на это хватить, но как быть с обновлением тканей? И будущими детьми? Получается, чтобы люди росли и растили детей, половым клеткам необходимо решить проблему укорачивания теломер.
 Как из человека стать машиной: биохакеры и мировое господство
Как из человека стать машиной: биохакеры и мировое господство
Для этого есть специальный фермент теломераза. Она удлиняет теломеры и позволяет клетке делиться бесконечно долго. О том, что такой фермент существует, догадался советский биолог Алексей Оловников ещё в 1973 году. Через 11 лет учёные из Калифорнийского университета в Беркли выделили теломеразу из клеток. И в 2009-м получили за это открытие Нобелевскую премию. Как выразился Леонард Хейфлик, «проницательное предположение Оловникова получило экспериментальное подтверждение».
Многие россияне обиделись на Нобелевский комитет, хотя сам Алексей Матвеевич не стал комментировать его решение, а некоторое время спустя выдвинул новую теорию, ещё более смелую. Он предположил, что теломеры — лишь немые свидетели старения, а вызывают его другие специальные молекулы ДНК. Их он назвал хрономерами. По версии Оловникова, хрономеры находятся в клетках мозга и постепенно укорачиваются, отсчитывая время нашей жизни. Иными словами, хрономеры — это физическое воплощение биологических часов. Самое же неординарное предположение заключается в том, что на укорачивание хрономер влияет смена фаз Луны, возможно, через её гравитационное поле. Экспериментальных подтверждений этой экстравагантной гипотезы пока нет.
— Эксперты при виде моих гипотез традиционно чешут в затылках, — говорит Алексей Оловников. Но он не отчаивается и в статьях заранее благодарит экспериментаторов, которые смогут подтвердить его теорию. Так же как учёные из Калифорнийского университета подтвердили его догадку о существовании теломеразы более 30 лет назад.

Одна из причин старения — укорачивание теломер. Теломеры — это повторяющиеся фрагменты на концах хромосом. Примерно после 50-70 делений клетки теломеры заканчиваются, клетка больше не может делиться и погибает. Фото: depositphotos.com
В конце XX века выяснилось, что активация теломеразы в отдельных клетках приводит к их бессмертию. Но что значит «активация»? Строго говоря, ген теломеразы есть во всех клетках организма, но они, как правило, не подозревают о его существовании, поскольку ген выключен. В стволовых и половых клетках он, наоборот, включён, и теломераза удлиняет теломеры при малейшей необходимости. Получается, что, искусственно включив этот ген, можно заставить теломеразу работать в любой клетке и фактически обессмертить её. Более того, с помощью определенных вирусов ген теломеразы можно встроить в любую клетку — даже ту, в которой его и в помине не было.
Это открытие заинтриговало весь мир. У учёных появился инструмент, способный делать клетки бессмертными. Можно ли обессмертить самих людей? Однозначного ответа на этот вопрос до сих пор нет, однако за годы исследований накопилось множество любопытных данных.