Crispr/cas9: что он лечит, а главное
Содержание:
- Новые способы доставки Cas9 в клетку
- Использование dCas9 в эпигенетике
- Классификация
- Портрет CRISPR
- Использование Cas9 в генной инженерии
- Уничтожение рака
- Происхождение систем класса 1
- General purpose of this site
- Происхождение систем класса 2
- Использование dCas9 для визуализации геномных последовательностей in situ
Новые способы доставки Cas9 в клетку
Основными требованиями к системе доставки Cas9 помимо высокой эффективности доставки является:
(1) конструкция синтезирующая Cas9 не должна встраиваться в геном клетки и не должна быть в клетке постоянно чтобы не мешать работе клетки и не спровоцировать иммунных реакций;
(2) средство доставки должно быть способно вместить достаточно большие по размерам фермент Cas9 или кодирующую его мРНК, а также одну или несколько направляющих РНК;
(3) оно должно быть удобно для использования в виде инъекций;
(4) такое средство вместе с Cas9 и направляющими РНК должно быть достаточно легко воспроизводимым для крупномасштабного производства лекарственного препарата для борьбы с распространенными болезнями.
Таким критериям в отличие от вирусных систем доставки, отвечают липидные наночастицы. Так, например, была создана биодеградируемая система доставки Cas9 липидной наночастицей, которая позволила после однократного введения достичь in vivo более 97 % ингибирования уровня одного из белков сыворотки крови. При этом такое однократное введение, несмотря на временный характер системы доставки и компонентов системы редактирования, приводило к долговременному ингибированию продолжавшемуся в течение 12 месяцев.
Тем не менее продолжается разработка вирусных частиц для доставки Cas9 и sgРНК. Одной из таких разработок является NanoMEDIC (nanomembrane-derived extracellular vesicles for the delivery of macromolecular cargo) NanoMEDIC эффективно индуцировал редактирование генома в различных типах клеток человека, таких как Т-клетки, моноциты, ИПСК, корковые нейроны, полученные из ИПСК, и миогенные клетки.
Легче переносить в клетки для редактирования генома более компактные белки Cas, поскольку они могут быть упакованы в небольшие по объему средства доставки, такие как дезактивированный аденоассоциированный вирус (AAV). В качестве таких компактных белков можно использовать варианты Cas, обнаруженные в бактериофагах, например CRISPR-CasΦ, который вдвое меньше по молекулярной массе по сравнению с Cas9
Использование dCas9 в эпигенетике
Соединив инактивированную молекулу dCas9, которая связывает ДНК, но не расщепляет её, с нуклеазой FokI, удается получить нуклеазы и рестриктазы для высокоселективного разрезания ДНК. Разработан также способ избирательного эпигенетического перепрограммирования активности генов с помощью инактивированной молекулы dCas9, соединенной с ферментом, осуществляющим деметилирование ДНК. Причём такое перепрограммирование эпигенома можно проводить даже in vivo. Позднее выяснилось, что если укоротить управляющую РНК до 14-15 нуклеотидов, то молекула Cas9 теряет способность разрезать ДНК. Используя это свойство удалось создать систему для избирательной активации определённых генов in vivo и проверить её эффективность путем лечения мышей со смоделированными заболеваниями. У этого метода есть только одна проблема: обычно система CRISPR загружается в безвредный вирус, называемый аденоассоциированным вирусом (AAV), который переносит систему в клетку. Но весь белок, состоящий из dCas9 и направляющей РНК, слишком велик, чтобы поместиться в один AAV. Чтобы обойти эту проблему, исследователи загрузили dCas9 в один вирус, а управляющую РНК — в другой.
Классификация
На основе устройства эффекторных белковых комплексов системы CRISPR/Cas разделяют на два класса. В системах класса 1 эффекторный комплекс образован множеством субъединиц, в том числе несколькими белками Cas, а в системах класса 2 эффектором является один большой многодоменный белок. К сожалению, белки Cas, и даже белок Cas1 — самый эволюционно консервативный из белков Cas, — в силу разнообразия аминокислотных последовательностей и независимой эволюции не могут быть использованы для воссоздания филогении систем CRISPR/Cas .
Классы систем CRISPR/Cas подразделяются на несколько типов. К классу 1 относятся типы I, III и IV, а к классу 2 — типы II, V и VI. Деление на типы основано на устройстве эффекторных комплексов, причем в системах одного и того же типа, как правило, в состав комплекса входит особый сигнатурный белок, уникальный для систем этого типа. Типы, в свою очередь, делятся на подтипы, различающиеся особенностями строения локуса CRISPR и, в некоторых случаях, наличием уникальных белков Cas (рис. 2) .

Рисунок 2. Разнообразие систем CRISPR/Cas. а — Общая схема устройства систем классов 1 и 2. б — Схема отдельных типов систем.
, рисунок адаптирован
В системах класса 1 созревание (процессинг) crРНК катализирует сложный комплекс из белков Cas, известный как Cascade (от англ. CRISPR-associated complex for antiviral defence). Он связывается с транскриптом-предшественником crРНК (пре-crРНК) и привлекает дополнительный белок Cas6 (реже Cas5) — нуклеазу, осуществляющую процессинг .
В наиболее изученных представителях класса 2 — системах типа II — процессинг катализирует фермент, не имеющий отношения к системе CRISPR/Cas, — бактериальная РНКаза III — при участии дополнительных РНК — транс-действующих CRISPR-РНК (tracrРНК от trans-acting). tracrРНК описаны также в системах типа V класса 2. Однако в системах этого типа и типа VI пока еще не охарактеризована нуклеаза, которая осуществляет процессинг предшественника crРНК. Но известно, что она также входит в состав эффекторного комплекса, разрушающего чужеродную ДНК .
Различия между системами классов 1 и 2 становятся особенно очевидны на этапе интерференции, когда crРНК распознает свою мишень и связывается с ней. В системах типа I, относящихся к классу 1, белковый комплекс, содержащий зрелую crРНК, распознает комплементарную ей последовательность в мишени и привлекает дополнительный белок Cas — Cas3, — который обладает хеликазной активностью, благодаря чему расплетает двойную спираль ДНК-мишени, а также имеет нуклеазный домен, который разрезает мишень. В системах типа III класса 1 нуклеаза, которая разрушает молекулу-мишень, входит в состав процессирующего комплекса, причем для деградации чужеродной ДНК ей не требуется дополнительной хеликазной активности. Кроме того, в ходе работы систем типа III специальная РНКаза, ассоциированная с локусами CRISPR, разрушает еще и транскрипты, считанные с генома-мишени. В системах же класса 2 за разрушение мишени отвечают различные домены одного и того же большого эффекторного белка .
Как мы уже отмечали, восстанавливать филогенетические отношения между различными типами систем CRISPR/Cas даже по довольно консервативному белку Cas1, присутствующему во всех системах, невозможно из-за того, что системы CRISPR/Cas разных типов и подтипов часто обмениваются друг с другом своими эффекторными модулями. Особенно ярко эта особенность прослеживается в тех подтипах систем III типа, которые работают с РНК-мишенями и потому включают в себя обратную транскриптазу. Они часто обмениваются эффекторными модулями с системами других подтипов III типа. Вероятно, такой обмен служит своего рода ответом на постоянно повышающееся разнообразие быстро эволюционирующих вирусов. Обмен эффекторными модулями также помогает защититься от белков анти-CRISPR (Acr) , которыми обзавелись многие бактериофаги .
Подробнее о системах анти-CRISPR читайте в статье «Анти-CRISPR: ответ вирусов» .
В случае многих типов систем CRISPR/Cas эволюция защитных функций приводила к их вовлечению в другие процессы, не связанные с адаптивным иммунитетом . «Биомолекула» уже писала о нескольких любопытных примерах участия систем CRISPR/Cas в процессах, не связанных с защитой от вирусов и мобильных генетических элементов .
Портрет CRISPR
Впервые повторяющиеся последовательности равной длины, перемежающиеся уникальными участками, были описаны в 1987 г. в геноме основного модельного организма микробиологии и молекулярной биологии — кишечной палочки (Escherichia coli) . Позже похожие структуры нашли и у многих других прокариот: как у филогенетически очень далеких друг от друга видов бактерий, так и у архей. Среди них, например, архея Haloferax mediterranei, живущая в очень соленой воде Мертвого и Средиземного морей; цианобактерии рода Anabaena; патогенные бактерии Mycobacterium tuberculosis — возбудитель туберкулеза; Streptococcus pyogenes, вызывающая различные заболевания — от ангины до воспалений кожи и мышц у человека и других млекопитающих . CRISPR-структуры были найдены у 45% всех известных бактерий и 85% архей . В геномах эукариот и вирусов ничего подобного обнаружено не было. Со временем стало понятно, что CRISPR — это сложная многокомпонентная система, а повторы — только малая часть «айсберга». Из чего же состоит этот айсберг?
В первую очередь — из кассет, содержащих повторы и спейсеры. Число составных звеньев в CRISPR-кассете может варьировать от двух до нескольких сотен. Пока рекордсменом в этом признана морская протеобактерия Haliangium ochraceum с 587 спейсерами в кассете . Часто в геномах встречается более одной кассеты. Больше всего их обнаружено в ДНК метаногенной термофильной археи Methanocaldococcus jannaschii — 18 кассет занимают почти 1% ее генома.
СRISPR-структуры чаще располагаются на основной хромосоме (нуклеоиде), но иногда входят в состав плазмид (маленьких кольцевых, автономно реплицирующихся молекул ДНК). Повторы в кассете, как правило, строго совпадают между собой по длине и последовательности нуклеотидов. Лишь последний повтор иногда отличается от канонической последовательности остальных, да и то лишь в нескольких концевых позициях.
Для повторов характерна частичная диадная симметрия — участки последовательности в начале и в конце повтора обратно комплементарны. Благодаря этому концы палиндромных повторов могут взаимодействовать и образовывать устойчивые вторичные структуры, прежде всего шпильки.
Спейсеры в кассете часто равны по длине, но отличаются по последовательности нуклеотидов. Наборы спейсеров у штаммов одного вида тоже могут сильно различаться. Благодаря высокой вариабельности, задолго до того, как выяснилась роль CRISPR в клетках прокариот, их стали использовать для быстрого типирования штаммов известных бактерий: возбудителей чумы (Yersinia pestis) , дифтерии (Corynebacterium diphtheriae) , гастроэнтерита (Campylobacter jejuni) , а также уже упоминавшихся Mycobacterium tuberculosis и Streptococcus pyogenes .
Чередующиеся повторы и спейсеры образуют «тело» CRISPR-кассеты. «Головой» служит лидерная последовательность; она задает направление транскрипции кассеты (рис. 1). Средняя длина лидерной последовательности около 400 пар нуклеотидов; она не содержит открытых рамок считывания, т.е. не кодирует белки.
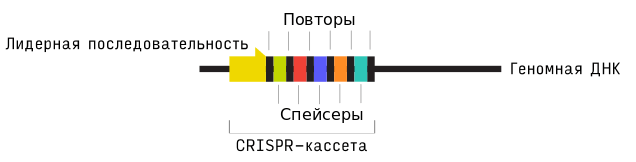
Рисунок 1. Структура CRISPR-кассеты.
Лидерные последовательности отличаются высоким содержание аденина (A) и тимина (T). Уотсон-криковская пара A-Т удерживается только двумя водородными связями, а G-С — тремя, поэтому двухцепочечную ДНК в AT-богатых участках легче расплести и превратить в одноцепочечную. В AT-богатых регионах малая бороздка ДНК более узкая — такая топология служит характерным местом посадки для многих белков, взаимодействующих с ДНК. AT-богатые участки часто встречаются в регуляторных последовательностях и точках начала репликации. Предполагают, что лидерная последовательность регулирует транскрипцию CRISPR-кассеты, а значит и функционирование всей системы . Для некоторых организмов промоторы в лидерной последовательности обнаружены экспериментально.
Спейсеры, повторы, лидерная последовательность: таков обобщенный портрет геномной CRISPR-структуры (рис. 1). Но можно ли, глядя на него, предположить какую роль эта структура играет в клетке? С момента открытия CRISPR-кассет возникло несколько гипотез о её функции.
Использование Cas9 в генной инженерии
Кроме изначальной функции в бактериальном иммунитете, белок Cas9 активно используют для создания точечных разрывов в двойной спирали ДНК, такие разрывы могут приводить к инактивации генов или созданию гетерологичных генов посредством соединения негомологичных концов и соответствующей гомологичной рекомбинации. Вместе с белками ZFN и TALEN, Cas9 становится значимым инструментом редактирования генома. Более того, создана технология, позволяющая вносить точечную мутацию не разрезая цепь ДНК, а путём преобразования одного нуклеотидного основания в другое.
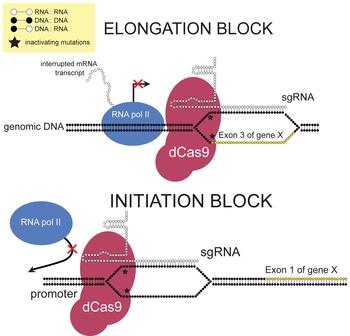 Механизм избирательного ингибирования транскрипции с помощью dCas9 путём стерического препятствия
Механизм избирательного ингибирования транскрипции с помощью dCas9 путём стерического препятствия
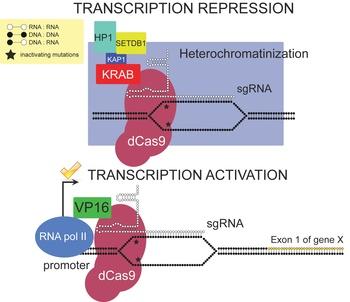 Варианты Cas9, которые связываются с ДНК, но не расщепляют её могут быть использованы для создания для избирательного регулирования транскрипционной активации и репрессии
Варианты Cas9, которые связываются с ДНК, но не расщепляют её могут быть использованы для создания для избирательного регулирования транскрипционной активации и репрессии
К 2012 году Cas9 приобрёл популярность, потому что он позволяет расщеплять практически любую нуклеотидную последовательность, комплементарную управляющей РНК. Поскольку избирательность Cas9 является следствием комплементарности управляющей РНК и ДНК, а не модификации самого белка (в отличие от случаев TALEN и ZFN), для новых ДНК-мишеней возможна выработка специфических Cas9. Варианты Cas9, которые связывают ДНК, но не расщепляют её (dCas9), могут быть использованы для доставки транскрипционных активаторов или репрессоров к специфичным последовательностям ДНК с целью регулирования транскрипционной активации и репрессии. Хотя природный Cas9 требует составления управляющей РНК из двух в корне различных РНК — CRISPR-РНК (crRNA), и транс-активационную РНК (tracrRNA), нацеливание Cas9 было упрощено при помощи выработки единой химерной управляющей РНК. Предполагается, что Cas9 можно будет использовать для изменения генома целых популяций организмов. В 2015 году посредством Cas9 впервые был модифицирован геном человеческого эмбриона. Разработана технология иммуногеномной инженерии гибридом, позволяющая быстро перепрограммировать специфичность их антител с помощью Cas9.
Создана технология, которая позволяет редактировать отдельные «буквы» ДНК и РНК, что позволит лечить врожденные заболевания, вызванные точечными мутациями. Используя цитидин-деаминазы или же аденозин-деаминазы соединенные с dCas9 можно выключить экспрессию (путем введения преждевременных стоп-кодонов) или поменять сплайсинг необходимые для синтеза тех или иных белков
Создана технология MAGESTIC (multiplexed accurate genome editing with short, trackable, integrated cellular barcodes), которая не только расщепляет ДНК, но ещё и доставляет к месту разрыва кусок ДНК необходимый для точной замены (с помощью гибридного связывающего ДНК белка LexA-Fkh1p), что повышает точность и эффективность редактирования. Еще одним инструментом для целевой вставки ДНК может стать CRISPR-ассоциированная транспозаза CAST (CRISPR-associated transposase) цианобактерии Scytonema hofmanni. ShCAST катализирует РНК-управляемую транспозицию ДНК путем однонаправленной вставки ниже протоспейсера сегментов ДНК размером в 60-66 пар нуклеотидов .
Уничтожение рака
Редактирование генов человека с помощью CRISPR по-прежнему является очень противоречивым. Однако, эта технология может улучшить иммунотерапию рака и даже вырезать гены, вызывающие раковые клетки, прежде чем они начнут наносить смертельный ущерб человеческому телу.
В 2016 году Национальные институты здравоохранения начали исследование по уничтожению трех различных видов рака на людях через технологию редактирования генов CRISPR. Проект получил поддержку интернет-миллиардера Шона Паркера (Sean Parker) и был возглавлен опытными учеными из Университета Пенсильвании.
Результаты исследования станут известны не скоро, поскольку проект все еще ждет одобрения со стороны FDA (Управление по контролю за качеством пищевых продуктов и лекарственных препаратов).
Происхождение систем класса 1
Хотя аминокислотные последовательности эффекторных белков типов I и III класса 1 мало похожи, можно не сомневаться, что эффекторные комплексы этих систем имеют общее происхождение. Их пространственные структуры поразительно похожи, и в обоих случаях структурная основа эффекторного комплекса образована несколькими копиями белка Cas7 (рис. 3). Также комплексы содержат белок Cas5, приходящийся дальним родственником белку Cas7, и так называемые малую и большую субъединицы. Малые субъединицы очень близки структурно и сходны с C-концевым доменом белка Cas10. В системах I типа роль большой субъединицы исполняет белок Cas8, аминокислотная последовательность которого высоко вариабельна даже в пределах систем различных подтипов типа I. В системах III типа большая субъединица представлена белком Cas10, который содержит два РНК-связывающих домена, причем один из них очень похож на домен-«ладонь», имеющийся у многих РНК- и ДНК-полимераз. Отметим, что Cas8 структурно лишь отдаленно напоминает белок Cas10, однако общность структурной организации и наличие опорного элемента из белков Cas5 и Cas7 почти не оставляет сомнений, что системы I и III типов класса 1 произошли от одного предка. Любопытно, что на долю этих типов приходится около 90% всех идентифицированных систем CRISPR/Cas и почти 100% этих систем у архей .
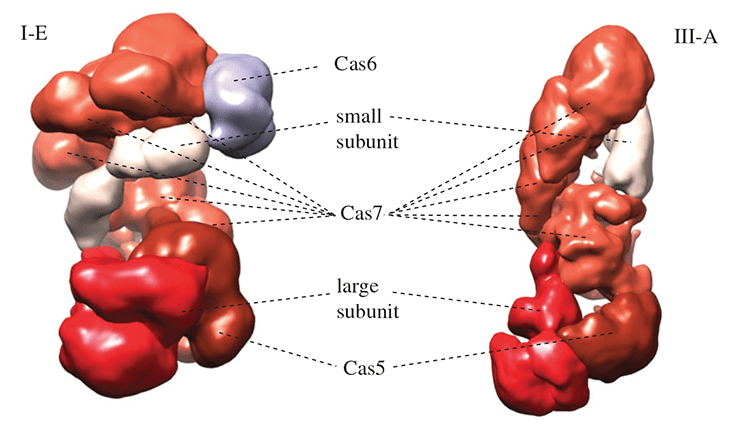
Рисунок 3. Сравнение строения эффекторных комплексов систем I и III типов класса 1
Стоит отметить, что распознавание мишени системами III типа запускает полимеразную активность белка Cas10, который начинает производить циклические олиго-(А)-нуклеотиды (cOA). Большинство систем CRISPR/Cas III типа включает ряд белков, которые не относятся к числу белков Cas, но необходимы для функционирования системы. Таковыми являются, в частности, белки Csm6 и Csx1. Csm6 связывает cOA, за счет чего активируется его РНКазный домен, который разрушает и РНК-мишень (напомним, многие системы CRISPR/Cas III типа действуют на РНК, а не на ДНК), и другие молекулы РНК, «подвернувшиеся под руку». Следствием такого массового неспецифического разрушения РНК является или переход клетки в состояние покоя, или ее программируемая гибель. Оба этих варианта предотвращают дальнейшее распространение вируса по бактериальной колонии и массовую гибель других бактериальных клеток .
Так как последствием активации пути Cas10—cOA может стать программируемая клеточная гибель, существует предположение, что эффекторные комплексы некоторых систем CRISPR/Cas произошли от систем ответа на стресс, которые запускали гибель клетки. Ген возможного белка, который дал эволюционное начало сигнальной системе с защитной функцией, удалось идентифицировать в геномах нескольких бактерий. Этот белок содержит единственный домен-«ладонь», гомологичный полимеразно-циклазному домену Cas10. Этот факт служит еще одним подтверждением предположения, что адаптивный иммунитет прокариот, то есть системы CRISPR/Cas, произошли от древних форм защиты бактериальных сообществ, запускавших гибель клетки или переводящих ее в состояние покоя. Системы III типа с двойной функцией — разрушение чужеродной ДНК и запуск состояния покоя или программируемой гибели клетки — считаются одними из самых сложных систем CRISPR/Cas .
Системы IV типа встречаются в основном в составе плазмид и профагов (рис. 4) и подробнее рассматриваются ниже. На данный момент достоверных сведений об их происхождении нет.

Рисунок 4. Обмен компонентами между системами CRISPR-Cas класса 1 и мобильными генетическими элементами в ходе эволюции. Условные обозначения: RT — обратная транскриптаза, TR — концевые повторы.
, рисунок адаптирован
General purpose of this site
This site provides tools to assist in the finding of CRISPRs structures in published microbial genomes or in user-submitted sequences. Importantly, this site does not focus on the genetic environment often associated with CRISPR structures, the so-called CAS (CRISPR-associated sequences) genes . The reason for this is that most CRISPR structures are not associated with CAS genes, so that CAS cannot be used as a CRISPR-finder tool. A second important aspect is that we have tried here to provide a tool which would not miss even the smallest CRISPR structures (containing a single spacer) and CRISPR which might be slightly different from canonical structures. Whereas the identification of the larger structures is relatively easy and straightforward, and has been achieved by a variety of methods, the search for the very small CRISPR is much more ambiguous. As a result, a number of very small «questionable» CRISPR are contained in the database. Many of these are not true CRISPRs, and they need to be critically investigated. It is expected that such candidates will for instance be investigated by typing multiple isolates from the same species. Larger alleles if they exist would need to be sequenced, and the CRISPR nature of the locus would then be confirmed or ruled out.
Происхождение систем класса 2
Эффекторная компонента систем класса 2 радикальным образом отличается от таковой у систем класса 1. Все эффекторные функции выполняет не сложный многобелковый комплекс, а один большой белок со многими доменами. Удивительно, но все белки-эффекторы систем класса 2 гомологичны нуклеазам, которые кодируются разнообразными мобильными генетическими элементами. Эффекторные белки систем типов II и V — Cas9 и Cas12 соответственно — имеют общий домен с эндонуклеазами семейства RuvC (RuvC-подобный домен). Собственно, этот домен — единственное, что объединяет Cas9 и Cas12: их аминокислотные последовательности совершенно различны, и эти белки, по-видимому, не гомологичны друг другу .
Если не брать в расчет белки Cas, ближайшие родственники белков Cas9 и Cas12 — это белки TnpB, также содержащие домен RuvC и принадлежащие IS-элементам семейства IS605 и их родственникам (рис. 5). Интересно, что гены tnpB — одни из самых многочисленных генов в геномах бактерий и архей. Судя по всему, Cas9, Cas12 и TnpB имеют общее эволюционное происхождение. Системы CRISPR/Cas подтипа V-U вообще не имеют генов адаптационного модуля и содержат, помимо локуса CRISPR, только несколько генов белков, гомологичных TnpB, которые, вероятнее всего, и являются эффекторными. Предполагают, что подтип V-U появился совсем недавно по эволюционным меркам и представляет собой модель предковой формы систем типов II и V .

Рисунок 5. Обмен компонентами между системами CRISPR-Cas класса 2 и мобильными генетическими элементами в ходе эволюции. Условные обозначения: HEPN — РНКаза.
, рисунок адаптирован
Появление систем II и V типов связывают со случайной вставкой TnpB-содержащих IS-элементов рядом с локусом CRISPR (рис. 5). Дальнейший ход эволюции сопровождался независимым преобразованием белков TnpB в эффекторные белки путем получения дополнительных доменов (правда, не совсем понятно, откуда: возможно, источниками дополнительных доменов стали внутренние акты дупликации и рекомбинации) .
Помимо разнообразных мобильных элементов, важную роль в эволюции систем CRISPR/Cas, по-видимому, сыграли системы токсин—антитоксин: показано, что многие белки-токсины из этих семейств родственны некоторым белкам Cas (а именно Cas2) .
Системы типа VI, подробно рассматриваемые в следующем разделе, отличаются тем, что распознают исключительно РНК-мишени. Системы этого типа почти наверняка связаны с системами токсин—антитоксин, поскольку в их белках Cas часто обнаруживают домен HEPN, имеющийся у многих белков-токсинов, действующих как РНКазы (рис. 5) .
Использование dCas9 для визуализации геномных последовательностей in situ
Исследователи разработали новый метод молекулярной визуализации с помощью РНК-направляемой эндонуклеазы CRISPR/dCas9 связанной с меткой. Технология позволила метить выбранные геномные последовательности в ядрах и хромосомах in situ. Метод назван RGEN-ISL. В отличие от классической флуоресцентной гибридизации in situ, RGEN-ISL не требует денатурации ДНК и, следовательно, обеспечивает лучшую сохранность структуры хроматина.
Аналогичную функцию выполняет генетический инструмент, названный CRISPR-HOT (CRISPR–Cas9-mediated homology-independent organoid transgenesis), для цветной маркировки определенных генов в органоидах человека.