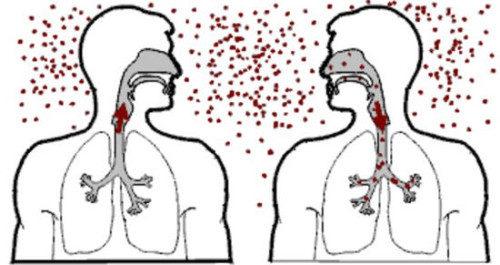
Бактерии устойчивы к антибиотикам. что делать? не принимать антибиотики
Содержание:
- Техника лабораторного исследования
- Эпидемиологические исследования АБР респираторных патогенов в РФ
- Одноклеточные атакуют
- Что будет, если…
- Высокий уровень приоритетности
- Проблема антибиотикорезистентности
- Эпидемия гонореи?
- Дисковый способ
- АБР штаммов S. pyogenes, выделенных в РФ
- Расшифровка
- Ответные меры ВОЗ
- Посев на флору
Техника лабораторного исследования
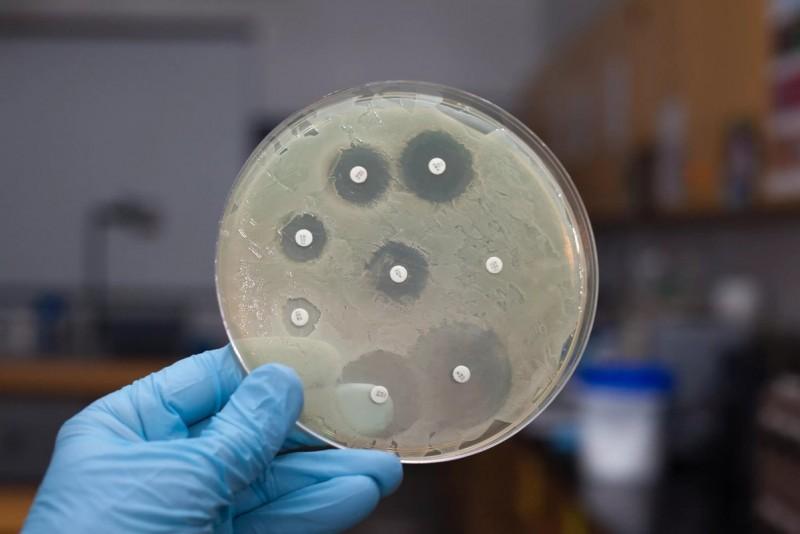
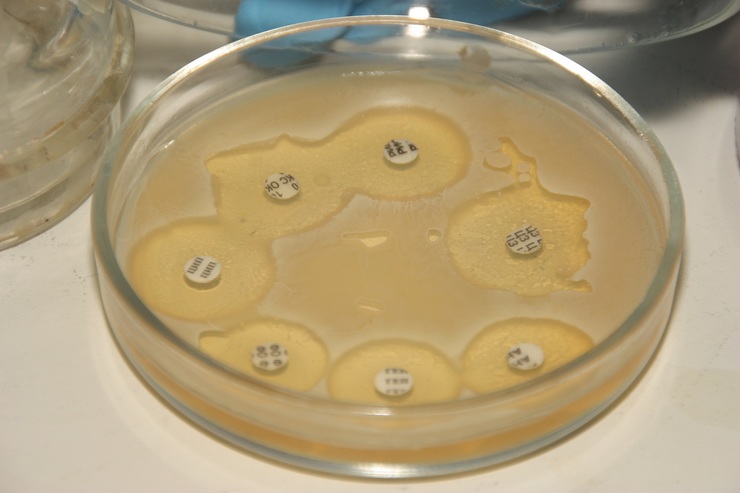
Для определения чувствительности бактерий нужно сделать посев материала на питательную среду. Используют для этого чашку Петри, куда помещают питательную среду. На поверхность кладут бумажные диски, пропитанные антибиотиками. Обычно в одну чашку помещается пять дисков. Если нужно исследовать большее количество препаратов, берут две или три чашки.
Затем на поверхность среды мазками наносят материал, который нужно исследовать. Чашки помещают в термостат — это тепловой шкаф, в котором поддерживается температура 37 градусов. Она оптимальна для выращивания бактериальных колоний. Через 24–72 часа появляются колонии микроорганизмов.
Если микроб чувствителен к антибиотику, вокруг бумажного диска роста не будет. Если же бактерия резистентна, то есть устойчива, рост будет наблюдаться даже рядом с пропитанным диском.
Как расшифровать результаты исследования, определяет врач по отметкам лаборанта в бланке
Эпидемиологические исследования АБР респираторных патогенов в РФ
Эпидемиологические исследования АБР респираторных патогенов (S. pyogenes, S. pneumoniae и H. influenzae) — проект ПеГАС — проводятся в РФ под эгидой Межрегиональной ассоциации по клинической микробиологии и антимикробной химиотерапии (МАКМАХ) и НИИ антимикробной химиотерапии с 1999 г. В отдельных этапах исследования принимали участие более 30 центров из различных городов России. Для всех неповторяющихся клинических изолятов трех вышеперечисленных видов бактерий проводилась повторная идентификация и определение чувствительности методом микроразведений с последующим анализом данных в лаборатории НИИАХ (г. Смоленск). Результаты данного исследования были представлены в центральной печати . Однако, учитывая длительный временной промежуток между сбором штаммов и подготовкой публикации к печати, что приводило к устареванию данных об АБР к моменту их опубликования, НИИАХ И МАКМАХ инициировали онлайн-проект «Карта антибиотикорезистентности России» — AMRmap (map.antibiotic.ru) , позволивший существенно сократить сроки между сбором штаммов и представлением результатов. Далее будут представлены данные анализа AMRmap о резистентности основных респираторных возбудителей за период с 2013 по 2018 г., а также других публикаций по данной проблеме за указанный период времени.

Одноклеточные атакуют
Осенью 2016 года в Нью-Йорке идёт заседание Генеральной Ассамблеи ООН, в котором участвуют представители 193 стран, то есть фактически вся планета. Обычно здесь обсуждают вопросы войны и мира. Но сейчас речь не о Сирии, а о микробах, выработавших устойчивость к лекарствам.
«Мировые лидеры продемонстрировали беспрецедентное внимание к проблеме сдерживания инфекций, устойчивых к противомикробным препаратам. Имеется в виду формирование у бактерий, вирусов, паразитов и грибков способности сопротивляться действию препаратов, которые раньше использовались для их уничтожения и лечения вызванных ими болезней
Впервые главы государств приняли на себя обязательство предпринять масштабные и координированные действия по борьбе с первопричинами развития устойчивости к противомикробным препаратам сразу в целом ряде сфер, прежде всего в сферах здравоохранения, охраны здоровья животных и сельском хозяйстве. Это лишь четвёртый в истории случай, когда вопрос здравоохранения был поднят Генеральной Ассамблеей ООН», — сообщает сайт ВОЗ.
Прогноз мрачный. «Пациентам становится всё сложнее излечиваться от инфекций, поскольку уровень устойчивости патогенных микроорганизмов к действию антибиотиков и, что ещё хуже, антибиотиков резервного ряда стабильно растёт. В сочетании с чрезвычайно медленной разработкой новых антибиотиков это повышает вероятность того, что респираторные и кожные инфекции, инфекции мочевых путей, кровотока могут стать неизлечимыми, а значит, смертельными», — поясняет доктор Недрет Эмироглу из Европейского бюро ВОЗ.
— К этому списку заболеваний я бы обязательно добавил малярию и туберкулёз. В последние годы бороться с ними становится всё труднее, поскольку возбудители приобрели устойчивость к лекарствам, — уточняет Юрий Венгеров.
Примерно о том же говорит помощник генерального директора ВОЗ по безопасности здравоохранения Кейджи Фукуда: «Антибиотики теряют эффективность, так что обычные инфекции и небольшие травмы, которые излечивались в течение многих десятилетий, сейчас снова могут убивать».

Модель бактериофага, поражающего микроба. Эти вирусы внедряются в бактерий и вызывают их лизис, то есть растворение. Хотя бактериофаги были открыты в начале XX века, только сейчас их стали включать в официальные медицинские справочники. Фото: «Кот Шрёдингера»
— Бактерии начали сопротивляться особенно рьяно, когда антибиотики стали в огромных количествах применяться в больницах и в сельском хозяйстве, — уверяет биохимик Константин Мирошников (доктор химических наук, руководитель лаборатории молекулярной биоинженерии Института биоорганической химии им. Академиков М.М. Шемякина и Ю.А. Овчинникова РАН). — Например, чтобы остановить болезни у цыплят, фермеры используют десятки тысяч тонн антибиотиков. Зачастую для профилактики, что позволяет бактериям узнать врага поближе, привыкнуть к нему и выработать устойчивость. Сейчас применение антибиотиков стали ограничивать законодательно. Считаю, что общественное обсуждение таких вопросов и дальнейшее ужесточение закона позволят замедлить рост устойчивых бактерий. Но не остановят их.
— Возможности создания новых антибиотиков почти исчерпаны, а старые выходят из строя. В какой-то момент мы окажемся бессильны перед инфекциями, — признаёт Юрий Венгеров
— Тут ещё важно понимать, что антибиотики превращаются в лекарство только тогда, когда существует доза, способная убить микробов, но при этом не навредить человеку. Вероятность найти такие вещества всё меньше и меньше
Что будет, если…
Резистентные бактерии обнаруживаются (вначале — как единичные случаи) максимум через несколько лет после появления нового антибиотика, а иногда — еще на стадии его клинических исследований. Из разработанных с 1940-х годов примерно 150 антибиотиков больше половины практически потеряли эффективность и используются на авось — как препараты первой линии. Если болезнь прорвет ее оборону, врачи отступают на вторую линию, потом — на третью. А новые и (пока!) эффективные лекарства намного дороже старых, иногда — в сто и более раз.
Опубликованный в декабре 2014 года отчет «Антибиотикорезистентность: необходимы срочные меры против кризиса ради здоровья и благосостояния населения» (Antimicrobial Resistance: Tackling a crisis for the health and wealth of nations), подготовленный по поручению премьер-министра Великобритании Дэвида Кэмерона исследовательской группой из института RAND Europe и аудиторской компанией KPMG, страшнее любого голливудского ужастика.

В 2050 году из-за лекарственной устойчивости в мире (в основном в бедных странах Африки и Азии) ежегодно будут умирать не 700 000 человек, как сейчас, а 10 млн. Прямой ущерб для мировой экономики составит в сумме $100−120 трлн, а с учетом косвенных последствий вроде роста детской и материнской смертности, опасности сепсиса после любых хирургических вмешательств и вообще разрушения современной системы здравоохранения — в два раза больше. Перед медициной встает реальная перспектива отката на полтора века назад, когда почти половина детей не доживала до года, туберкулез был смертным приговором и т. д.
Правда, сами авторы отмечают, что рассчитали пессимистический сценарий — что будет, если не принимать меры по исправлению сложившейся ситуации. А меры уже принимаются.
Высокий уровень приоритетности
- Enterococcus faecium
- Staphylococcus aureus
- Helicobacter pylori
- Campylobacter spp.
- Salmonellae
- Neisseria gonorrhoeae
Бактерии второй группы объединены по признаку повсеместного распространения, высокой социально-экономической значимости вызываемых ими заболеваний и быстрого развития резистентности к основным антибиотикам, используемым для их эрадикации, однако в резерве еще остается один или несколько эффективных препаратов.
Enterococcus faecium
E. faecium входит в состав нормальной микрофлоры кишечника, но в то же время является условно-патогенным микроорганизмом. У ослабленных больных может вызывать инфекции мочевыводящих путей, раневую инфекцию, сепсис и эндокардит. Резистентен к аминогликозидам, пенициллинам и цефалоспоринам. Беспокойство вызывает снижение чувствительности к ванкомицину — до 72 % в отдельных популяциях. Большинство штаммов E. faecium чувствительны к линезолиду, тигециклину, даптомицину.
Staphylococcus aureus
Золотистый стафилококк, колонизирующий кожу и слизистые оболочки, способен вызывать тяжелые инфекции кожи и мягких тканей, респираторные, раневые инфекции, остеомиелит, сепсис, артрит, эндокардит. Недавнее появление и распространение ванкомицин- и гликопептид-резистентных штаммов в дополнение метициллин-резистентному S. aureus значительно сужает выбор антибактериальных препаратов, однако у возбудителя сохраняется чувствительность к аминогликозидам, эритромицину, тетрациклину, ко-тримоксазолу, линезолиду.
Helicobacter pylori
Тревогу ВОЗ вызывает увеличение случаев резистентности всем известной H. pylori к кларитромицину, что сказывается на эффективности традиционных схем эрадикационной терапии, в том числе и в России. Перед эрадикацией ВОЗ рекомендует проверить чувствительность бактерии к этому антибиотику, при выявлении устойчивости — использовать схемы без него — с метронидазолом, тетрациклином или рифаксимином, а также добавлять висмута трикалия дицитрат.
Campylobacter spp.
Бактерии рода Campylobacter удерживают первое место в мире по гастроэнтеритам, которые у большинства населения планеты протекают в легкой форме, но представляют опасность для маленьких детей, беременных, стариков и иммунокомпрометированных больных. В большинстве случаев достаточно регидратации и восстановления электролитного баланса, антибактериальную терапию назначают при тяжелом течении. Проблемой является резистентность Campylobacter к фторхинолонам, основному средству борьбы с кишечной микрофлорой, и макролидам. Устойчивость к этим препаратам, впрочем, сильно варьирует от страны к стране — от менее 5 % в Финляндии до более 90 % в Индии. В Европе и России эритромицин всё еще остается препаратом выбора. По данным микробилогических исследований, в России также еще вполне актуальны фторхинолоны. В запасе для особо тяжелых случаев с осложнениями — гентамицин и карбапенемы.
Salmonellae
Представители рода сальмонелл также вызывают набор кишечных инфекций, от легкого энтерита до брюшного тифа. Большинство этих бактерий уже резистентны к бета-лактамам, аминогликозидам, тетрациклинам, хлорамфениколу и ко-тримоксазолу. Устойчивость к фторхинолонам растет во всем мире, но пока не привела к полной бесполезности этих препаратов, они остаются антибиотиками выбора, наравне с макролидами и цефалоспоринами третьего поколения. Антибактериальной терапии требуют только тяжелые случаи кишечных инфекций и, конечно, брюшной тиф и паратифы.
Neisseria gonorrhoeae
Гонорея из неприятной, но относительно легко излечимой болезни эволюционировала в глобальную медицинскую проблему. Гонококк потерял чувствительность к пенициллинам, тетрациклинам, сульфаниламидам и фторхинолонам.
Особое опасение вызывает появление и постепенное распространение штаммов, резистентных к цефалоспоринам (цефтриаксону), долгое время служивших безотказным средством борьбы с этой инфекцией. При резистентной к стандартным схемам лечения гонорее рекомендовано использовать комбинацию азитромицина с высокими дозами цефтриаксона. В России гонококк также практически резистентен к фторхинолонам, но пока сохраняет 100 %-ную чувствительность к цефтриаксону.
Проблема антибиотикорезистентности
Отсутствие эффекта от антибиотикотерапии, связанное с антибиотикорезистентностью, приводит к тому, что болезнь продолжает прогрессировать и переходит в более тяжелую форму, лечение которой становится еще более затруднительным. Особую опасность представляют случаи, когда бактериальная инфекция поражает жизненно важные органы: сердце, легкие, головной мозг, почки и т.д., ведь в этом случае промедление смерти подобно.
Вторая опасность заключается в том, что некоторые болезни при недостаточности терапии антибиотиками могут приобретать хроническое течение. Человек становится носителем усовершенствованных микроорганизмов, устойчивых к антибиотикам определенной группы. Он же теперь является источником инфекции, бороться с которой старыми методами становится бессмысленным.
Все это подталкивает фармацевтическую науку к изобретению новых, более эффективных средств с другими действующими веществами. Но процесс опять идет по кругу с развитием антибиотикорезистентности уже к новым препаратам из разряда противомикробных средств.
Если кому-то кажется, что проблема антибиотикорезистентности возникла совсем недавно, он очень ошибается. Эта проблема стара как мир. Ну, возможно не настолько, и все же лет 70-75 ей уже есть. Согласно общепринятой теории, появилась она вместе с внедрением в медицинскую практику первых антибиотиков где-то в 40-х годах ХХ столетия.
Хотя существует концепция более раннего появления проблемы резистентности микроорганизмов. До появления антибиотиков этой проблемой особо не занимались. Ведь это так естественно, что бактерии, как и другие живые существа, старались приспособиться к неблагоприятным условиям окружающей среды, делали это по-своему.
Проблема резистентности болезнетворных бактерий напомнила о себе, когда появились первые антибиотики. Правда, тогда вопрос еще не стоял так актуально. В тот период активно велись разработки различных групп антибактериальных средств, что в некотором роде было обусловлено неблагоприятной политической обстановкой в мире, военными действиями, когда бойцы умирали от ранений и сепсиса лишь потому, что им не могли оказать эффективную помощь из-за отсутствия необходимых препаратов. Просто этих препаратов еще не существовало.
Наибольшее число разработок велось в 50-60 годах ХХ столетия, и в течение 2 последующих десятилетий велось их усовершенствование. Прогресс на этом не закончился, но начиная с 80-х годов разработок в отношении антибактериальных средств стало заметно меньше. Виной ли тому большая затратность этого предприятия (разработка и выпуск нового препарата в наше время доходит уже до границы в 800 миллионов долларов) или банальное отсутствие новых идей в отношении «воинственно настроенных» активных веществ для инновационных препаратов, но в связи с этим проблема антибиотикорезистентности выходит на новый пугающий уровень.
Занимаясь разработкой перспективных АМП и создавая новые группы таких препаратов, ученые надеялись победить множественные виды бактериальной инфекции. Но все оказалось не так просто «благодаря» антибиотикорезистентности, довольно быстро развивающейся у отдельных штаммов бактерий. Энтузиазм понемногу иссякает, но проблема так и остается нерешенной долгое время.
Эпидемия гонореи?
Пример того, как социально опасная болезнь может стать неизлечимой, — современная ситуация с гонореей. Эта инфекция, передающаяся половым путем (ИППП), известна с древности, и сегодня ею в России болеют 36 человек на 100 тыс. населения. Ее возбудители — гонококки (Neisseria gonorrhoeae) вызывают гнойное воспаление мочеиспускательного канала и яичек у мужчин, маточных труб и яичников у женщин, что может привести к бесплодию и импотенции.
Проблема в том, что заболевание часто протекает бессимптомно, особенно у женщин. По статистике, средний срок обращения к врачу после заражения гонореей — полгода. Хотя специалисты советуют сдать анализы после любого незащищенного контакта с непостоянным половым партнером. Кроме того, в нашей стране до сих пор не принято в случае неприятных симптомов со стороны половых органов обращаться к врачу — многие сами назначают себе лекарства, почитав о них в интернете.
«Раньше действительно можно было принять две таблетки антибиотика фторхинолоновых групп и вылечиться от гонореи, — говорит Михаил Гомберг, главный научный сотрудник Московского научно-практического центра дерматовенерологии и косметологии. — Но по данным мониторинга резистентности гонококка к разным антибиотикам целые группы антибиотиков больше не могут быть рекомендованы для лечения, в том числе фторхинолоны, пенициллин, макролиды. Возможность посоветоваться с другом, а потом пойти в аптеку и купить лекарство привела к тому, что гонорея перестала излечиваться. Речь идет о грядущей эпидемии гонококковой инфекции».
Это мировая тенденция: в Китае за 5 лет — с 1996 по 2001 гг. — устойчивость гонококка к антибиотикам увеличилась с 17 до 70%. Специалисты по ИППП говорят, что для лечения гонореи остается одна группа действующих препаратов — цефалоспорины, но и их уже нельзя использовать как монопрепарат, а надо комбинировать с другим антибиотиком. Рекомендации по лечению гонореи меняются буквально каждые несколько лет, и только врач знает, что именно эффективно в данный момент.
Что могут сделать пациенты?
Использовать антибиотики только в случае их назначения дипломированным медицинским специалистом.
Всегда доводить до конца полный курс лечения, даже если самочувствие уже улучшилось.
Не делиться антибиотиками с другими людьми и не использовать оставшиеся антибиотики, назначенные ранее.Что могут сделать врачи и фармацевты?
Заниматься профилактикой инфекционных заболеваний.
Назначать и отпускать антибиотики только когда они действительно необходимы.
Назначать и отпускать правильные препараты для лечения болезни.
Дисковый способ
Распространенный и простой способ определения типа бактериальной микрофлоры. Исследуемый материал размещают в чаше Петри по всей поверхности, помещают небольшие картонные диски, смоченные в определенном виде антибиотика. После чашу плотно закрывают и устанавливают в термостат при температуре человеческого тела на 12 часов.
Бакпосев мочи назначается при подозрении на инфекции мочеполовых путей и урогенитального тракта
Под воздействием диффузных процессов антибактериального препарата формируется зона подавления патогенной микрофлоры. По окончанию анализа производят замер диаметра выявленной зоны подавления.
АБР штаммов S. pyogenes, выделенных в РФ
За период с 2013 по 2018 г. был собран и протестирован 601 штамм S. pyogenes, выделенный при инфекциях дыхательных путей и ЛОР-органов в 14 городах РФ. Все изоляты β-гемолитического стрептококка серогруппы А (БГСА) были чувствительны к пенициллину (и ко всем другим β-лактамным антибиотикам), к ванкомицину и линезолиду (рис. 1). Максимальная резистентность была отмечена к препаратам тетрациклинового ряда (15% нечувствительных штаммов) и к макролидам (около 11% штаммов, нечувствительных к эритромицину). Примечательно, что линкосамиды (клиндамицин) сохраняли активность против 98,5% выделенных штаммов, что косвенно свидетельствует о распространенности М-фенотипа резистентности к макролидам (эффлюкс). В то же время в публикации об уровне АБР S. pyogenes, выделенных у детей в Москве в 2013–2015 гг., общий уровень резистентности к макролидам составил 13%, при этом у 10 макролидрезистентных штаммов БГСА определяли механизмы устойчивости к АБП группы макролидов-линкосамидов-стрептограминов (MLS); все эти изоляты оказались устойчивыми ко всем макролидам и линкозамидам (MLS-фенотип резистентности) .

По сравнению с данными проекта ПеГАС за период с 1999 по 2009 г. , когда устойчивость БГСА к эритромицину составляла 3%, и данными исследования CERBERUS 2008–2012 гг. , в котором уровень резистентности к макролидам у пиогенного стрептококка составил 8,6%, в последние годы отмечается постепенное увеличение резистентности S. pyogenes к макролидам, что требует динамического наблюдения за данным показателем.
Расшифровка
Результат исследования несет в себе два главных значения:
- Во-первых, это наличие определенной бактерии.
- Во-вторых, ее концентрация в организме. Не обязательно быть специалистом, чтобы расшифровать полученные данные.
Выделяют 4 степени роста микроорганизмов в организме:
- Первая и вторая степени ничем не угрожают. Они говорят о наличии до 10 колоний бактерий. Но эти показания свидетельствуют не о диагнозе, а о загрязнении самого материала.
- Третья (до 100 колоний) и четвертая (больше 100 колоний) степени уже указывают на проблему. Количество колоний – это важный показатель, так как по нему ставят степень диагноза.
Ответные меры ВОЗ
Решение проблемы устойчивости к антибиотикам является для ВОЗ важным приоритетом. В мае 2015 г. Всемирная ассамблея здравоохранения утвердила Глобальный план действий по устойчивости к противомикробным препаратам, включающий и устойчивость к антибиотикам. Глобальный план действий направлен на обеспечение профилактики и лечения инфекционных болезней с помощью безопасных и эффективных лекарств.
Глобальным планом действий по устойчивости к противомикробным препаратам поставлены 5 стратегических задач:
- повысить информированность и понимание устойчивости к противомикробным препаратам;
- усилить эпиднадзор и научные исследования;
- сократить число случаев заражения;
- оптимизировать использование противомикробных препаратов;
- обеспечить устойчивые инвестиции на цели противодействия устойчивости к противомикробным препаратам.
Собравшиеся на сессии Генеральной Ассамблеи Организации Объединенных Наций в Нью-Йорке в сентябре 2016 г. главы государств приняли обязательство развернуть широкую и координированную деятельность по борьбе с глубинными причинами устойчивости к антибиотикам в ряде секторов, особенно в области охраны здоровья человека и животных, а также сельского хозяйства. Государства-члены подтвердили свою решимость разработать национальные планы действий по борьбе с этим явлением, взяв за основу глобальный план действий. ВОЗ оказывает государствам-членам поддержку по подготовке их национальных планов действий по решению проблемы устойчивости к противомикробным препаратам.
ВОЗ реализует несколько инициатив, направленных на решение проблемы устойчивости к противомикробным препаратам:
Всемирная неделя правильного использования антибиотиков
Эта глобальная многолетняя кампания проводится ежегодно в ноябре начиная с 2015 г
под девизом «Антибиотики: используйте осторожно!» В рамках тематической недели проводятся многочисленные мероприятия
Глобальная система по надзору за устойчивостью к противомикробным препаратам (GLASS)
Данная система, функционирование которой обеспечивает ВОЗ, базируется на стандартизированном подходе к сбору, анализу и обмену данными, касающимися устойчивости к противомикробным препаратам, в глобальном масштабе. Эти данные используются для принятия решений на местном, национальном и региональном уровнях.
Глобальное партнерство по научным исследованиям и разработке антибиотиков (GARDP)
Эта совместная инициатива ВОЗ и Инициативы по лекарственным средствам против забытых болезней стимулирует исследования и разработки на основе государственно-частных партнерств. К 2023 г. Партнерство планирует разработать и вывести на рынок до четырех новых лекарственных средств за счет совершенствования существующих антибиотиков и ускоренного создания новых антибиотиков.
Посев на флору
Общее описание
 Это микробиологическое исследование, позволяющее определить качественный и количественный состав микрофлоры исследуемого биоматериала, в том числе выявить условно-патогенные микроорганизмы в высоком титре и патогенные микроорганизмы, определить их чувствительность к антибиотикам.
Это микробиологическое исследование, позволяющее определить качественный и количественный состав микрофлоры исследуемого биоматериала, в том числе выявить условно-патогенные микроорганизмы в высоком титре и патогенные микроорганизмы, определить их чувствительность к антибиотикам.
Возможности метода
- точное определение возбудителя инфекционных болезней;
- разработка рациональной антимикробной терапии в каждом конкретном случае;
- оценка степени эффективности проводимой терапии.
Материал для исследования
- разовая порция мочи,
- урогенитальный мазок (с секретом предстательной железы),
- мокрота,
- мазок из ротоглотки,
- мазок из носоглотки,
- грудное молоко,
- эякулят,
- отделяемое из уха,
- мазок с конъюнктивы,
- синовиальная жидкость,
- спинномозговая жидкость,
- мазок из цервикального канала,
- мазок из уретры,
- плевральная жидкость,
- смыв с бронхов,
- желчь,
- экссудат,
- биоптаты.
Подготовка к исследованию
- употребление пациентом большого количества воды не менее чем за 8-12 часов до сбора мокроты;
- посев мочи на флору должен проводиться при условии исключения мочегонных препаратов в течении 48 часов до сбора мочи;
- женщинами сдача мочи или урогенитатального мазка выполняется до начала менструации или спустя 2 дня после ее окончания;
- для мужчин рекомендуется не мочиться в течение не менее 3 часов до сдачи мочи или мазка;
- в день взятия биоматериала на анализ пациентам запрещается чистить зубы.
Трактовка результатов исследования
Нормальная микрофлора человека представляет собой совокупность микроорганизмов, населяющих кожу и слизистые оболочки. Наибольшее их количество обитает в желудочно-кишечном тракте, остальная часть — на кожных покровах, зеве, глотке, в мочеполовой системе. Нормальная микрофлора подразделяется на постоянную, факультативную и случайную. Референсные значения для различных видов микроорганизмов зависят от их локализации (точки взятия биологического материала). Так, биологический материал, полученный из зева, носа, используется для определения характера неспецифического инфекционного процесса, протекающего в организме. Также соскоб из носа актуален при анализе на чувствительность к антибиотикам.
По способности вызывать инфекционные заболевания микроорганизмы классифицируют на непатогенные (не вызывающие заболевания), условно-патогенные (в норме могут выделяться в небольших количествах и при определенных условиях активно размножаются, приводя к воспалению) и патогенные (являются возбудителями инфекционных заболеваний и в составе нормальной микрофлоры не обнаруживаются).
При обнаружении условно-патогенных микроорганизмов в высоком титре или патогенных микроорганизмов определяется их чувствительность к антибиотикам и бактериофагам.
Как у мужчин, так и у женщин на результаты исследования может оказывать влияние проведенная ранее противогрибковая или антибактериальная терапия.
Нормы
Нормой является наличие в микрофлоре непатогенных микроорганизмов, условно-патогенных в небольшом количестве и отсутствие патогенных.
Посев на флору с определением чувствительности к антибиотикам – это точный микробиологический анализ, который проходит в лабораторных условиях. Для исследования берется биологический материал и помещается в среду, благоприятную для развития патогенных микроорганизмов.
Он дает возможность врачу поставить корректный диагноз и сразу определить группу эффективных антибиотиков.