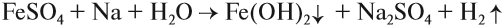Самый легкий металл
Содержание:
Почему графен – материал будущего?
Графен – самый тонкий и прочный материал, известный человеку.
Графен – самый прочный материал, известный человеку. Будучи прозрачным, графен состоит из однослойного атома углерода, расположенного в треугольной решетке и является основным структурным элементом древесного угля, графита и углеродных нанотрубок. По своей прочности графен в 200 раз превосходит сталь. Многообразие химических и физических свойств этого самого прочного материала на Земле обусловлено кристаллической структурой и химической связью атомов углерода, которые и составляют графен. Используют этот поражающий воображение материал в аэрокосмической и автомобильной промышленности. Конечно графен – не вибраниум, однако вполне способен составить ему конкуренцию, учитывая, что в будущем с помощью графена ученые наверняка совершат огромное количество самых разных открытий. Так, с помощью этого сверхпрочного и тонкого материала ученые смогут восстанавливать сломанные кости и даже предотвращать переломы.
Lithium. Nirvana
Я так счастлив,Ведь сегодня я нашёл своих друзей…Они в моей голове.Я такой безобразный, но это нормально,Ведь и ты такой…Мы разбили наши зеркала.Утро воскресенья.Для меня каждый день.И я не боюсь, зажги мои свечи…Я в оцепенении, ведь я нашёл бога…
Да…
Я так одинок, но это ничего,Я побрил себе голову… И я не печалюсь,И, может,Я виноват во всём, что слышал…Но я не уверен..Я так взвинчен,Не дождусь встречи с тобой там…Мне всё равно.Я так возбужден,Но это не страшно,У меня добрые намерения.
Да..
Я люблю это — я не схожу с умаЯ скучаю по тебе, я не схожу с ума,Я люблю тебя, я не схожу с ума,Я убью тебя, я не схожу с ума..
Я так счастлив,Ведь сегодня я нашёл своих друзей…Они в моей голове.Я такой безобразный, но это нормально,Ведь и ты такой…Мы разбили наши зеркала.Утро воскресенья.Для меня каждый день.И я не боюсь, зажги мои свечи…Я в оцепенении, ведь я нашёл бога…
Да…
Я люблю это — я не схожу с умаЯ скучаю по тебе, я не схожу с ума,Я люблю тебя, я не схожу с ума,Я убью тебя, я не схожу с ума…
Автор перевода — tester

Применение
Сплав сульфида лития и сульфида меди — эффективный полупроводник для термоэлектропреобразователей (ЭДС около 530 мкВ/К).
Из лития изготовляют аноды химических источников тока (аккумуляторов, например, литий-хлорных аккумуляторов) и гальванических элементов с твёрдым электролитом (например, литий-хромсеребряный, литий-висмутатный, литий-окисномедный, литий-двуокисномарганцевый, литий-иодсвинцовый, литий-иодный, литий-тионилхлоридный, литий-оксидванадиевый, литий-фторомедный, Литий-двуокисносерный элементы), работающих на основе неводных жидких и твёрдых электролитов (тетрагидрофуран, пропиленкарбонат, метилформиат, ацетонитрил).
Кобальтат лития и молибдат лития показали лучшие эксплуатационные свойства и энергоёмкость в качестве положительного электрода литиевых аккумуляторов.
Гидроксид лития используется как один из компонентов для приготовления электролита щелочных аккумуляторов. Добавление гидроксида лития к электролиту тяговых железо-никелевых, никель-кадмиевых, никель-цинковых аккумуляторных батарей повышает их срок службы в 3 раза и ёмкость на 21 % (за счёт образования никелатов лития).
Алюминат лития — наиболее эффективный твёрдый электролит (наряду с цезий-бета-глинозёмом).
Монокристаллы фторида лития используются для изготовления высокоэффективных (КПД 80 %) лазеров на центрах свободной окраски и для изготовления оптики с широкой спектральной полосой пропускания.
Перхлорат лития используют в качестве окислителя.
Сульфат лития используют в дефектоскопии.
Нитрат лития используют в пиротехнике для окрашивания огней в красный цвет.
Сплавы лития с серебром и золотом, а также медью являются очень эффективными припоями. Сплавы лития с магнием, скандием, медью, кадмием и алюминием — новые перспективные материалы в авиации и космонавтике (из-за их лёгкости). На основе алюмината и силиката лития создана керамика, затвердевающая при комнатной температуре и используемая в военной технике, металлургии, и, в перспективе, в термоядерной энергетике. Огромной прочностью обладает стекло на основе литий-алюминий-силиката, упрочняемого волокнами карбида кремния. Литий очень эффективно упрочняет сплавы свинца и придает им пластичность и стойкость против коррозии.
Триборат лития-цезия используется как оптический материал в радиоэлектронике. Кристаллические ниобат лития LiNbO3 и танталат лития LiTaO3 являются нелинейными оптическими материалами и широко применяются в нелинейной оптике, акустооптике и оптоэлектронике.Литий также используется при наполнении осветительных газоразрядных металлогалогеновых ламп.Гидроксид лития добавляют в электролит щелочных аккумуляторов для увеличения срока их службы.
В чёрной и цветной металлургии литий используется для раскисления и повышения пластичности и прочности сплавов. Литий иногда применяется для восстановления методами металлотермии редких металлов.
Изотопы 6Li и 7Li обладают разными ядерными свойствами (сечение поглощения тепловых нейтронов, продукты реакций) и сфера их применения различна. Гафниат лития входит в состав специальной эмали, предназначенной для захоронения высокоактивных ядерных отходов, содержащих плутоний.
Высокогигроскопичные бромид LiBr и хлорид лития LiCl применяются для осушения воздуха и других газов.
Соли лития обладают нормотимическими и другими лечебными свойствами. Поэтому они находят применение в медицине.
Стеарат лития («литиевое мыло») используется в качестве загустителя для получения пастообразных высокотемпературных смазок машин и механизмов.
Гидроксид лития LiOH, пероксид Li2O2 применяются для очистки воздуха от углекислого газа; при этом последнее соединение реагирует с выделением кислорода (например, 2Li2O2 + 2CO2 → 2Li2CO3 + O2), благодаря чему используется в изолирующих противогазах, в патронах для очистки воздуха на подлодках, на пилотируемых космических аппаратах и т. д.
Литий и его соединения широко применяют в силикатной промышленности для изготовления специальных сортов стекла и покрытия фарфоровых изделий.
Соединения лития используются в текстильной промышленности (отбеливание тканей), пищевой (консервирование) и фармацевтической (изготовление косметики).
Получение
- Сырьё
Исходным сырьём для лития служат два источника: минеральное сырьё (например, сподумен) и солевые растворы из соляных озёр, богатые солями лития. В обоих случаях результатом работы является карбонат лития Li2CO3.
Сподумен (силикат лития и алюминия) можно перерабатывать несколькими способами. Например, спеканием с сульфатом калия получают растворимый сульфат лития, который осаждают из раствора содой:
- Li2SO4+Na2CO3⟶Li2CO3↓+Na2SO4{\displaystyle {\ce {Li2SO4 + Na2CO3 -> Li2CO3 v + Na2SO4}}}
Солевые растворы предварительно выпаривают. В солевых растворах содержится хлорид лития LiCl. Однако вместе с ним содержатся большие количества других хлоридов. Для увеличения концентрации лития из выпаренного раствора осаждают карбонат лития Li2CO3, например по схеме
- 2LiCl+Na2CO3⟶Li2CO3↓+2NaCl{\displaystyle {\ce {2LiCl + Na2CO3 -> Li2CO3 v + 2NaCl}}}
- Получение металла
Металлический литий чаще всего получают электролизом расплава солей или восстановлением из оксида.
- Электролиз
При электролизе используется хлорид лития. Его получают из карбоната по схеме:
- Li2CO3+2HCl⟶2LiCl+H2O+CO2{\displaystyle {\ce {Li2CO3 + 2HCl -> 2LiCl + H2O + CO2}}}
Поскольку температура плавления хлорида лития близка к температуре кипения лития, применяют эвтектическую смесь с хлоридом калия или бария, что понижает температуру расплава и позволяет избавиться от необходимости улавливать пары металла. Расход электроэнергии до 14 кВт∙ч на 1 кг лития. На другом электроде получают газообразный хлор.
- Восстановление
Поскольку литий — активный металл, его восстановление из оксидов или галогенидов возможно только при немедленном удалении лития из зоны реакции. В противном случае невозможно сместить баланс реакции в нужную сторону. Литий удаляют из зоны реакции путём поддержания температур, при которых литий испаряется и покидает зону реакции в виде паров. Другие реагенты при этом должны оставаться в расплаве. Для восстановления используются кремний или алюминий, например:
- 2Li2O+Si⟶4Li↑+SiO2{\displaystyle {\ce {2Li2O + Si -> 4Li ^ + SiO2}}}
- Рафинирование
Полученный литий очищают методом вакуумной дистилляции, последовательно выпаривая разные металлы из сплава при определённых температурах.
Добыча
В 2015 году в мире добыли 32,5 тыс. тонн лития и его соединений в пересчёте на металл. Крупнейшие страны по добыче — Австралия, Чили и Аргентина. В России собственная добыча лития была полностью утрачена после распада СССР, но в 2017 году Россия запустила экспериментальную установку, позволяющую добывать литий из бедных руд с небольшими затратами.
Большая часть добывается из естественных водных линз в толще соляных озёр, в насыщенных соляных растворах которых концентрируется хлорид лития. Раствор выкачивается и выпаривается на солнце, полученная смесь солей перерабатывается. Содержание лития в растворе колеблется от 0,01 % до 1 %. Также значительная доля добычи приходится на минеральное сырьё, например, минерал сподумен.
Металлическая микрорешётка

Это самый легкий металл во Вселенной. Если взять тот же невесомый пенопласт, то он будет тяжелее этого пористого материала в 100 раз. Но обманчивый внешний вид не должен вводить в заблуждение, ведь по показателю прочности материал даст фору графиту.
Используют его в инженерных областях, при изготовлении тепловых изоляторов и амортизаторов. Еще одно качество металла – способность без потери полезных свойств сжиматься и возвращаться в исходное положение. Эту особенность успешно применяют для накопления энергии. Интересно, что металлические решетки взяли на вооружения инженеры компании Boeing для изготовления самолетов.
Физические свойства
Литий — серебристо-белый металл, мягкий и пластичный, твёрже натрия, но мягче свинца. Его можно обрабатывать прессованием и прокаткой.
При комнатной температуре металлический литий имеет кубическую объёмноцентрированную решётку (координационное число 8), пространственная группа I m3m, параметры ячейки a = 0,35021 нм, Z = 2.
Ниже 78 К устойчивой кристаллической формой является гексагональная плотноупакованная структура, в которой каждый атом лития имеет 12 ближайших соседей, расположенных в вершинах кубооктаэдра. Кристаллическая решётка относится к пространственной группе P 63/mmc, параметры a = 0,3111 нм, c = 0,5093 нм, Z = 2.
Из всех щелочных металлов литий характеризуется самыми высокими температурами плавления и кипения (180,54 и 1340 °C, соответственно), у него самая низкая плотность при комнатной температуре среди всех металлов (0,533 г/см³, почти в два раза меньше плотности воды). Вследствие своей низкой плотности литий всплывает не только в воде, но и, например, в керосине.
Маленькие размеры атома лития приводят к появлению особых свойств металла. Например, он смешивается с натрием только при температуре ниже 380 °C и не смешивается с расплавленными калием, рубидием и цезием, в то время как другие па́ры щелочных металлов смешиваются друг с другом в любых соотношениях.
Карминово-красное окрашивание пламени солями лития
Об элементе
Ли́тий (химический символ — Li; лат. Lithium) — элемент первой группы (по устаревшей классификации — главной подгруппы первой группы), второго периода периодической системы химических элементов с атомным номером 3.
Литий был открыт в 1817 году шведским химиком и минералогом Иоганном Арфведсоном сначала в минерале петалите (Li,Na)[Si4AlO10], а затем в сподумене LiAl[Si2O6] и в лепидолите KLi1.5Al1.5[Si3AlO10](F,OH)2. Металлический литий впервые получил Гемфри Дэви в 1818 году.
Своё название литий получил из-за того, что был обнаружен в «камнях» (греч. λίθος — камень). Первоначально назывался «литион», современное название было предложено Берцелиусом.
Физические свойства
Простое вещество литий — мягкий щелочной металл серебристо-белого цвета, , мягкий и пластичный, твёрже натрия, но мягче свинца. Его можно обрабатывать прессованием и прокаткой.
При комнатной температуре металлический литий имеет кубическую объёмноцентрированную решётку (координационное число 8), пространственная группа I m3m, параметры ячейки a = 0,35021 нм, Z = 2. Ниже 78 К устойчивой кристаллической формой является гексагональная плотноупакованная структура, в которой каждый атом лития имеет 12 ближайших соседей, расположенных в вершинах кубооктаэдра. Кристаллическая решетка относится к пространственной группе P 63/mmc, параметры a = 0,3111 нм, c = 0,5093 нм, Z = 2.
Из всех щелочных металлов литий характеризуется самыми высокими температурами плавления и кипения (180,54 и 1340 °C, соответственно), у него самая низкая плотность при комнатной температуре среди всех металлов (0,533 г/см³, почти в два раза меньше плотности воды). Вследствие своей низкой плотности литий всплывает не только в воде, но и, например, в керосине.
Маленькие размеры атома лития приводят к появлению особых свойств металла. Например, он смешивается с натрием только при температуре ниже 380 °C и не смешивается с расплавленными калием, рубидием и цезием, в то время как другие па́ры щелочных металлов смешиваются друг с другом в любых соотношениях.
Химические свойства
Литий является щелочным металлом, однако относительно устойчив на воздухе. Литий является наименее активным щелочным металлом, с сухим воздухом (и даже с сухим кислородом) при комнатной температуре практически не реагирует. По этой причине литий является единственным щелочным металлом, который не хранят в керосине (к тому же плотность лития столь мала, что он будет в нём плавать); он может непродолжительное время храниться на воздухе.
Во влажном воздухе медленно реагирует с азотом и другими газами, находящимися в воздухе, превращаясь в нитрид Li3N, гидроксид LiOH и карбонат Li2CO3. В кислороде при нагревании горит, превращаясь в оксид Li2O. Интересная особенность лития в том, что в интервале температур от 100 °C до 300 °C он покрывается плотной оксидной плёнкой и в дальнейшем не окисляется. В отличие от остальных щелочных металлов, дающих стабильные надпероксиды и озониды; надпероксид и озонид лития — нестабильные соединения.
В 1818 немецкий химик Леопольд Гмелин установил, что литий и его соли окрашивают пламя в карминово-красный цвет, это является качественным признаком для определения лития. Температура самовоспламенения находится в районе 300 °C. Продукты горения раздражают слизистую оболочку носоглотки.
Спокойно, без взрыва и возгорания, реагирует с водой, образуя LiOH и H2. Реагирует также с этиловым спиртом (с образованием алкоголята), с водородом (при 500—700 °C) с образованием гидрида лития, с аммиаком и с галогенами (с иодом — только при нагревании). При 130 °C реагирует с серой с образованием сульфида. В вакууме при температуре выше 200 °C реагирует с углеродом (образуется ацетиленид). При 600—700 °C литий реагирует с кремнием с образованием силицида. Химически растворим в жидком аммиаке (−40 °C), образуется синий раствор.
В водном растворе литий имеет самый низкий стандартный электродный потенциал (−3,045 В) из-за малого размера и высокой степени гидратации иона лития.
Длительно литий хранят в петролейном эфире, парафине, газолине и/или минеральном масле в герметически закрытых жестяных коробках. Металлический литий вызывает ожоги при попадании на влажную кожу, слизистые оболочки и в глаза.

Нахождение в природе
Геохимия лития
Литий по геохимическим свойствам относится к крупноионным литофильным элементам, в числе которых калий, рубидий и цезий. Содержание лития в верхней континентальной коре составляет 21 г/т, в морской воде 0,17 мг/л.
Основные минералы лития — слюда лепидолит — KLi1,5Al1,5[Si3AlO10](F, OH)2 и пироксен сподумен — LiAl[Si2O6]. Когда литий не образует самостоятельных минералов, он изоморфно замещает калий в широко распространённых породообразующих минералах.
Месторождения лития приурочены к редкометалльным гранитным интрузиям, в связи с которыми развиваются литиеносные пегматиты или гидротермальные комплексные месторождения, содержащие также олово, вольфрам, висмут и другие металлы. Стоит особо отметить специфические породы онгониты — граниты с магматическим топазом, высоким содержанием фтора и воды и исключительно высокими концентрациями различных редких элементов, в том числе и лития.
Другой тип месторождений лития — рассолы некоторых сильносолёных озёр.
Месторождения
Месторождения лития известны в Чили, Боливии (Солончак Уюни — крупнейшее в мире), США, Аргентине, Конго, Китае (озеро Чабьер-Цака), Бразилии, Сербии, Австралии.
В России более 50 % запасов сосредоточено в редкометалльных месторождениях Мурманской области.
Изотопы лития
Основная статья: Изотопы лития
Природный литий состоит из двух стабильных изотопов: 6Li (7,5 %) и 7Li (92,5 %); в некоторых образцах лития изотопное соотношение может быть сильно нарушено вследствие природного или искусственного фракционирования изотопов. Это следует иметь в виду при точных химических опытах с использованием лития или его соединений. У лития известны 7 искусственных радиоактивных изотопов (4Li − 12Li) и два ядерных изомера (10m1Li и 10m2Li). Наиболее устойчивый из них, 8Li, имеет период полураспада 0,8403 с. Экзотический изотоп 3Li (трипротон), по-видимому, не существует как связанная система.
7Li является одним из немногих изотопов, возникших при первичном нуклеосинтезе (то есть в период от 1 секунды до 3 минут после Большого Взрыва) в количестве не более 10−9 от всех элементов. Некоторое количество изотопа 6Li, как минимум в десять тысяч раз меньшее, чем 7Li, также образовано в первичном нуклеосинтезе.
Примерно в десять раз больше 7Li образовались в звёздном нуклеосинтезе. Литий является промежуточным продуктом реакции ppII, но при высоких температурах активно преобразуется в два ядра гелия-4 (через 8Be).
В космосе
Аномально высокое содержание лития наблюдается в звездных образованиях, состоящих из красного гиганта (или сверхгиганта), внутри которого находится нейтронная звезда — объектах Ландау — Торна — Житкова.
Также имеется большое количество звезд-гигантов с необычно высоким содержанием лития, что объясняется попаданием лития в атмосферу звезд при поглощении ими экзопланет-гигантов.
Устройство аккумулятора

Литий-ионные аккумуляторы состоят из электродов, которые разделены сепаратором с порами. При этом его пропитывают электролитами. Электродный пакет помещают в герметичную оболочку, а набор катодов и анодов прикрепляют к токосъемным клеммам. Оболочку (корпус) могут оснащать предохранительными клапанами, сбрасывающими внутреннее давление в случае возникновения аварийной ситуации или нарушения в работе эксплуатации. Различают такие аккумуляторы по типу катодных материалов, которые используют в устройстве. Ядро лития в них обладает количеством протонов, которое отличается от суммы электронов, окруживших ядро. Поэтому такие устройства и называют ионными. Переносят электроны в аккумуляторе ионы Li с положительным зарядом. Такие частички способны внедряться в кристаллические решетки другого ряда материалов и образовывать химические связи, вследствие чего образуются окислы и соли металлов.
Свойства металлов
Характерные свойства металлов
· Металлический блеск (характерен не только для металлов: его имеют и неметаллы иод и углерод в виде графита)
· Хорошая электропроводность
· Возможность лёгкой механической обработки (см.: пластичность; однако некоторые металлы, например германий и висмут, непластичны)
· Высокая плотность (обычно металлы тяжелее неметаллов)
· Высокая температура плавления (исключения: ртуть, галлий и щелочные металлы)
· Большая теплопроводность
· В реакциях чаще всего являются восстановителями
Физические свойства металлов
Все металлы (кроме ртути и, условно, франция) при нормальных условиях находятся в твёрдом состоянии, однако обладают различной твёрдостью. Ниже приводится твёрдость некоторых металлов по шкале Мооса.
Твёрдость некоторых металлов по шкале Мооса:
| Твёрдость | Металл |
| 0.2 | Цезий |
| 0.3 | Рубидий |
| 0.4 | Калий |
| 0.5 | Натрий |
| 0.6 | Литий |
| 1.2 | Индий |
| 1.2 | Таллий |
| 1.25 | Барий |
| 1.5 | Стронций |
| 1.5 | Галлий |
| 1.5 | Олово |
| 1.5 | Свинец |
| 1.5 | Ртуть(тв.) |
| 1.75 | Кальций |
| 2.0 | Кадмий |
| 2.25 | Висмут |
| 2.5 | Магний |
| 2.5 | Цинк |
| 2.5 | Лантан |
| 2.5 | Серебро |
| 2.5 | Золото |
| 2.59 | Иттрий |
| 2.75 | Алюминий |
| 3.0 | Медь |
| 3.0 | Сурьма |
| 3.0 | Торий |
| 3.17 | Скандий |
| 3.5 | Платина |
| 3.75 | Кобальт |
| 3.75 | Палладий |
| 3.75 | Цирконий |
| 4.0 | Железо |
| 4.0 | Никель |
| 4.0 | Гафний |
| 4.0 | Марганец |
| 4.5 | Ванадий |
| 4.5 | Молибден |
| 4.5 | Родий |
| 4.5 | Титан |
| 4.75 | Ниобий |
| 5.0 | Иридий |
| 5.0 | Рутений |
| 5.0 | Тантал |
| 5.0 | Технеций |
| 5.0 | Хром |
| 5.5 | Бериллий |
| 5.5 | Осмий |
| 5.5 | Рений |
| 6.0 | Вольфрам |
| 6.0 | β-Уран |
Температуры плавления чистых металлов лежат в диапазоне от −39 °C (ртуть) до 3410 °C (вольфрам). Температура плавления большинства металлов (за исключением щелочных) высока, однако некоторые «нормальные» металлы, например олово и свинец, можно расплавить на обычной электрической или газовой плите.
В зависимости от плотности, металлы делят на лёгкие (плотность 0,53 ÷ 5 г/см³) и тяжёлые (5 ÷ 22,5 г/см³). Самым лёгким металлом является литий (плотность 0.53 г/см³). Самый тяжёлый металл в настоящее время назвать невозможно, так как плотности осмия и иридия — двух самых тяжёлых металлов — почти равны (около 22.6 г/см³ — ровно в два раза выше плотности свинца), а вычислить их точную плотность крайне сложно: для этого нужно полностью очистить металлы, ведь любые примеси снижают их плотность.
Большинство металлов пластичны, то есть металлическую проволоку можно согнуть, и она не сломается. Это происходит из-за смещения слоёв атомов металлов без разрыва связимежду ними. Самыми пластичными являются золото, серебро и медь. Из золота можно изготовить фольгу толщиной 0.003 мм, которую используют для золочения изделий. Однако не все металлы пластичны. Проволока из цинка или олова хрустит при сгибании; марганец и висмут при деформации вообще почти не сгибаются, а сразу ломаются. Пластичность зависит и от чистоты металла; так, очень чистый хром весьма пластичен, но, загрязнённый даже незначительными примесями, становится хрупким и более твёрдым. Некоторые металлы такие как золото, серебро, свинец, алюминий, осмий могут срастаться между собой, но на это может уйти десятки лет.
Все металлы хорошо проводят электрический ток; это обусловлено наличием в их кристаллических решётках подвижных электронов, перемещающихся под действием электрического поля. Серебро, медь и алюминий имеют наибольшую электропроводность; по этой причине последние два металла чаще всего используют в качестве материала для проводов. Очень высокую электропроводность имеет также натрий, в экспериментальной аппаратуре известны попытки применения натриевых токопроводов в форме тонкостенных труб из нержавеющей стали, заполненных натрием. Благодаря малому удельному весу натрия, при равном сопротивлении натриевые «провода» получаются значительно легче медных и даже несколько легче алюминиевых.
Высокая теплопроводность металлов также зависит от подвижности свободных электронов. Поэтому ряд теплопроводностей похож на ряд электропроводностей и лучшим проводником тепла, как и электричества, является серебро. Натрий также находит применение как хороший проводник тепла; широко известно, например, применение натрия в клапанах автомобильных двигателей для улучшения их охлаждения.
Цвет у большинства металлов примерно одинаковый — светло-серый с голубоватым оттенком. Золото, медь и цезий соответственно жёлтого, красного и светло-жёлтого цвета.
Взаимодействие кислот с металлами
С кислотами металлы реагируют по-разному. Металлы, стоящие в электрохимическом ряду активности металлов (ЭРАМ) до водорода, взаимодействуют практически со всеми кислотами.
Происходит реакция замещения, которая также является окислительно-восстановительной:
- Mg+2HCl=MgCl2+H2↑{\displaystyle {\mathsf {Mg+2HCl=MgCl_{2}+H_{2}\uparrow }}}
- 2Al+2H3PO4=2AlPO4+3H2↑{\displaystyle {\mathsf {2Al+2H_{3}PO_{4}=2AlPO_{4}+3H_{2}\uparrow }}}
Взаимодействие концентрированной серной кислоты H2SO4 с металлами
Окисляющие кислоты могут взаимодействовать и с металлами, стоящими в ЭРАМ после водорода:
- Cu+2H2SO4=CuSO4+SO2↑+2H2O{\displaystyle {\mathsf {Cu+2H_{2}SO_{4}=CuSO_{4}+SO_{2}\uparrow +2H_{2}O}}}
Сильно разбавленная кислота реагирует с металлом по классической схеме:
- Mg+H2SO4=MgSO4+H2↑{\displaystyle {\mathsf {Mg+H_{2}SO_{4}=MgSO_{4}+H_{2}\uparrow }}}
При увеличении концентрации кислоты образуются различные продукты:
- Mg+2H2SO4=MgSO4+SO2↑+2H2O{\displaystyle {\mathsf {Mg+2H_{2}SO_{4}=MgSO_{4}+SO_{2}\uparrow +2H_{2}O}}}
- 3Mg+4H2SO4=3MgSO4+S↓+4H2O{\displaystyle {\mathsf {3Mg+4H_{2}SO_{4}=3MgSO_{4}+S\downarrow +4H_{2}O}}}
- 4Mg+5H2SO4=4MgSO4+H2S↑+4H2O{\displaystyle {\mathsf {4Mg+5H_{2}SO_{4}=4MgSO_{4}+H_{2}S\uparrow +4H_{2}O}}}
Реакции для азотной кислоты (HNO3)
Продукты взаимодействия железа с HNO3 разной концентрации
- Cu+4HNO3(60%)=Cu(NO3)2+2NO2↑+2H2O{\displaystyle {\mathsf {Cu+4HNO_{3}(60\%)=Cu(NO_{3})_{2}+2NO_{2}\uparrow +2H_{2}O}}}
- 3Cu+8HNO3(30%)=3Cu(NO3)2+2NO↑+4H2O{\displaystyle {\mathsf {3Cu+8HNO_{3}(30\%)=3Cu(NO_{3})_{2}+2NO\uparrow +4H_{2}O}}}
При взаимодействии с активными металлами вариантов реакций ещё больше:
- Zn+4HNO3(60%)=Zn(NO3)2+2NO2↑+2H2O{\displaystyle {\mathsf {Zn+4HNO_{3}(60\%)=Zn(NO_{3})_{2}+2NO_{2}\uparrow +2H_{2}O}}}
- 3Zn+8HNO3(30%)=3Zn(NO3)2+2NO↑+4H2O{\displaystyle {\mathsf {3Zn+8HNO_{3}(30\%)=3Zn(NO_{3})_{2}+2NO\uparrow +4H_{2}O}}}
- 4Zn+10HNO3(20%)=4Zn(NO3)2+N2O↑+5H2O{\displaystyle {\mathsf {4Zn+10HNO_{3}(20\%)=4Zn(NO_{3})_{2}+N_{2}O\uparrow +5H_{2}O}}}
- 5Zn+12HNO3(10%)=5Zn(NO3)2+N2↑+6H2O{\displaystyle {\mathsf {5Zn+12HNO_{3}(10\%)=5Zn(NO_{3})_{2}+N_{2}\uparrow +6H_{2}O}}}
- 4Zn+10HNO3(3%)=4Zn(NO3)2+NH4NO3+3H2O{\displaystyle {\mathsf {4Zn+10HNO_{3}(3\%)=4Zn(NO_{3})_{2}+NH_{4}NO_{3}+3H_{2}O}}}
Легирование
Основная статья: Легирование (металлургия)
Легирование — это введение в расплав дополнительных элементов, модифицирующих механические, физические и химические свойства основного материала.
ЛИТИЙ И КРЕМНИЙ
Силицид лития — соединение, полученное еще в прошлом веке, но его формула, а следовательно, и состав ДО сих пор не считаются окончательно установленными. Первым получил это вещество известный французский ученый Анри Муассан. Он нагревал в вакууме до 400—500C смесь лития и кремния и получал легкие (чуть тяжелее воды) голубоватые кристаллы. Согласно Муассану, формула этого соединения Li6Si2. Эта формула и вызывает сомнения. Абсолютно достоверного ответа на вой рос, прав Муассан или нет, не получено не только оттого, что силицид лития не нашел пока практического применения, но и потому, что это соединение сложно получать, а исследовать еще сложнее. На воздухе силицид лития быстро разлагается.
ЛИТИЙ В ПСИХОТЕРАПИИ. Медики не раз наблюдали, что некоторые соединения лития (в соответствующих дозах, разумеется) оказывают положительное влияние на больных, страдающих маниакальной депрессией. Объясняют этот эффект двояко. С одной стороны, установлено, что литий способен регулировать активность некоторых ферментов, участвующих в переносе из межклеточной жидкости в клетки мозга ионов натрия и калия. С другой стороны, замечено, что ионы лития непосредственно воздействуют на ионный баланс клетки. А от баланса натрия и калия зависит в значительной мере состояние больного: избыток натрия в клетках характерен для депрессивных пациентов, недостаток — для страдающих маниями. Выравнивая натрий-калиевый баланс, соли лития оказывают положительное влияние и на тех, и на других.
В КАРДИОСТИМУЛЯТОРЕ. В последние годы появилась серия публикаций о чрезвычайно миниатюрных электрохимических источниках тока (батареях, аккумуляторах) с различными соединениями лития. Такие батареи работают, в частности, в новых стимуляторах сердечной деятельности.
ИОДИД ЛИТИЯ — КАТАЛИЗАТОР. Как недавно установили химики иркутского Института органической химии, реакцию ацетиленовых углеводородов с некоторыми кремнийорганическими соединениями хорошо ускоряет катализатор, в состав которого, наряду с соединением платины, входит йодид лития.
Вы читаете, статья на тему Литий в ядерном реакторе