Почему ртуть жидкая, в отличие от других металлов
Содержание:
В окружающей среде
Содержание ртути в ледниках за 270 лет
До индустриальной революции осаждение ртути из атмосферы составляло около 4 нанограммов на 1 кубический дециметр льда. Природные источники, такие, как вулканы, составляют примерно половину всех выбросов атмосферной ртути. Причиной появления остальной половины является деятельность человека. В ней основную долю составляют выбросы в результате сгорания угля (главным образом в тепловых электростанциях) — 65 %, добыча золота — 11 %, выплавка цветных металлов — 6,8 %, производство цемента — 6,4 %, утилизация мусора — 3 %, производство соды — 3 %, чугуна и стали — 1,4 %, ртути (в основном для батареек) — 1,1 %, остальное — 2 %.
Одно из тяжелейших загрязнений ртутью в истории случилось в японском городе Минамата в 1956 году, что привело к более чем трём тысячам жертв, которые либо умерли, либо сильно пострадали от болезни Минамата.
ЗАПАСЫ И ДОБЫЧА
 Ртуть — относительно редкий элемент в земной коре со средней концентрацией 83 мг/т. Однако ввиду того, что ртуть слабо связывается химически с наиболее распространёнными в земной коре элементами, ртутные руды могут быть очень концентрированными по сравнению с обычными породами. Наиболее богатые ртутью руды содержат до 2,5 % ртути. Основная форма нахождения ртути в природе — рассеянная, и только 0,02 % её заключено в месторождениях. Содержание ртути в различных типах изверженных пород близки между собой (около 100 мг/т). Из осадочных пород максимальные концентрации ртути установлены в глинистых сланцах (до 200 мг/т). В водах Мирового океана содержание ртути — 0,1 мкг/л. Важнейшей геохимической особенностью ртути является то, что среди других халькофильных элементов она обладает самым высоким потенциалом ионизации. Это определяет такие свойства ртути, как способность восстанавливаться до атомарной формы (самородной ртути), значительную химическую стойкость к кислороду и кислотам.
Ртуть — относительно редкий элемент в земной коре со средней концентрацией 83 мг/т. Однако ввиду того, что ртуть слабо связывается химически с наиболее распространёнными в земной коре элементами, ртутные руды могут быть очень концентрированными по сравнению с обычными породами. Наиболее богатые ртутью руды содержат до 2,5 % ртути. Основная форма нахождения ртути в природе — рассеянная, и только 0,02 % её заключено в месторождениях. Содержание ртути в различных типах изверженных пород близки между собой (около 100 мг/т). Из осадочных пород максимальные концентрации ртути установлены в глинистых сланцах (до 200 мг/т). В водах Мирового океана содержание ртути — 0,1 мкг/л. Важнейшей геохимической особенностью ртути является то, что среди других халькофильных элементов она обладает самым высоким потенциалом ионизации. Это определяет такие свойства ртути, как способность восстанавливаться до атомарной формы (самородной ртути), значительную химическую стойкость к кислороду и кислотам.
Одно из крупнейших в мире ртутных месторождений находится в Испании (Альмаден). Известны месторождения ртути на Кавказе (Дагестан, Армения), в Таджикистане, Словении, Киргизии (Хайдаркан — Айдаркен) Украине (Горловка, Никитовский ртутный комбинат).
В России находятся 23 месторождения ртути, промышленные запасы составляют 15,6 тыс. тонн (на 2002 год), из них крупнейшие разведаны на Чукотке — Западно-Палянское и Тамватнейское.
Ртуть получают обжигом киновари (сульфида ртути(II)) или металлотермическим методом. Пары ртути конденсируют и собирают. Этот способ применяли ещё алхимики древности.
Торговля «красной ртутью»
Красная ртуть по праву считается наиболее коммерчески успешным вымышленным материалом. В начале 90-х многие жулики, от мелких до оргпреступности, торговали сомнительными товарами, называя их «красной ртутью».
Продавались смеси ртути с кирпичной пылью и другими веществами красных оттенков, оксид ртути, пироантимонат, киноварь и другие ртутьсодержащие вещества.
Также под таким названием проходили амальгамы золота, платины, плутония и других металлов, контрабандно вывозимых с территории Российской Федерации. В связи с высокой стоимостью амальгамированных металлов цена таких амальгам достигала $500 за грамм.
В 2008 году несколько мошенников на окраине Уфы пытались продать термос с обычной ртутью за 5 млн рублей, но были задержаны. Однако, в итоге им был выписан лишь административный штраф за ненадлежащее хранение ртути, поскольку состава преступления в их действиях не нашлось.
В конце 80-х ЦРУ, Моссад и другие разведки делали попытки закупок КР , но постоянно покупали разные смеси ртути с кирпичной пылью и другими красящими веществами.
3.
Ртуть может быть не только в жидком состоянии, но и газообразном, поскольку при комнатной температуре происходит её нагрев и она начинает испаряться
Пары ртути очень вредны для организма человека, поэтому с этим металлом нужно обращаться очень осторожно
В домашних условиях вы можете встретить ртуть в чистом виде только в градусниках. Не забывайте, что обязательно нужно вызывать специальную службу, если вы его разобьете.
Существуют ли еще жидкие металлы?
Ртуть единственный металл, который при нормальных условиях имеет жидкую форму. Дело в температуре плавления. Существуют также металлы, которые становятся жидкими при температуре тела человека.
Например, температура плавления Галлия составляет 29,8 градуса. Это значит, что в наших ладонях он станет таким же жидким как ртуть. Также, существует металл Цезий, который плавится при 28,5 градусах, но лучше в руки его не брать, поскольку он является щелочным металлом. Нельзя не упомянуть Франций, который “растает” в руках при 26,5 градусах.
Техника
●Ртуть используется как рабочее тело
в ртутных термометрах (особенно высокоточных), так как (а) обладает довольно
широким диапазоном, в котором находится в жидком состоянии, (б) её коэффициент
термического расширения почти не зависит от температуры и (в) обладает
сравнительно малой теплоёмкостью. Сплав ртути с таллием используется для
низкотемпературных термометров.
●Парами ртути заполняют
люминесцентные лампы, поскольку пары светятся в тлеющем разряде. В спектре
испускания паров ртути много ультрафиолетового света и, чтобы преобразовать его
в видимый, стекло люминесцентных ламп изнутри покрывают люминофором. Без люминофора
ртутные лампы являются источником жесткого ультрафиолета (254 нм), в каковом
качестве и используются. Такие лампы делают из кварцевого стекла, пропускающего
ультрафиолет, поэтому они называются кварцевыми.
●Ртутные электрические вентили
(игнитроны) в мощных выпрямительных устройствах, электроприводах,
электросварочных устройствах, тяговых и выпрямительных подстанциях и т. п. со
средней силой тока в сотни ампер и выпрямленным напряжением до 5 кВ.
●Ртуть и сплавы на её основе
используются в герметичных выключателях, включающихся при определённом
положении.
●Ртуть используется в датчиках положения.
●В некоторых химических источниках
тока (например, ртутно-цинковых), в эталонных источниках напряжения (Нормальный
элемент Вестона).
●Ртуть также иногда применяется в
качестве рабочего тела в тяжелонагруженных гидродинамических подшипниках.
●Ртуть ранее входила в состав
некоторых биоцидных красок для предотвращения обрастания корпуса судов в
морской воде. Сейчас запрещается использовать такого типа покрытия.
●Иодид ртути(I) используется как полупроводниковый
детектор радиоактивного излучения.
●Фульминат ртути(II) («гремучая ртуть») издавна
применяется в качестве инициирующего ВВ (Детонаторы).
●Бромид ртути(I) применяется при термохимическом
разложении воды на водород и кислород (атомно-водородная энергетика).
●Перспективно использование ртути в
сплавах с цезием в качестве высокоэффективного рабочего тела в ионных
двигателях.
●До середины 20 века ртуть широко
применялась в барометрах и манометрах.
●Ртутные вакуумные насосы были
основными источниками вакуума в 19 и начале 20 веков.
●Ранее ртуть использовали для
золочения поверхностей методом амальгамирования, однако в настоящее время от
этого метода отказались из-за токсичности ртути.
●Соединения ртути использовались в
шляпном производстве для выделки фетра.
Горнорудные процессы и переработка
Основной источник для добычи ртути — руда HgS (киноварь). Крупнейшее месторождение находится в Испании. Мировое производство Hg из неё составляет около 8 тыс. тонн в год. Кроме киновари, к ртутным рудам относят:
- кордероит Hg3S2Cl2;
- ливингстонит HgSb4S8;
- монтроидит HgO;
- каломель HgCl.

Ртутьсодержащие руды формируются глубоко под землёй и поднимаются к поверхности под воздействием вулканической деятельности. Обычно их находят в трещиноватых породах на глубине до 1 км. Кроме рудных месторождений, существуют ещё такие источники получения ртути:
- побочные продукты добычи или переработки других металлов (цинка, золота, серебра) или минералов;
- вторичное сырьё — отработанные продукты или отходы.
Окислительно-дистилляционный обжиг
Извлечение материала из киновари — основной способ промышленного производства Hg. Поскольку большинство добываемой киновари содержит менее 1% ртути, извлечённую из выработок руду необходимо обогащать. Применяют самые разнообразные методы механической обработки от отсадки до флотации. Сама технология не сильно изменилась со времён Аристотеля и представляет собой процесс перегонки. Технически это выглядит так:
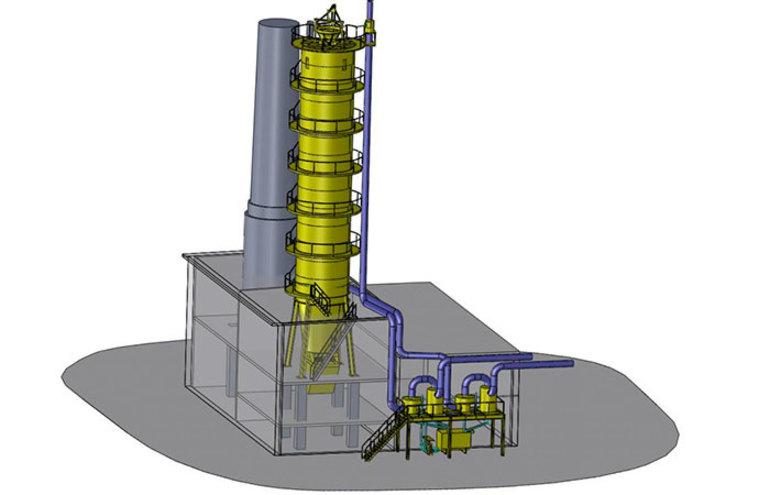
- Нагрев сульфидной руды в присутствии воздуха. Кислород соединяется с серой и происходит высвобождение паров металла при температуре выше точки его кипения.
- Газы пропускаются через систему трубок для конденсации паров в жидкую фазу.
Наиболее распространённый тип печей — классический вертикальный. Перед загрузкой руду смешивают с углём или коксом. Сжигание топлива в нижней части печи порождает поток горячих газов, которые при температуре около 300 °C проходят через падающую руду и испаряют высвободившуюся ртуть. Тепло, генерируемое окислительно-восстановительной реакцией, усиливает нагрев поступающего воздуха, температура в верхней части печи поднимается до 700 °C, что делает извлечение более эффективным.
Полученные пары и продукты сгорания охлаждаются, как правило, в водяном конденсаторе. После извлечения металлической ртути газы очищают от вредных элементов перед тем, как выпустить в атмосферу. Собранный жидкий металл из-за высокого удельного веса выталкивает на поверхность примеси, которые затем нетрудно удалить фильтрованием. Для более тонкой очистки процессы перегонки повторяют несколько раз, но уже на другом оборудовании. Также с целью удаления примесей полученный продукт подвергают электролизу.
Другие способы
В практике современной горной добычи применяется и метод обработки рудных тел без извлечения на поверхность. В этом случае в штольни закачиваются раскалённые газы, вызывающие испарение металла в присутствии ранее размещённого сорбента. На последний выпадает ртутьсодержащий конденсат после охлаждения энергоносителя.
Существует и альтернативный пирометаллургическому способу процесс — гидрометаллургический метод получения металла из руд. Суть его заключается в выщелачивании ртути из породы растворами гидроксида натрия и сульфида натрия. Затем Hg выделяют электролизом. Выщелачивание обходится значительно дороже обжига и применяется в отношении неподдающихся классической переработке руд.
https://youtube.com/watch?v=sDcbGCXCEq0
Насколько опасен ртутный градусник
Если обращаться аккуратно со ртутным градусником, хранить его в недоступном для малышей и защищенном от прямых солнечных лучей месте, то никакой опасности данный прибор не несет. Продаются современные градусники в специальных чехлах, которые смягчат удар даже при падении.
Однако, следует помнить, что при нарушении целостности термометра существует опасность для здоровья. Он содержит жидкий тяжелый металл – ртуть, испарения которого сильно токсичны. Эта субстанция относится к первому классу максимально опасных веществ. Именно поэтому во многих странах полностью запрещен выпуск ртутных градусников. Всего 1-2 грамма вещества могут спровоцировать серьезное отравление ртутью.
Чем опасна ртуть: последствия для организма
Если все же термометр разбился, подвижные ртутные шарики довольно быстро забиваются в маленькие щели, закатываются в углы, где достать их очень сложно. Не собранная сразу ртуть начинает испаряться. Процесс испарения происходит при температуре от 18 градусов по Цельсию. Яд попадает в человеческий организм обычно через дыхательные пути, вызывая отравление.
Многие скажут, что будь градусник настолько опасен, то его бы полностью исключили с продажи. Конечно, острого отравления может и не произойти, но длительное вдыхание паров ядовитого вещества может привести к неприятным последствиям.
Могут возникнуть:
- отклонения со стороны нервной системы (ЦНС);
- проблемы с почками и печенью;
- заболевания щитовидной железы;
- нарушение дыхание, пневмония;
- поражение плода во время беременности.
Симптомы отравления ртутью
Если разбился градусник в квартире, необходимо срочно позаботиться, чтобы убрать все кусочки стекла и частички ртути. Контакт с самой ртутью практически не опасен, но если вдыхать пары ртути, то можно нанести своему организму большой вред. В зависимости от концентрации вещества в воздухе могут проявиться неприятные симптомы, которые должны насторожить.
К ним можно отнести:
- сильное переутомление при стандартных нагрузках;
- сонливость;
- вялость;
- головокружения или головные боли;
- тремор в руках (дрожание);
- повышенная потливость;
- пониженное артериальное давление;
- апатия, депрессивные состояния;
- бессонница.
При появлении нескольких из вышеописанных симптомов, необходимо незамедлительно обратиться к врачу, а также в специальные службы, которые проведут измерение специальными приборами концентрации паров опасного вещества у вас дома. Как собрать ртуть из разбитого градусника? Какие предметы нужно подготовить и как защитить себя во время этого процесса? Этими вопросами задаются все, кто хотя бы раз разбил градусник. О том, как правильно убрать опасное вещество, немного ниже.
Первая помощь при отравлении ртутью
Если вы разбили градусник, и подозреваете, что произошло отравление ядовитым веществом, необходимо немедленно обратиться в лечебное учреждение. Лечение интоксикации, вызванной парами ртути, проводится только стационарно, поэтому следует вызвать неотложку.
До приезда скорой можно немного облегчить состояние отравившегося человека.
Если он находится в сознании, следует действовать так:
- Обеспечить покой, полный постельный режим.
- Предоставить максимальный доступ свежего воздуха.
- Провести промывание желудка.
- Вызвать рвоту.
- Принять активированный уголь исходя из расчета 1 драже на 10 кг веса;
- Обеспечить обильное питье.
Если отравившийся находится без сознания, то его нужно уложить набок и обеспечить доступ свежего воздуха в помещение. Следует контролировать состояние языка пациента, чтобы избежать его западания.
Химические свойства
Характерные степени окисления
| Степень окисления | Оксид | Гидроксид | Характер | Примечания |
|---|---|---|---|---|
| +1 | Hg2O | <Hg2(OH)2 или
Hg2O•H2O>* |
Слабоосновный | Склонность к диспропорционированию |
| +2 | HgO | <Hg(OH)2>** | Очень слабое основание, иногда — амфотерный |
- *Гидроксид не получен, существуют только соответствующие соли.
- **Гидроксид существует только в очень разбавленных (<10−4моль/л) растворах.
Диаграмма Пурбе системы Hg-HgO
Для ртути характерны две степени окисления: +1 и +2. В степени окисления +1 ртуть представляет собой двухъядерный катион Hg22+ со связью металл-металл. Ртуть — один из немногих металлов, способных формировать такие катионы, и у ртути они — самые устойчивые.
В степени окисления +1 ртуть склонна к диспропорционированию. Оно протекает при нагревании:
-
- Hg22+→Hg+Hg2+{\displaystyle {\mathsf {Hg_{2}^{2+}\rightarrow Hg+Hg^{2+}}}}
подщелачивании:
-
- Hg22++2OH−→Hg+HgO+H2O{\displaystyle {\mathsf {Hg_{2}^{2+}+2OH^{-}\rightarrow Hg+HgO+H_{2}O}}}
добавлении лигандов, стабилизирующих степень окисления ртути +2.
Из-за диспропорционирования и гидролиза гидроксид ртути (I) получить не удаётся.
На холоде ртуть +2 и металлическая ртуть, наоборот, сопропорционируют. Поэтому, в частности, при реакции нитрата ртути (II) со ртутью получается нитрат ртути (I):
-
- Hg+Hg(NO3)2→Hg2(NO3)2{\displaystyle {\mathsf {Hg+Hg(NO_{3})_{2}\rightarrow Hg_{2}(NO_{3})_{2}}}}
В степени окисления +2 ртуть образует катионы Hg2+, которые очень легко гидролизуются. При этом гидроксид ртути Hg(OH)2 существует только в очень разбавленных (<10−4моль/л) растворах. В более концентрированных растворах он дегидратируется:
-
- Hg2++2OH−→HgO+H2O{\displaystyle {\mathsf {Hg^{2+}+2OH^{-}\rightarrow HgO+H_{2}O}}}
В очень концентрированной щёлочи оксид ртути частично растворяется с образованием гидроксокомплекса:
-
- HgO+OH−+H2O→Hg(OH)3−{\displaystyle {\mathsf {HgO+OH^{-}+H_{2}O\rightarrow ^{-}}}}
Ртуть в степени окисления +2 образует уникально прочные комплексы со многими лигандами, причём как жёсткими, так и мягкими по теории ЖМКО. С йодом (-1), серой (-2) и углеродом она образует очень прочные ковалентные связи. По устойчивости связей металл-углерод ртути нет равных среди других металлов, поэтому получено огромное количество ртутьорганических соединений.
Из элементов IIБ группы именно у ртути появляется возможность разрушения очень устойчивой 6d10 — электронной оболочки, что приводит к возможности существования соединений ртути(IV), но они крайне малоустойчивы, поэтому эту степень окисления скорее можно отнести к курьёзной, чем к характерной. В частности, при взаимодействии атомов ртути и смеси неона и фтора при температуре 4 К получен HgF4. Однако более новые исследования не подтвердили его существование.
Свойства металлической ртути
Ртуть — малоактивный металл. Она не растворяется в растворах кислот, не обладающих окислительными свойствами, но растворяется в царской водке с образованием тетрахлорортутной кислоты:
-
- 3Hg+2HNO3+12HCl→3H2HgCl4+2NO↑+4H2O{\displaystyle {\mathsf {3Hg+2HNO_{3}+12HCl\rightarrow 3H_{2}+2NO\uparrow +4H_{2}O}}}
и азотной кислоте:
-
- Hg+4HNO3→Hg(NO3)2+2NO2↑+2H2O{\displaystyle {\mathsf {Hg+4HNO_{3}\rightarrow Hg(NO_{3})_{2}+2NO_{2}\uparrow +2H_{2}O}}}
Также с трудом растворяется в серной кислоте при нагревании, с образованием сульфата ртути:
-
- Hg+2H2SO4→HgSO4+SO2↑+2H2O{\displaystyle {\mathsf {Hg+2H_{2}SO_{4}\rightarrow HgSO_{4}+SO_{2}\uparrow +2H_{2}O}}}
При растворении избытка ртути в азотной кислоте на холоде образуется нитрат диртути Hg2(NO3)2.
При нагревании до 300 °C ртуть вступает в реакцию с кислородом:
-
- 2Hg+O2→300∘C2HgO{\displaystyle {\mathsf {2Hg+O_{2}{\xrightarrow {300^{\circ }C}}2HgO}}}
При этом образуется оксид ртути(II) красного цвета. Эта реакция обратима: при нагревании выше 340 °C оксид разлагается до простых веществ.
-
- 2HgO→>340∘C2Hg+O2↑{\displaystyle {\mathsf {2HgO{\xrightarrow {>340^{\circ }C}}2Hg+O_{2}\uparrow }}}
Реакция разложения оксида ртути исторически является одним из первых способов получения кислорода.
При нагревании ртути с серой образуется сульфид ртути(II):
-
- Hg+S→t∘CHgS{\displaystyle {\mathsf {Hg+S{\xrightarrow {t^{\circ }C}}HgS}}}
Ртуть также реагирует с галогенами (причём на холоде — медленно).
Ртуть можно окислить также щелочным раствором перманганата калия:
-
- Hg+2KMnO4+3KOH→KHg(OH)3+2K2MnO4{\displaystyle {\mathsf {Hg+2KMnO_{4}+3KOH\rightarrow K+2K_{2}MnO_{4}}}}
и различными хлорсодержащими отбеливателями. Эти реакции используют для удаления металлической ртути.
Словенский город Идрия — крупнейший в Европе центр добычи ртути с XV века
Страны-лидеры в ртутной промышленности
В наши дни, лидирующие позиции в мировой добыче ртутной руды, занимают такие страны:
- Испания;
- Канада;
- Мексика;
- Италия;
- США;
- Турция;
- Япония;
- Филиппины;
- Алжир и некоторые страны постсоветского пространства.
Государства бывшего СССР, в которых есть крупные разработки ртутьсодержащей руды – это Казахстан, Украина, Таджикистан, Киргизия, Российская Федерация и Узбекистан.
Большинство стран, которые занимаются добычей ртути, не используют её в собственной промышленности. Основными потребителями мировых запасов этого жидкого металла являются следующие страны: Соединённые Штаты Америки, Япония, Великобритания, Франция и Германия, поскольку это крупные промышленные центры.
Токсикология ртути
Основная статья: Отравление ртутью
| NFPA 704 для данного вещества (синее — опасность для здоровья, красное — огнеопасность, жёлтое — реакционноспособность) |
Ртуть и многие её соединения ядовиты. Воздействие ртути — даже в небольших количествах — может вызывать серьёзные проблемы со здоровьем и представляет угрозу для внутриутробного развития плода и развития ребёнка на ранних стадиях жизни.
Ртуть может оказывать токсическое воздействие на нервную, пищеварительную и иммунную системы, а также на легкие, почки, кожу и глаза.
ВОЗ рассматривает ртуть в качестве одного из десяти основных химических веществ или групп химических веществ, представляющих значительную проблему для общественного здравоохранения.
Наиболее ядовиты пары́ и растворимые соединения ртути. Сама металлическая ртуть менее опасна, однако она постепенно испаряется даже при комнатной температуре. Пары могут вызвать тяжёлое отравление. Ртуть и её соединения (сулема, каломель, киноварь, цианид ртути) поражают нервную систему, печень, почки, желудочно-кишечный тракт, при вдыхании — дыхательные пути (а проникновение ртути в организм чаще происходит именно при вдыхании её паров, не имеющих запаха). По классу опасности ртуть относится к первому классу (чрезвычайно опасное химическое вещество). Опасный загрязнитель окружающей среды, особенно опасны выбросы в воду, поскольку в результате деятельности населяющих дно микроорганизмов происходит образование растворимой в воде и токсичной метилртути, накапливающейся в рыбе. Ртуть — типичный представитель кумулятивных ядов.
Органические соединения ртути (диметилртуть и др.) в целом намного токсичнее, чем неорганические, прежде всего из-за их липофильности и способности более эффективно взаимодействовать с элементами ферментативных систем организма.
Гигиеническое нормирование концентраций ртути
Предельно допустимые уровни загрязнённости металлической ртутью и её парами[источник не указан 1011 дней]:
- ПДК в населённых пунктах (среднесуточная) — 0,0003 мг/м³
- ПДК в жилых помещениях (среднесуточная) — 0,0003 мг/м³
- ПДК воздуха в рабочей зоне (макс. разовая) — 0,01 мг/м³
- ПДК воздуха в рабочей зоне (среднесменная) — 0,005 мг/м³
- ПДК сточных вод (для неорганических соединений в пересчёте на двухвалентную ртуть) — 0,005 мг/л
- ПДК водных объектов хозяйственно-питьевого и культурного водопользования, в воде водоёмов — 0,0005 мг/л
- ПДК рыбохозяйственных водоёмов — 0,00001 мг/л
- ПДК морских водоёмов — 0,0001 мг/л
Демеркуризация
Основная статья: Демеркуризация
Очистка помещений и предметов от загрязнений металлической ртутью и источников ртутных паров называется демеркуризацией. В быту самой частой ситуацией для демеркуризации является ртуть, вылившаяся из разбитого ртутного термометра, что не представляет серьёзной опасности, но требует аккуратности и соблюдения правил безопасности. Необходимо аккуратно собрать все раскатившиеся шарики ртути (например, сложить на влажное бумажное полотенце, собирать удобно пипеткой, можно кисточкой, можно широким скотчем), нужно внимательно осмотреть самые дальние углы комнаты. Затем сложите всё, что касалось ртути, в пакет с молнией и закройте его, положите в другой пакет с молнией и его тоже закройте (на случай, если один из них порвётся), после чего позвоните по номеру 112 в единую дежурную диспетчерскую службу и выясните, куда нужно сдавать собранную ртуть, и сдайте её на переработку. Также необходимо будет проветрить помещение в течение суток (открыть окна). Выбрасывать ртуть в бытовой мусор или сливать в канализацию нельзя. Также нельзя использовать пылесос для сбора ртути — он разобьёт ртуть на мельчайшие капли и ускорит её испарение, тем самым концентрация паров ртути повысится вплоть до опасного уровня.
Запрет использования содержащей ртуть продукции
Основная статья: Минаматская конвенция о ртути
С 2020 года международная конвенция, названная в память массового отравления ртутью и подписанная многими странами, запретит производство, экспорт и импорт нескольких различных видов ртутьсодержащих продуктов, применяемых в быту, в том числе электрических батарей, электрических выключателей и реле, некоторых видов компактных люминесцентных ламп (КЛЛ), люминесцентных ламп с холодным катодом или с внешним электродом, ртутных термометров и приборов измерения давления. Конвенция вводит регулирование использования ртути и ограничивает ряд промышленных процессов и отраслей, в том числе горнодобывающую (особенно непромышленную добычу золота), производство цемента.
Примечания
- ↑ (англ.). WebElements. Дата обращения 17 августа 2013.
- ↑ Химическая энциклопедия : в 5 т. / Под ред. Н. С. Зефирова. — Москва : Советская энциклопедия, 1995. — Т. 4. — С. 278. — 639 с. — 20 000 экз. — ISBN 5—85270—039—8. — ISBN 5-82270-092-4 (т. 4).
- [www.electrik.info/main/fakty/132-pervye-shagi-k-otkrytiyu-sverxprovodimosti.html Первые шаги к открытию сверхпроводимости. К 250-летию открытия замерзания ртути]
- Вольфсон, Ф. И. Главнейшие типы рудных месторождений / Ф. И. Вольфсон, А. В. Дружинин. — М. : Недра, 1975. — 392 с.
- Эглестонит — статья из Геологического словаря: т.2. — М.: Недра. Под редакцией К. Н. Паффенгольца и др.. 1978.
- . wiki.web.ru. Дата обращения 6 ноября 2019.
- ↑ Венецкий С.И. Серебряная вода // Рассказы о металлах.. — Москва, 1979. — С. 208—209. — 240 с. — 60 000 экз.
- H.L. Clever. (англ.). IUPAC SOLUBILITY DATA. NIST (1987). Дата обращения 29 сентября 2017.
- Рассчитано по данным, взятым из: Справочник химика. — Т. 3. — М.; Л.: Химия, 1965.
- Реми Г. Курс неорганической химии. — Т. 2. — М.: Мир, 1966.
- Государственная фармакопея российской федерации. — Научный центр экспертизы средств медицинского применения, 2008.
- Закусов В. В. Фармакология. — М.: Медицина, 1966.
- . www.medical-enc.ru. Дата обращения 18 февраля 2017.
- Ртуть // : / гл. ред. А. М. Прохоров. — 3-е изд. — М. : Советская энциклопедия, 1969—1978.
- Приборостроение и автоматизация. Справочник. Изд. «Машиностроение» М. 1964
- . chem21.info. Дата обращения 31 марта 2018.
- ↑
Физические свойства и значение
Ртуть (Hg) — тяжёлый серебристый металл, который при нормальных условиях находится в жидком состоянии. Легко образует сплавы (амальгамы) с другими металлами, и это делает её ценной для добычи и обработки золота. В сравнении с другими металлами ртуть — плохой проводник тепла, но отличный проводник электричества. Наиболее известные и используемые соединения:
- Хлорид HgCl2 — сулема, сильный яд.
- Хлорид Hg2Cl2 — каломель, применяется в медицине.
- Гремучая ртуть Hg (ОНК)2 — детонатор, используется для производства взрывчатых средств.
- Сульфид HgS — киноварь, высокосортный пигмент.

В металлической форме традиционно используется в термометрах и специальных типах электрических переключателей. Разгерметизация подобных устройств связана с риском испарения некоторой части жидкого металла, поэтому использование элементарной ртути в бытовых приборах сокращают. В промышленности она незаменима как единственный жидкий металл. Например, в качестве электрода при производстве хлора и гидроксида натрия электролизом из раствора. Основные характеристики металлической формы выглядят так:
- атомный номер — 80;
- плотность — 13,5336 г/м3;
- температура плавления — -38C;
- температура кипения — 356,73C.

Заметное увеличение концентрации ртути в окружающей среде происходит благодаря человеческой деятельности. Бо́льшая часть выбрасывается в атмосферу после сгорания ископаемого топлива в результате работы горнодобывающей промышленности и сжигания твёрдых отходов. Непосредственное попадание в почвы и мировой океан связано с применением сельскохозяйственных удобрений и утилизацией промышленных сточных вод.