Технология электролиза алюминия
Содержание:
- Растворение алюминия в электролите
- Создание глинозема из руд — этап производства алюминия
- Хлорид магния
- Нарушения, вызванные неудовлетворительным состоянием анода
- Создание из глинозема алюминия при производстве также проходит в несколько этапов.
- Электролиз Холла – Эру.
- Применение алюминия
- Алюминий – материал будущего
- Из чего производят алюминий?
- Теоретические основы электротермического восстановления алюминия и кремния
- Развитие и размещение алюминиевой промышленности в мире
- Процесс Байера.
- Производство и применение алюминия
- Фторид магния
- Технология производства
Растворение алюминия в электролите
Металлический алюминий растворяется в расплавленном электролите незначительно (порядка 0,1%). Однако, распространяясь по всему объему электролита, алюминий окисляется на его поверхности кислородом воздуха, а также реагирует с анодными газами, образуя Аl2O3 и вызывая тем самым растворение новых порций металла в электролите. Растворимость алюминия в электролите, а следовательно, окисление металла сильно возрастает с уменьшением межполюсного расстояния и с повышением температуры. В связи с этим стремятся вести процесс при возможно низкой температуре, но не уменьшая чрезмерно межполюсное расстояние.
Создание глинозема из руд — этап производства алюминия
Глинозем можно получить тремя методами: кислотным, щелочным и электролитическим. Самым популярным является щелочной метод. Суть метода заключается в том, что алюминиевые растворы очень быстро начинают разлагаться при введении гидроокиси алюминия, а раствор, который остался от разложения после выпаривания при интенсивном перемешивании при температуре 170 С, может снова растворить глинозем, который содержится в бокситах. Данный способ имеет такие главные стадии:
1. Подготовка боксита, которая подразумевает его дробление и измельчение в специальных мельницах. В мельницы отправляют едкую щелочь, боксит и немного извести. Пульпу, которая получилась, направляют на выщелачивание.
2. Выщелачивания боксита подразумевает его химическое разложение от соединения с водным раствором щелочи. При этом гидраты окиси алюминия при соединении со щелочью в раствор переходят в форме алюмината натрия, а кремнезем, который содержится в боксите, соединяясь со щелочью, в раствор переходит в форме силиката натрия. В растворе эти соединения: алюминат натрия и силикат натрия формируют нерастворимый натриевый алюмосиликат. В этот остаток переходят окислы железа и титана, которые предают остатку красный оттенок. Такой остаток – это красный шлам. Когда растворение полученного алюмината натрия завершается, его разводят водным раствором щелочи при понижении температуры до 100°С.
3. Отделение красного шлама и алюминатного раствора друг от друга происходит благодаря промывке в сгустителях. После чего красный шлам оседает, а оставшийся алюминатный раствор фильтруют.
4. Разложение алюминатного раствора. Его фильтруют и отправляют в крупные емкости с мешалками. Из данного раствора при охлаждении до 60°С и перемешивании постоянном выделяется гидроокись алюминия. Из-за того что процесс протекает неравномерно и очень медленно, а рост кристаллов гидроокиси алюминия очень важен при дальнейшей обработке, то в эти емкости с мешалками — декомпозеры ещё добавляют много твердой гидроокиси.
5. Получение гидроокиси алюминия осуществляется в вакуум-фильтрах и гидроциклонах. Большую часть гидроокиси как затравочный материал возвращают к процедуре декомпозиции. После водной промывки остаток отправляется на кальцинацию; и фильтрат тоже возвращается в процесс.
6. Обезвоживание гидроокиси алюминия — завершающая стадия производства глинозема. Она проходит в трубчатых, постоянно вращающихся печах. Сырая гидроокись алюминия, когда проходит через печь, полностью высушивается и обезвоживается.
Хлорид магния
Существенно понижает температуру плавления и вязкость электролита. Однако применение-его затруднено из-за склонности соли к гидролизу, при котором вместе с добавкой MgCl2 вносится в электролит значительное количество влаги, что недопустимо с позиций техники безопасности.
На некоторых заводах применяют совместные добавки NaCl и MgF2, при этом происходит повышение-электропроводимости электролита за счет введения катионов Na+ и заметное снижение расхода углерода,
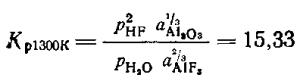
Эти величины давлений получены при условии, когда pHF + pH2O= 101,3 кПа.
Глинозем, поступающий в электролит, обычно прокаливается на корке, и основная масса воды удаляется, поэтому потери фторида алюминия относительно невелики: если считать, что в глиноземе останется 0,1% (по массе) воды, то на 1 т алюминия за счет реакции гидролиза будет затрачиваться всего 1,8 кг фтористого алюминия.
Источниками влаги являются также водород и углеводороды, образующиеся при коксовании анодной массы. Вода образуется по реакции Н2 + СO2 = Н2O + СО Если допустить, что вся эта влага реагирует с фтористым алюминием, то потери его составят уже 19 кг на 1 т алюминия. На самом деле часть воды растворяется в электролите и подвергается электролитическому разложению с выделением на катоде водорода, который растворяется в алюминии. При литье алюминиевых, слитков водород вследствие понижения его растворимости выделяется в виде пузырьков, и качество отливок ухудшается. Для электролизеров с обожженными анодами этот источник влаги отсутствует.
Нарушения, вызванные неудовлетворительным состоянием анода
Часто приводят к серьезным расстройствам технологии электролиза. К ним относятся: рас-
слоение анода на ваннах БТ и ВТ, образование шеек на боковой поверхности анода, т. е. выгорание этой поверхности, протеки пека на электролизерах ВТ, отрыв блоков от несущей штанги на электролизерах OA, перекосы анодов.
Расслоение анодов на ваннах ВТ и БТ вызывается нарушениями в технологии формирования анода, о которых говорилось выше. При расслоениях анод теряет прочность, и в процессе обработки ванны от него могут отколоться крупные куски, что приведет к повышению анодной плотности тока и к перегреву электролита. В тех местах, где откололись значительные куски (обычно на углах анода), электролитную корку засыпают большим слоем глинозема, чтобы уменьшить потери тепла, и корку здесь не вскрывают, чтобы не создать больших осадков глинозема. Последствия этого нарушения устраняются только после полного израсходования неисправной части анода и восстановления его нормального сечения.
Шейки на аноде выгорают особенно сильно при горячем ходе, а также если боковая поверхность анода не оплескивается электролитом. Выгорание шеек на ваннах ВТ может привести к оголению некоторых штырей наружного ряда. В таких случаях снимают секцию анодного колокола, на уровне нижней кромки анодного кожуха устанавливают горизонтально стальной лист и в пространство между кожухом и анодом заливают жидкую анодную массу. В результате коксования этой массы выгоревшее пространство анода восстанавливается.
Протеки пека через трещины в анодах ванн ВТ приводят к тому, что в этих местах на подошве образуются выступы («конусы»), которые, как уже упоминалось, могут привести к местным перегревам электролита.
На электролизерах OA основные нарушения в работе анодного массива связаны с оплавлением ниппелей при чрезмерно большой силе тока, приходящейся на отдельный блок, или при слишком малой толщине огарка, т. е. когда ниппель попадает в электролит. Если верхняя часть блока сильно выгорела, это может привести к обрыву блока и падению его в электролит.
Создание из глинозема алюминия при производстве также проходит в несколько этапов.
1. Электролиз окиси алюминия происходит при температуре в электролизере — 970°С. Электролизер имеет футерованную углеродистыми блоками ванну, к которой подключается электрический ток. Выделившийся жидкий алюминий собирается на угольном основании, и оттуда его регулярно откачивают. В электролит сверху погружены угольные аноды, сгорающие в атмосфере кислорода, который выделяется из окиси алюминия, и при этом выделяетс я окись или двуокись углерода.
2.Электролиз хлорида алюминия осуществляется путем превращения окиси алюминия в реакционном сосуде в хлорид алюминия. После чего в изолированной ванне осуществляется электролиз хлорида алюминия. Хлор, который при этом выделился, отсасывается и направляется для вторичного использования. А алюминий выпадает в осадок на катоде.
3.Восстановление марганцем хлорида алюминия, при этом освобождается алюминий. За счет управляемой конденсации выделяются загрязнения, связанные с хлором, из потока хлорида марганца. Когда происходит освобождение хлора, хлорид марганца превращается в окись марганца, которая потом восстанавливается до состояния марганца, который пригоден к вторичному использованию.
Электролиз Холла – Эру.
Заключительная стадия производства алюминия включает его электролитическое восстановление из чистой окиси алюминия, полученной в процессе Байера. Этот способ извлечения алюминия основывается на том (открытом Холлом и Эру) факте, что когда глинозем растворяется в расплавленном криолите, при электролизе раствора выделяется алюминий. Типичный электролизер Холла – Эру представляет собой ванну с расплавленным криолитом 3NaF Ч AlF3 (Na3AlF6) – двойным фторидом натрия и алюминия, в котором растворено 3–5% глинозема, – плавающим на подушке из расплавленного алюминия. Стальные шины, проходящие через подину из углеродистых плит, используются для подачи напряжения на катод, а подвешенные угольные бруски, погруженные в расплавленный криолит, служат анодами. Рабочая температура процесса близка к 950° С, что значительно выше температуры плавления алюминия. Температура в электролизной ванне регулируется изменением зазора между анодами и катодным металлоприемником, на который осаждается расплавленный алюминий. Для поддержания оптимальной температуры и концентрации глинозема в современных электролизерах применяются сложные системы управления. На производство алюминия расходуется очень много электроэнергии, поэтому энергетический КПД процесса – главная проблема в алюминиевой промышленности. Электродные реакции представляют собой восстановление алюминия из его окиси и окисление углерода до его окиси и двуокиси на анодах. Одна печь дает до 2,2 т алюминия в сутки. Металл сливается раз в сутки (или реже), потом флюсуется и дегазируется в отражательной копильной печи и разливается по формам.

Применение алюминия
Металл стал пользоваться большим спросом в то время, когда развивалась авиационная промышленность. Развитие самолетостроения, а затем и космической отрасли, подталкивали к увеличению производства алюминия. Именно в то время его стали называть «крылатый металл». Сам по себе алюминий мягкий и пластичный металл. Однако в сплаве с магнием или цинком и после термической обработки он обретает значительную прочность, которая сравнима с прочностью конструкционной стали с низким содержанием углерода. При этом алюминий легче стали в 2,9 раз. Вот почему космические корабли создаются, а небоскребы строятся с использованием материалов на основе алюминия.
Алюминий – материал будущего
Разработка метода получения чистого алюминия из боксита с помощью процесса Байера и электролиза Холла-Эру расширила область применения этого элемента. Кроме того, сочетание высокой прочности с легкостью позволило в некоторых случаях заменить алюминием более дорогую сталь. Устойчивость к воздействию атмосферных факторов дала возможность использовать алюминий в производстве оконных и дверных профилей. Еще одним преимуществом алюминия является возможность подвергать его многократной вторичной переработке, благодаря чему он считается относительно дружественным окружающей среде материалом.
Из чего производят алюминий?
Чистый алюминий не встречается в природе из-за его способности к пассивации. Это явление заключается в окислении металла в присутствии воздуха, в результате чего на его поверхности образуется пассивный защитный слой. Алюминий покрывается слоем оксида алюминия (Al2O3) толщиной до нескольких нм. Затем, под воздействием влаги внешний слой подвергается частичному гидролизу, в результате чего дополнительно образуется гидроксид, т.е. Al(OH)3.
Алюминий входит в состав разных минеральных пород, встречающихся в природе в виде руд. Для производства чистого алюминия используется, прежде всего, глинистая бокситовая руда. Она образуется в основном в местах выветривания алюмосиликатных пород в жарком климате и содержит также соединения железа. Это порода с характерным красным или коричневым цветом, которая встречается в двух видах: силикатном и карбонатном.
Теоретические основы электротермического восстановления алюминия и кремния
Восстановление оксида алюминия в условиях электротермии можно описать тремя суммарными реакциями:
Аl2О3+3С = 2Аl + 3СО, (85)
2Аl2О3+ 9С = Аl4С3 + 6СО , (86)
Аl2О3+ Аl4С3= 6Аl + 3СО . (87)
Величины энергии Гиббса для этих реакций (рис. 66) становятся отрицательными (т. е. реакция оказывается вероятной) при температурах: для реакции (85) — 2296 К; для реакции (86) — 2240 К и для (87) — 2370 К.
Таким образом, наиболее вероятной при высоких температурах процесса является реакция (86) — образование карбида алюминия; менее вероятна реакция восстановления оксида до металла—(85). Но продукты этих двух реакций — карбид алюминия и алюминий растворимы друг в друге и образуют весьма тугоплавкие смеси. Кроме того, Аl4С3 растворяется в Аl2О3, поэтому в результате восстановления оксида алюминия углеродом получаются смеси алюминия, карбида и оксида, имеющие высокие температуры плавления. Выпустить такую массу из печи обычно не представляется возможным. Необходимо иметь в виду, что на самом деле процесс сопровождается еще и образованием промежуточного продукта — субоксида алюминия Аl2О, обладающим высоким давлением насыщенного пара. При температурах процесса — около 2000 °С имеет значение также испарение металлического алюминия. Все эти обстоятельства исключают возможность получения алюминия восстановлением его оксида углеродом. Реакция восстановления оксида кремния
SlО2+2C = Si + 2CO
(88)
в заметной степени протекает при температуре 1727°С, когда ΔG становится отрицательной. При более низкой температуре 1527°С начинается реакция карбидообра-зования:
SiO2 + 3C = SiC + 2СО,
(89)
Образовавшийся карбид кремния вступает в реакцию с оксидом или монооксидом и образуется кремний: 2SiC + SiО2 = 3Si + 2CO, SiC + SiO = 2Si + CO.
Рассмотрим последовательность реакций совместного восстановления оксидов кремния и алюминия, например кианита (Al2О3·SiО2).
В интервале температур 1197—1527°С происходит процесс муллитизации, т. е. перехода кианита в муллит 2Al2О3·2SiО2. Затем при 1527—1577 °С идет реакция (89) образования карбида кремния. Дальнейшее повышение температуры приводит к восстановлению оксида алюминия как углеродом — реакция (85), так и карбидом кремния и кремнием: Al2О3 + SiC = Al2О + SiO + + СО, Al2О3 + 2Si = Al2О + 2SiO. Получающиеся по этой реакции субоксиды алюминия и кремния окончательно восстанавливаются до металлов при 1827—1927 °С:
SiO + SiC = 2Si + CO, (90)
Al2О +С = 2Аl+ СО, (91)
Аl2О + Si = 2Аl + SiO . (92)
Карбид алюминия, который получается по реакции (86), также реагирует с кремнием с образованием алюминия и карбида кремния: Al4C3 + 3Si = 4Al + 3SiC. Образование карбида алюминия идет медленнее, чем восстановление оксида до металла, поэтому условием успешного проведения процесса является быстрый нагрев шихты до температуры 1900°С и высокая реакционная способность углеродистого восстановителя. Продукт восстановления — силикоалюминий должен быть выведен из зоны реакции возможно быстрее, иначе произойдет образование карбида алюминия: 4Аl + 3С = Аl4С3. Необходимы также повышенная газопроницаемость и тугоплавкость шихты, способствующие тепло-и массообмену по объему ванны печи. Следовательно, основное, что определяет возможность получения сплавов Аl—Si — это понижение в них активности алюминия.
Развитие и размещение алюминиевой промышленности в мире
Сырьевая база
Основные мировые месторождения, на которых добывают бокситы
Боксит является основным минеральным сырьём для алюминиевой промышленности. Его запасы в мире распределены очень неравномерно и ограничены. В мире существует семь бокситоносных районов:
- Западная и Центральная Африка (основные залежи в Гвинее);
- Южная Америка: Бразилия, Венесуэла, Суринам, Гайана;
- Карибский регион: Ямайка;
- Океания и юг Азии: Австралия, Индия;
- Китай;
- Средиземноморье: Греция и Турция;
- Урал (Россия).
По данным Геологической службы США мировые ресурсы бокситов оцениваются в 55 — 75 млрд т, которые распределяются между отдельными регионами следующим образом: Африка — 32 %, Океания — 23 %, Южная Америка и страны Карибского бассейна — 21 %, Азия — 18 %, прочие регионы — 6 %. В целом мировые запасы природных ресурсов бокситов достаточны для удовлетворения мировых потребностей в алюминии в течение продолжительного времени.
Понимая важность сырьевой базы, крупнейшие производители алюминия в мире поделили основные месторождения бокситов высокого качества с содержанием глинозёма не менее 50 %. Другим компаниям остается либо приобретать глинозём на открытом рынке и быть всецело зависимыми от рыночного колебания цен, либо объединять усилия с владельцами месторождений.
Основные производители алюминия в мире
Производство первичного алюминия по континентам земного шара
Крупнейшие производители алюминия в мире
Панорама Богословского алюминиевого завода в городе Краснотурьинске
Список стран, крупнейших производителей алюминия
Основная статья: Список стран по выплавке алюминия
По данным Геологической службы США крупнейшими производителями алюминия в мире явились следующие страны:
| Место | Страна | Производство алюминия в 2016 году, тыс. тонн | Годовые производственные мощности, тыс. тонн |
|---|---|---|---|
| 1 | Китай | 31000 | 40100 |
| 2 | Россия | 3580 | 4180 |
| 3 | Канада | 3250 | 3270 |
| 4 | Индия | 2750 | 3850 |
| 5 | Объединённые Арабские Эмираты | 2400 | 2400 |
| 6 | Австралия | 1680 | 1720 |
| 7 | Норвегия | 1230 | 1550 |
| 8 | Бахрейн | 970 | 970 |
| 9 | Соединённые Штаты Америки | 840 | 1730 |
| 10 | Исландия | 800 | 840 |
| 11 | Бразилия | 790 | 1400 |
| 12 | Саудовская Аравия | 740 | 740 |
| 13 | Южно-Африканская республика | 690 | 715 |
| 14 | Катар | 640 | 640 |
| Весь мир | 57600 | 72500 |
Список компаний — крупнейших производителей алюминия
Десятка крупнейших компаний-производителей алюминия выглядит следующим образом:
| Место | Название компании | Страна | Объём производства, тыс. т |
|---|---|---|---|
| 1 | Русал, UС RUSAL | Россия, Швейцария | 4153 |
| 2 | Alcoa Inc. | США | 3965 |
| 3 | Alcan | Канада | 3454 |
| 4 | Aluminum Corporation of China Limited, CHALCO | Китай | 2034 |
| 5 | Årdal og Sunndal Verk, ASV (Hydro Aluminium) | Норвегия | 1576 |
| 6 | BHP Billiton | Австралия | 1349 |
| 7 | Dubai Aluminium Company Limited (DUBAL), | Объединённые Арабские Эмираты | 872 |
| 8 | Rio Tinto | Великобритания, Австралия | 864 |
| 9 | Aluminium Bahrain B.S.C. (Alba) | Бахрейн | 860 |
| 10 | Century Aluminum | США | 741 |
Самым крупным предприятием по производству алюминия является Братский алюминиевый завод, который первым в мире стал производить более 1 миллиона тонн алюминия в год. Завод производит 30 % российского алюминия и 4 % мирового. Завод потребляет 75 % электроэнергии, вырабатываемой Братской ГЭС.
Процесс Байера.
Процесс получения чистой окиси алюминия включает нагревание боксита с едким натром, фильтрование, осаждение гидроокиси алюминия и ее прокаливание для выделения чистого глинозема. На практике руда смешивается с нужным количеством горячего едкого натра в автоклаве из низкоуглеродистой стали, и смесь прокачивается через ряд стальных сосудов с паровой рубашкой. В сосудах поддерживается давление пара 1,4–3,5 МПа в течение времени от 40 мин до нескольких часов, пока не завершится переход окиси алюминия из боксита в раствор алюмината натрия в перегретой жидкости. После охлаждения твердый осадок отделяется от жидкости. Жидкость фильтруется; в результате получается пересыщенный чистый раствор алюмината. Этот раствор метастабилен: алюминат-ион разлагается с образованием гидроокиси алюминия. Добавление в раствор кристаллической гидроокиси алюминия, остающейся от предыдущего цикла, ускоряет разложение. Сухие кристаллы гидроокиси алюминия затем прокаливаются для отделения воды. Получающийся безводный глинозем пригоден для использования в процессе Холла – Эру. По экономическим соображениям в промышленности эти процессы стремятся делать по возможности непрерывными.
Производство и применение алюминия
Металлический алюминий получают электролизом раствора окиси алюминия, называемой глиноземом, в расплавленном криолите. Окись алюминия добывают из боксита путем длительной очистки, а криолит получают либо из природного минерала, либо искусственным путем, причем последний способ в настоящее время даже дешевле. Процесс ведут в электрических печах при температуре около 1000°, силе тока около 50 000 а и напряжении 4—5 в (рис. 81).
Применяется алюминий главным образом в виде сплавов с другими металлами, так как он слишком мягок. Наиболее распространенными сплавами являются силумин — сплав алюминия с кремнием, дюралюминий, в состав которого, помимо алюминия, входят небольшие количества магния, железа, меди, марганца, магналий — сплав алюминия с магнием. Все эти сплавы легкие и прочные. Силумин применяется главным образом для литья, дюралюминий и магналий — в самолетостроении, машиностроении, судостроении, для изготовления посуды. Алюминием покрывают поверхность стальных и железных изделий, что предохраняет их от коррозии. Для этого стальное изделие выдерживают некоторое время в расплавленном алюминии или нагревают в порошке алюминия, который образует на поверхности сплав с металлом.
Такие изделия не окисляются даже при высокой температуре. Этот способ предохранения металлов от окисления называется алитированием.
Рис. 81. Схема промышленной установки для получения алюминия электролизом. 1 — крепление для анода; 2— штырь для подключения к сети угольного анода; 3 —корка застывшего электролита; 4 — наружный кожух; 5 — кирпичные стенки; 6 —графитовая обкладка; 7, 8 —катод; 9 — расплавленный алюминий; 10 — расплавленный электролит.
Алюминий широко применяется для изготовления проводов в электротехнике и алюминиевых выпрямителей, алюминиевая пыль — как краска для имитации под серебро, алюминиевый порошок —при алюминотермической сварке металлов.
■ 91. Глинозем содержит 91,8% окиси алюминия. Сколько можно получить алюминия из 2 т глинозема, если выход алюминия составляет 80% теоретического? 92. Используя материал § 104 и 106, составьте и заполните таблицу. (См. Ответ)
| Свойства аллюминия | Использование алюминия, с учетом его свойств |
93. Используя материал § 105, составьте и заполните таблицу.
Свойства соединений алюминия
Формула соединения
Название
Встречается ли в природе и в виде какого минерала
Наиболее важное свойство
Примечание
Статья на тему Алюминий Свойства
Фторид магния
По некоторым данным, в системе NaF—MgF2 имеется еще одно соединение—Na2MgAlF7, что в значительной степени усложняет диаграмму состояния.
Добавка фтористого магния ухудшает смачивание расплавом угольных частиц и способствует полному отделению угольной «пены». Обычно в электролит вводят оксид магния, при этом фторид магния получается
| Таблица 4. Физико-химические свойства расплавленного криолита с добавками 10% (по массе) солей при 1000 °С | |||||
| Соль |
Понижение
температуры плав- ления, °С |
Плотность, г/см3 |
Удельная электропроводи-
мость, См/м |
Вязкость, мПа-с | Потери алюминия на 100 г расплава, г/ч |
|
Без добавок LiF
MgF2 CaF2NaCl MgCl2 |
—
80 59 25 44 92 |
2,100
2,060 2,106 2,162 2,010 2,020 |
270
340 255 265 308 237 |
2,75
1,63 Нет св. 2,88 2,40 1,50 |
1,20
1,20 0,75 0,95 1,30 1,05 |
в результате реакции обмена 3MgO + 2Na3AlF6⇄3MgF2 + А12О3 + 6NaF.
Суммарное содержание фторидов кальция и магния обычно не превышает 6—8% (по массе).
Технология производства
Оценивая все вышесказанное, возникает вполне закономерный вопрос: почему люди производят медь уже давным-давно, хотя ее в природе гораздо меньше, чем алюминия, а этот металл получают недавно. Объяснение нужно искать в структуре руд и их химических особенностях. Если говорить про медь, то она иногда встречается в виде самородков, как золото, в которых содержание меди доходит до 99%. Из такого самородка при незначительном нагреве выплавляется металл, что было доступно еще с древности. К сожалению, сейчас медные самородки находится крайне редко и в промышленности используются руды содержанием меди 5% и меньше.
В отличие от меди, алюминий не встречается в самородном виде. Он является химически активным металлом, и вступает в реакцию с кислородом, многими кислотами и солями. Чтобы извлечь металл из этих соединений требуются сложные металлургические технологии.
Самая распространенная алюминиевая руда называется боксит. Она содержит до 60% оксида алюминия или глинозема. Первым этапом получения чистого металла является выщелачивание, в ходе которого боксит смешивается с содой и спекается. Полученное соединение сначала растворяют в воде, очищая от других примесей, а затем осаживают и выделяют из раствора. Осадок прокаливается в печах, и получается чистый оксид алюминия. Выход глинозема – до 85% от содержавшегося в руде. Глинозем достаточно устойчив к термическому воздействию, поэтому его растворяют в расплавленной соли, называемой криолит. Это позволяет снизить температуру процесса до 1000 °С. После чего через расплав пропускается электрический ток большой мощности, и алюминий оседает на одном из дне ванны, который является катодом в этом процессе. Расплавленный металл разливается в определенные формы и отправляется в прокатное производство.
Теперь можно со знанием дела сказать, что массовое производство алюминия стало возможным на только определенном этапе развития многих технологий. Первое, что надо отметить, с развитием химии, как науки, появился способ выделения металла из руды. Второй момент — инженеры и конструкторы создали оборудование, которое соответствовало всем необходимым требованиям. Плюс к этим составляющим появились мощные источники электрической энергии. Если говорить об экономической стороне дела, то производственные затраты делятся примерно на три части — сырье или глинозем, оборудование и электроэнергия. Затраты на электроэнергию составляют около 30%. Вот почему, как не трудно заметить, заводы по производству алюминия всегда строят поблизости от мощных электростанций.