Все, что следует знать о генной терапии
Содержание:
- Фармакокинетика
- ПЕРСОНАЛИЗИРОВАННАЯ МЕДИЦИНА
- Развитие концепции генотерапии
- Гемофилия и как ее лечат
- Редактирование генома
- Заключение
- Первый пошел: болезнь Гоше
- Лечение MLD
- Логическое обоснование генной терапии для лечения болезней человека
- Способы доставки в клетку генетической информации
- Примечания[править | править код]
- Неблагоприятные последствия экспрессии трансгенов
- Методы трансфекции клеток
Фармакокинетика
Доставка чужеродной ДНК и ее последующие преобразования в клетке-мишени не могут быть описаны обычными уравнениями фармакокинетики (гл. 1). Важны не только судьба собственно вводимой ДНК (например, объем распределения, скорость поступления в ткани), но и последствия изменения экспрессии генов и функции белков. Обязательно нужно учитывать следующее: 1) распределение введенной ДНК в тканях, 2) эффективность поглощения ДНК клетками-мишенями, 3) распределение ДНК между внутриклеточными органеллами, 4) скорость разрушения введенной ДНК,5) скорость транскрипции, 6) время жизни образующейся мРНК, 7) количество и стабильность синтезируемого белка, 8) распределение белка внутри клетки или уровень его секреции. Если учитывать все эти параметры, то можно (хотя пока еще — чисто теоретически) подбирать уровень трансфекции и экспрессии гена в соответствии с конкретными клиническими задачами. Во всяком случае, многокамерные фармакокинетические модели для генотерапии уже появились (Ledley and Ledley, 1994).
ПЕРСОНАЛИЗИРОВАННАЯ МЕДИЦИНА
Наследственных заболеваний огромное множество. Лечат их по-разному в зависимости от типа болезни. К примеру, нарушения метаболизма исправляют диетами, помогающими детоксикации организма. При дефектах белка вводят его внутривенно. Эта замещающая терапия лечит, к примеру, гемофилию и иммунодефицит. Иногда для компенсации утраченных функций трансплантируют костный мозг и другие органы. Такая терапия малоэффективна, а лечение длительное и дорогостоящее. Тем не менее, эти меры хоть как-то помогают облегчить участь пациентов.
Генотерапия — новейший способ борьбы с генетической причиной заболеваний. Он заключается во внедрении нормальных генов в больные соматические клетки. В отличие от клинической медицины, генная терапия искореняет недуг из ядра клетки, а не устраняет его следствия.

Поскольку отрасль новая, существует масса пробелов и рисков. Например, генотерапия может принести как пользу, так и вред, например, риск заболеть раком. Однако возможности генной терапии поистине безграничны. Это лечение болезни Паркинсона, кистозного фиброза, рака и многих других, казалось бы, неизлечимых заболеваний.
Так что же такое генная терапия? Давайте вспомним главную функцию генов в нашем организме. Они регулируют производство белков, которые нужны для правильной работы и здоровья клеток. Но некоторые генетические изъяны препятствуют выработке необходимых белков. Генная терапия же может помочь заменить дефективные гены на здоровые. Такие исправленные клетки будут делиться, производя себе подобные клетки со здоровой ДНК. Постепенно они позволят организму полностью излечиться.
3 подхода генной терапии:
- Активация генов организма, чтобы отключить ген-мутант.
- Фетальная генотерапия. Чужую ДНК вводят в эмбрион на ранней стадии развития. Информация остается в ДНК и передается следующим поколениям.
- Соматическая генотерапия. Дополнительные гены вводят в соматические клетки. «Отредактированные» гены не передаются потомкам, но состояние пациента улучшится.
Генная терапия может осуществляться по-разному:
Ex vivo. В этом случае клетки берут из организма пациента, модифицируют и вводят обратно. Этот метод хорош, когда клетки просто «достать» из тела и внедрить обратно. Например, при лечении заболеваний крови.
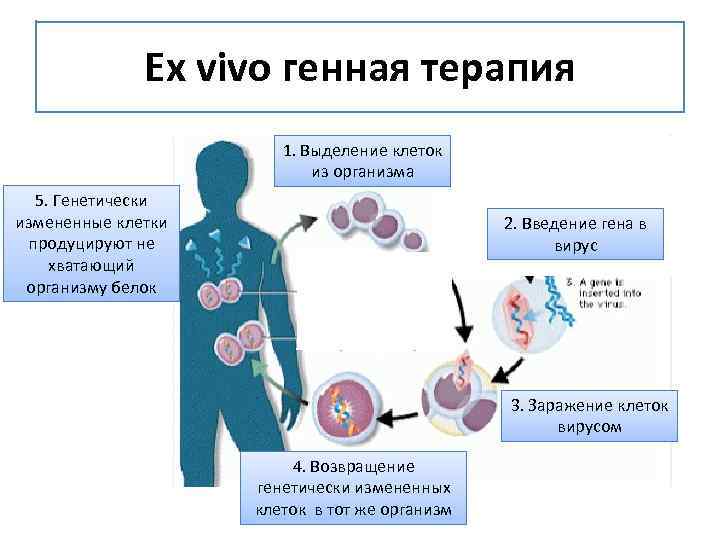
In vivo. Этот способ предполагает изменение генов внутри организма. Например, при лечении сердца клетки изъять непросто. Тогда гены доставляются туда при помощи молекул нуклеиновой кислоты. Иногда «курьерами» служат неопасные вирусы.
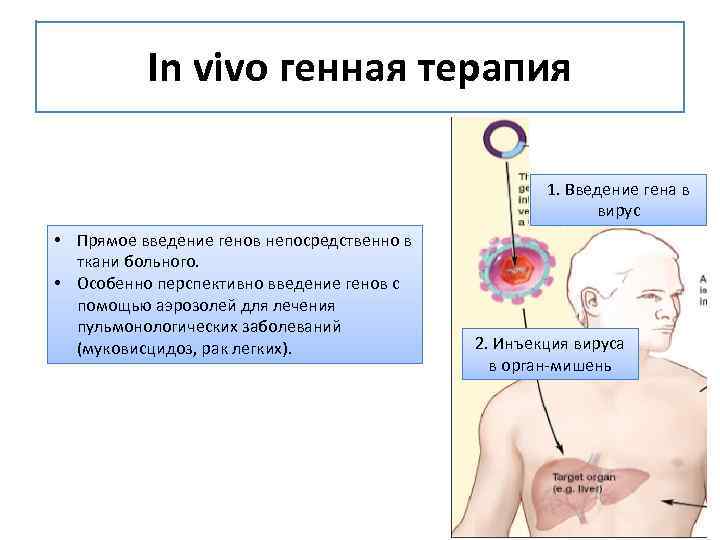
Вирусы — отличные помощники в доставке ДНК в клетки тела. Они запросто обходят иммунную защиту и легко перебираются от одной клетки к другой. Больше всего для этой цели подходят некоторые ретровирусы и аденовирусы.
Развитие концепции генотерапии
Концепция генотерапии, по-видимому, появилась сразу после открытия явления трансформации у бактерий и изучения механизмов трансформации клеток животных опухолеобразующими вирусами. Такие вирусы могут осуществлять стабильное внедрение генетического материала в геном клетки хозяина, поэтому было предложено использовать их в качестве векторов для доставки желаемой генетической информации в геном клеток. Предполагалось, что такие векторы могут в случае необходимости поправлять дефекты генома.
Реальностью генная коррекция соматических клеток стала после 1980-х годов, когда были разработаны методы получения изолированных генов, созданы эукариотические экспрессирующие векторы, стали обычными переносы генов у мышей и других животных.
Исторически генная терапия нацеливалась на лечение наследственных генетических заболеваний, однако поле её применения, по крайней мере теоретически, расширилось. В настоящее время генную терапию рассматривают как потенциально универсальный подход к лечению широкого спектра заболеваний, начиная от наследственных, генетических, и заканчивая инфекционными.
Гемофилия и как ее лечат
Свертывание крови поражает своей сложностью и изяществом. Мы разбирали его в статье «Как работает свертывание крови?» . — Ред.

Рисунок 1. Схема каскада коагуляции крови. Каскад в норме запускается в случае повреждения стенки кровеносного сосуда и заканчивается образованием белка фибрина — основного компонента кровяного сгустка. Такой сложный каскад со множеством регуляторов необходим потому, что для организма опасны как кровотечения, так и повышенная свертываемость крови, приводящая к тромбозам. При недостаточности или мутациях в факторе VIII развивается гемофилия А, в факторе IX — гемофилия В, в факторе XI — самый редкий вид, гемофилия С.
Заместительная терапия
Гемофилию лечат сегодня главным образом инъекционным введением пациентам недостающих факторов свертывания. Такая терапия называется заместительной и практикуется еще с 50-х годов прошлого века, при этом технология, на которой она основана, с тех пор претерпела значительные изменения и улучшения. Это было достигнуто благодаря введению более тщательного скрининга донорской крови (на присутствие вирусных патогенов), технологий концентрирования плазмы крови (для инфузий в меньшем объеме), и, наконец, клонированию генов факторов свертывания VIII и IX, позволившему создать рекомбинантные «версии» этих белков, имеющие более эффективный профиль эффективности и безопасности , .
Прочитать об этом можно в статье «Биомолекулы»: «Три поколения лекарств» .
Тем не менее заместительную терапию сейчас трудно назвать идеальной, ведь получающие такое лечение продолжают испытывать периодические кровотечения, им необходимы достаточно частые переливания (до трех процедур в неделю), а также неотложная помощь при кровотечениях, возникших в результате травм . Кроме того, у ряда пациентов, особенно с гемофилией А, вырабатываются нейтрализующие антитела к фактору свертывания, что делает инъекции неэффективными. Еще одна проблема — терапия факторами свертывания очень дорогая, ее стоимость составляет несколько сот тысяч долларов в год, а инъекции нужны пожизненно.
Сегодня появление такого лечения стало ближе, и возможно сейчас мы стоим на пороге терапевтической революции.
Редактирование генома
Данный обзор сфокусирован на усилительной генной терапии, в которой функциональный ген переносится в ткань-мишень для стимуляции экспрессии генного продукта, что оказывает терапевтический эффект (Рис.2).
Еще один привлекательный метод, находящийся на стадии разработки, — это редактирование генома, в котором мутация корректируется in situ, приводя к созданию в физиологически релевантной ткани-мишени копии гена дикого типа под контролем эндогенных регуляторных сигналов. Этот подход использует новые инструменты, в том числе нуклеазы цинковых пальцев, эффекторные нуклеазы, подобные активаторам транскрипции и CRISPR/Cas9 . Это различные типы специфичных к последовательности нуклеаз, которые осуществляют двухцепочечные разрывы в ДНК рядом с местом мутации, а затем используют донорную последовательность (шаблон) и клеточные механизмы репарации ДНК (например, гомологически направленную репарацию) для восстановления или коррекции функционирующего гена. Редактирование генома также может быть использовано для подавления экспрессии генов путем формирования мутаций сдвига рамки считывания в месте разрыва ДНК. Тем не менее, только в трёх клинических исследованиях генной терапии in vivo используется нуклеаза — для лечения гемофилии B (NCT02695160), мукополисахаридоза типа I (NCT02702115) и мукополисахаридоза типа II (NCT03041324). В данных случаях нуклеаза применяется не с целью коррекции мутации, а, скорее, для целенаправленной интеграции донорских кассет AAV в участки двухцепочечного разрыва ДНК в локусе альбумина. Выбор альбумина обоснован высокой транскрипционной активностью его промотора и возможностью использования локуса как безопасного участка для интеграции трансгена . Поскольку у взрослых периодичность обновления гепатоцитов относительно низка, и, следовательно, нет необходимости в интеграции векторов для достижения устойчивого уровня экспрессии после переноса гена , этот подход может найти лучшее применение в педиатрии. Однако, два основных способа применения редактирования генома ex vivo направлены на разрушение собственных пораженных генов больного, а не на интеграцию донорских последовательностей. В частности, нуклеазы цинковых пальцев и CRISPR (NCT03164135) применялись для разрушения корецептора ВИЧ-1 CCR5 и лечения ВИЧ-инфекции. Метод CRISPR также набирает обороты в модификации Т-клеток для иммунотерапии рака (NCT02793856).
Заключение
Стратегии переноса генов настолько мощны и универсальны, что лишь для нескольких серьезных заболеваний пока не разрабатываются методы переноса генов. Разработка новых классов терапевтических средств обычно занимает два-три десятилетия (например, моноклональные антитела и рекомбинантные белки). Тот же путь прошла генная терапия, внедренная в клинические испытания в начале 1990-х годов. Примеров клинического успеха в настоящее время достаточно, и подходы генной терапии, вероятно, будут становиться все более важными. Центральным вопросом является долгосрочная безопасность переноса генов, поэтому регулирующие органы требуют в течение 15 лет наблюдать за пациентами, участвовавшими в испытаниях генной терапии. Реализация терапевтических преимуществ современной молекулярной медицины будет зависеть от постоянного прогресса в технологии передачи генов.
Первый пошел: болезнь Гоше

Рисунок 3. Структура димера глюкозоцереброзидазы — фермента, уровень которого патологически снижается при болезни Гоше
В июле 2018 года журнал Nature Medicine опубликовал результаты исследования на мышах, проведенного под руководством Симона Уоддингтона (Simon Waddington) из лондонского Института женского здоровья. Результаты работы продемонстрировали эффективность фетальной генной терапии в лечении нейродегенеративных заболеваний и, в частности, болезни Гоше . Это самая частая форма среди редких наследственных ферментопатий, в основе которой лежит дефицит активности лизосомного фермента глюкозоцереброзидазы (рис. 3), обусловленный мутациями в гене глюкозилцерамидазы. В зависимости от характера мутаций, может развиваться тяжелая нейропатическая форма заболевания, манифестирующая с младенчества, или форма с более постепенным началом и менее выраженными симптомами. В то время как более легкие формы болезни Гоше хорошо поддаются заместительной терапии, тяжелая форма пока остается летальной. Признаки неизлечимой формы болезни Гоше появляются в первые месяцы жизни и включают прогрессирующую мышечную гипотонию, задержку и регресс психомоторного развития и другие неврологические признаки.
В ходе исследования Уоддингтон с соавторами продемонстрировал, что интракраниальное введение аденоассоциированного вирусного вектора 9 (AAV9) эмбриону мышей на 16 день гестации приводило к повышению экспрессии глюкозоцереброзидазы, что останавливало нейродегенерацию. При этом активность фермента в головном мозге была сравнима с таковой у здоровых мышей. Несмотря на то, что у больных грызунов все же диагностировался воспалительный процесс в головном мозге, они развивались достоверно лучше, чем мыши из группы контроля, которых пришлось усыпить через две недели после лечения из-за тяжести заболевания.
Мыши, подвергшиеся фетальной генной терапии, жили, по крайней мере, 18 недель, были фертильными и мобильными. Интересно, что введение вектора постнатально также облегчало течение заболевания, однако было менее эффективным, чем пренатальная экспрессия.
Поскольку AAV9 был способен проникать в мозг из кровотока, команда Уоддингтона провела еще один эксперимент, в ходе которого ввели значительно более высокую дозу вектора не в головной мозг, а непосредственно в кровь зародышей мышей. Мыши после экспрессии были в основном неотличимы от здоровых особей, но, поскольку по условиям эксперимента продолжительность их жизни составила только 55 дней, ученые не смогли сделать выводы о долгосрочной эффективности внутривенной генной терапии.
Эксперимент Уоддингтона стал самой сложной на сегодня работой, в ходе которой была проведена фетальная генная терапия у животных. Сегодня команда работает с корпорацией Apollo Therapeutics, объединившей усилия трех британских университетов и трех крупнейших фармацевтических компаний. Уоддингтон с коллегами преследуют новую цель: на сей раз перед ними стоит задача получить доклинические данные и потенциально протестировать лечение людей. И пока скептики размышляют над кругом возможностей применения фетальной генной терапии у человека, который может значительно сужаться из-за того, что болезнь Гоше не входит в пренатальные тесты, команда Уоддингтона уверенной поступью шагает в будущее. Будущее, где смогут выздоравливать дети с болезнью Гоше, миодистрофией Дюшенна, СМА и многими другими редкими, но сегодня, увы, неизлечимыми заболеваниями.
Лечение MLD
В отличие от других болезней лизосомного накопления, для MLD нет ферментозаместительной терапии (и вообще никакой одобренной специфической терапии).
Таким образом, большинство пациентов получает только симптоматическую терапию (например, противоэпилептические препараты в случае судорог, мышечные релаксанты или физиотерапию ), которая, хотя и облегчает их состояние, но не влияет на причину и патогенез болезни, и поэтому не сказывается на скорости ее прогрессии.
И тут на сцену выходит передовая терапия: подход, объединяющий две ипостаси advanced therapies — генную и клеточную терапии .
Логическое обоснование генной терапии для лечения болезней человека
 Концепция того, что передача генов может быть использована для лечения заболеваний, лежит в основе впечатляющих достижений последний двух десятилетий в области технологии рекомбинантной ДНК. У человека порядка 35 000 — 40 000 генов. Дефект практически любого гена может привести к появлению заболевания. Генная терапия человека предполагает введение скорректированного гена в ДНК пациента с целью замены отсутствующего или дефектного гена. С каждым днем мы все больше приближаемся к тому моменту, когда врачи смогут предугадать болезнь и ликвидировать ее причины вместо того, чтобы просто бороться с симптомами. Таким образом, текущие обширные медико-биологические исследования дают потенциальные возможности применения генной терапии для лечения болезней в будущем.
Концепция того, что передача генов может быть использована для лечения заболеваний, лежит в основе впечатляющих достижений последний двух десятилетий в области технологии рекомбинантной ДНК. У человека порядка 35 000 — 40 000 генов. Дефект практически любого гена может привести к появлению заболевания. Генная терапия человека предполагает введение скорректированного гена в ДНК пациента с целью замены отсутствующего или дефектного гена. С каждым днем мы все больше приближаемся к тому моменту, когда врачи смогут предугадать болезнь и ликвидировать ее причины вместо того, чтобы просто бороться с симптомами. Таким образом, текущие обширные медико-биологические исследования дают потенциальные возможности применения генной терапии для лечения болезней в будущем.
Как предполагают ученые, в ближайшее десятилетие молекулярная терапия в целом и генная терапия в частности будут использованы для лечения пациентов на индивидуальной основе. МЦ «Хадасса» взял на себя ведущую роль в развитии этой области медицины в Израиле.
У вас возникли вопросы? Обращайтесь к нам и получите ответ
по телефону: +972 2 560-97-99 (круглосуточно)
по электронной почте: ru-office@hadassah.org.il
или заполнив контактную форму
Роль института
В институте генной терапии им. Голдайн Савад работают первоклассные ученые с большими научными достижениями. Каждому из них предоставляются полная научная независимость и полная ответственность за свои научные разработки. Взаимный обмен идеями среди ученых института, а также с исследователями из других институтов и исследователями в различных дисциплинах, часто завершается важными научными открытиями и проектами.
Исследования
Исследовательская деятельность института покрывает широкий спектр заболеваний по трем основным направлениям: клеточная генная терапия, вирусные векторы и невирусные векторы. Кроме этого, институт вовлечен в разработку научно-исследовательских и биотехнологических инструментов для генной терапии, которые, как мы надеемся, помогут использовать генные технологии в клинических условиях.
Значительная часть исследований в институте проводится совместно с учеными из Еврейского университета, Института Вейцмана и с учеными других научно-исследовательских центров Израиля и всего мира. Таким образом, институт предоставляет среду, необходимую для взаимного обмена идеями и создания междисциплинарного сообщества исследователей, поддерживающих друг друга на всех этапах развития исследовательских проектов: на этапах замысла, начала исследований и разработки.
Использование результатов
Миссией института, согласно рекомендациям руководящего научного комитета и директора университетской больницы «Хадасса», является использование результатов лабораторных исследований для создания реальных методов лечения, которые могут быть полезны пациентам. Исследовательские лаборатории «Хадасса» являются неотъемлемой частью клинической больницы. Стратегическое расположение института позволяет передавать новые знания из лабораторий к пациентам и обратно в лаборатории.
Образование
Институт стремится подготовить новое поколение ученые, чтобы изучить общие элементы генных заболеваний и расширить концепции основ генетики на диагностику и лечение. Цель института не только предоставить образование будущим ученым, мы ожидаем, что наши выпускники тоже будут играть ведущие роли в области генной терапии. Институт обучает студентов, получающих степень магистра (M.Sc.) или доктора наук (Ph.D.).
Институт является крупным центром для научно-исследовательской подготовки студентов, выпускников, аспирантов и научных сотрудников. Например, в настоящее время в институте 28 студентов (выпускников и аспирантов), работающих с научными руководителями над различными исследовательскими проектами. Из-за пересечения областей научных интересов, все обучающиеся имеют возможность общаться друг с другом и с наставниками в рамках программы, представляющей широкий круг интересов в генной терапии, от базовых до прикладных – это позволяет студентам углубить и расширить свои знания.
Способы доставки в клетку генетической информации
Как показывают многочисленные исследования, использование различных вирусов является весьма эффективным решением, которое позволяет пробраться через имунную защиту организма, а затем инфицировать клетки, используя их для распространения вируса. Для осуществления данной процедуры, генные инженеры выбрали наиболее подходящие вирусы из группы ретровирусов и аденовирусов. Ретровирусы привносят генетическую информацию в виде рибонуклеиновой кислоты (РНК), молекулы, похожей на молекулу ДНК, которая помогает перерабатывать генетическую информацию, сохраненную в ДНК. Как только удается проникнуть вглубь так называемой клетки-мишени, из молекулы РНК получается копия молекулы ДНК. Данный процесс называется обратной транскрипцией. Как только новая молекула ДНК оказывается присоединенной к клетке, все новые копии клеток будут содержать этот модифицированный ген.
Аденовирусы несут генетическую информацию сразу в виде ДНК, который доставляется в неделящуюся клетку. Хотя эти вирусы доставляют ДНК непосредственно в ядро клетки-мишени, ДНК не совмещается с геномом клетки. Таким образом, модифицированный ген и генетическая информация не передаются дочерним клеткам. Преимуществом генной терапии, проводимой с помощью аденовирусов, заключается в том, что существует возможность введения генов в клетки нервной системы и в слизистую оболочку дыхательных путей, опять же, посредством вектора. Кроме того, существует и третий метод генной терапии, осуществляемый посредством так называемых аденоассоциированных вирусов. Эти вирусы содержат относительно небольшое количество генетической информации, и их гораздо сложнее вывести, чем ретровирусы и аденовирусы. Однако преимущество аденоассоциированных вирусов заключается в том, что они не вызывают реакции иммунной системы человека.
Примечания[править | править код]
- Только лишь соматических клеток — с точки зрения российского закона. В мире существует также генотерапия половых клеток (germline gene therapy)
- Rogers S, New Scientist 1970, p. 194
- . Life Sciences Foundation (21 июня 2011). Дата обращения 7 января 2014.
- (недоступная ссылка). Дата обращения 6 декабря 2008.
- (недоступная ссылка). Дата обращения 16 мая 2009.
- (недоступная ссылка). Дата обращения 16 мая 2009.
- (недоступная ссылка). Дата обращения 16 мая 2009.
- (недоступная ссылка). Дата обращения 16 мая 2009.
- Дина Файн Марон. Путь из мира безмолвия // В мире науки. — 2019. — № 1/2. — С. 142—150.
- (недоступная ссылка). Дата обращения 26 октября 2009.
- Алла Солодова. . Инфокс (27 июня 2011). Дата обращения 1 ноября 2011.
- (3 ноября 2012). Дата обращения 4 ноября 2012.
Неблагоприятные последствия экспрессии трансгенов
В случае успешной трансфекции и экспрессии трансгенов возникают новые проблемы. Как и с любым новым лекарственным средством, невозможно заранее предвидеть все возможные последствия генотерапии. Однако некоторые процессы вполне предсказуемы. Поскольку обычно трансфекция приводит к синтезу нового белка, возможна активация иммунной системы организма. Выраженный иммунный ответ может привести к инактивации секретируемого белка (как это происходит у больных гемофилией, получающих фактор VIII) или повреждению трансфицированных клеток. В некоторых случаях сама система доставки ДН К является иммуногенной, что было показано для аденовирусных векторов. Иммунный ответ на вектор снижает эффективность трансфекции, а при повторном введении вектора препятствует ей.
Таблица 5.1. Сравнение способов доставки трансгенов
|
Способ |
Емкость, тысячи нуклеотидов |
Спектр клеток-К- мишеней |
Длительность экспрессии |
Основные преимущества |
Основные недостатки |
|
Ретровирусы |
<8 |
Только делящиеся клетки |
Длительная |
Длительная экспрессия; низкая иммуно-генность |
Применим только для делящихся клеток; низкая эффективность трансфекции; сомнения в безопасности случайного встраивания в геном |
|
Аденовирусы |
<7,5 |
Большинство клеток |
Кратковременная |
Широкий спектр клеток-мишеней; заражает неделящиеся клетки; возможность получения высокой концентрации вектора; высокая эффективность трансфекции |
Кратковременная экспрессия; иммунный ответ организма |
|
Аденоассоцииро-ванные вирусы |
<5,2 |
Большинство клеток |
Длительная |
Широкий спектр клеток-мишеней; непатогенны и неиммуно-генны; длительная экспрессия |
Малая емкость; трудность получения высокой концентрации вектора и определения его титра |
|
Лентивирусы |
<8 |
Делящиеся и некоторые неделящиеся клетки |
Длительная |
Длительная экспрессия; заражает неделящиеся клетки |
Сомнения в безопасности вектора на основе ВИЧ; трудность получения |
|
Вирус простого герпеса |
20-30 |
Многие неделящиеся клетки, особенно нейроны |
Большая емкость |
Цитотоксичность; инактивация промотора |
|
|
Липосомы |
> 10 |
Большинство клеток |
Кратковременная |
Непатогенны; дешевы и просты в получении; безопасны |
Низкая эффективность; кратковременная экспрессия |
|
ДНК-белковые комплексы |
> 10 |
Большинство клеток |
Кратковременная |
Непатогенны; дешевы и просты в получении; безопасны |
Низкая эффективность; кратковременная экспрессия |
Причиной побочного действия может быть репродукция вирусного вектора. Значительные усилия направлены на разработку вирусных векторов, не способных к репродукции в клетках-мишенях. Для этого из вирусного генома удаляют некоторые гены, необходимые для репродукции (рис. 5.1). Чтобы получить такие вирусы в большом количестве, их приходится выращивать в культуре специальных линий клеток, восполняющих утраченные функции. Так получают ретровирусы, аденовирусы, аденоассоциированные вирусы и герпесвирусы, не способные к репродукции в обычных клетках. Однако этот подход не гарантирует полной потери способности вирусов к репродукции. Вирус может компенсировать потерю удаленных участков генома за счет неизвестных клеточных факторов или за счет рекомбинации с аналогичными дикими вирусами в организме больного. К счастью, последний феномен пока на практике не наблюдался.
Методы трансфекции клеток
Идеальная система доставки ДНК должна обеспечивать:
1) перенос молекул разной длины, 2) легкость получения в концентрированном виде и 3) избирательность по отношению к клеткам-мишеням. Кроме того, она должна гарантировать длительную экспрессию трансгенов, быть нетоксичной и неиммуногенной. Такая система пока не создана, а все существующие методы трансфекции in vivo имеют существенные недостатки. Сейчас разрабатываются несколько новых методов, основанных как на вирусных векторах, так и на невирусных способах доставки трансгенов. В табл. 5.1 сопоставлены особенности, преимущества и недостатки наиболее широко используемых методов.